Один из ключевых вопросов, связанных с происхождением метаболизма, в частности кодируемого белкового синтеза - это вопрос о том, что представляли собой наиболее древние каталитические системы, которые предшествовали появлению белковых катализаторов.
Специфическое аминоацилирование тРНК само по себе осуществляется в современных организмах с помощью белковых молекул - аминоацил-тРНК-синтетаз (АРСаз). Поэтому возникает вопрос - а как могло осуществляться аминоацилирование до того, как ГК окончательно сформировался? Ведь для специфического аминоацилирования в современных организмах необходимо наличие белковых катализаторов - АРСаз.
Кроме того, для формирования кодируемого пептидного синтеза необходимы также аминокислоты. Все опыты по моделированию абиогенного синтеза аминокислот показывают, что только небольшая часть аминокислот реально могла присутствовать как абиогенный их источник: это прежде всего глицин, аланин, валин и аспарагиновая кислота. Существенно также, что должны были синтезироваться оптические изомеры одного вида, а не их рацемическая смесь: разрешение данного вопроса становится возможным лишь в случае, если стереоспецифичный синтез аминокислот (имеющим результатом выход только L-аминокислот) осуществлялся с помощью стереоспецифичных же катализаторов.
Таким образом, уместным становится предположение о том, что биосинтез аминокислот и специфическое аминоацилирование должны были возникнуть до того, как сформировался кодируемый белковый синтез.
Итак, возникают три существенных вопроса, решение которых будет описано ниже в рамках представленной модели:
1) Как возник стереоспецифичный синтез аминокислот до того, как появились первые белковые ферменты, катализировавшие их синтез?
2) Каким образом стало возможно появление специфически аминоацилированных молекул РНК, на основе которых впоследствии возникли необходимые компоненты ГК - аминоацил-тРНК?
Кроме того ясно, что ГК мог сформироваться только при наличии соответствующих аминокислот, необходимых для биосинтеза белка.
Ответы на эти два животрепещущих вопроса будут представлены в данной статье. В представленной модели постулируется, что биосинтез многих, хотя и не всех аминокислот был возможен благодаря катализу очень коротких молекул РНК (возможно даже динуклеотидов), а специфически аминоацилированные молекулы возникли как раз в результате их биосинтеза на 3'(или 2'-)-конце олигонуклеотидов. Кроме того, представленная модель попутно объясняет необычные свойства самого ГК - связь первого нуклеотида кодона с путями биосинтеза аминокислот и связь второго нуклеотида кодона с некоторыми физико-химическими свойствами аминокислот.
В генетическом коде (ГК) существует поразительная связь свойств аминокислот со структурой первого и второго нуклеотидов в кодонах.
Первое поразительное свойство - связь путей биосинтеза аминокислот с первым нуклеотидом кодирующего его кодона.
Основные пути биосинтеза аминокислот. Какие пути могли быть наиболее древними?
Прежде, чем представить модель эволюционного происхождения древнего небелкового сайт-специфического аминоацилирования и увязать эту модель с древними путями биосинтеза аминокислот, рассмотрим современные пути биосинтеза аминокислот. Более подробная систематизированная информация о путях биосинтеза аминокислот на примере прокариот, осуществляющих синтез всех аминокислот, приведена в [Стейниер Р. и др. 1979].
Для начала отметим, что только одна аминокислота, гистидин, имеет совершенно независимое от других аминокислот биосинтетическое происхождение. Другие девятнадцать образуются из относительно небольшого количества промежуточных метаболитов, которые можно разбить изначально на 5 групп. Рассмотрим эти группы и попытаемся определить, какие из этих групп могли быть наиболее древними и сформироваться наиболее рано.
1. Группа щавелевоуксусной кислоты. Все аминокислоты образуются из аспартата, образуемого при переаминировании оксалоацетата.
Прежде всего отметим, что все аминокислоты по способам биосинтеза очень удобно разделить на четыре группы:
1) синтезируемые восстановительным прямым восстановительным аминированием α-кетокислот: глиоксалата, пирувата, оксалоацетата и α-кетоглутарата. Данный процесс обычно бывает сопряжён с обратимым дезаминированием глутамата (рис. 1).
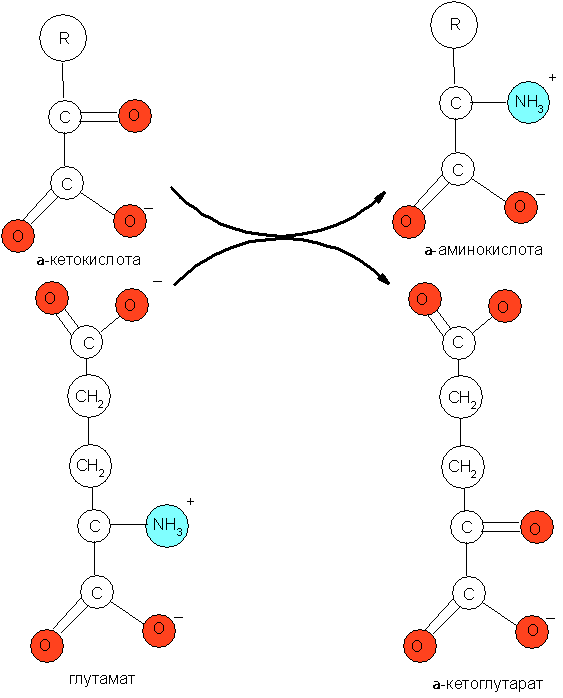
2) синтезируемые из оксалоацетата;
3) синтезируемые из пирувата;
4) синтезируемые из α-кетоглутарата.
Схематическое изображение связи продуктов цикла Кребса с путями 2)-4) биосинтеза аминокислот изображён на рис. 2:
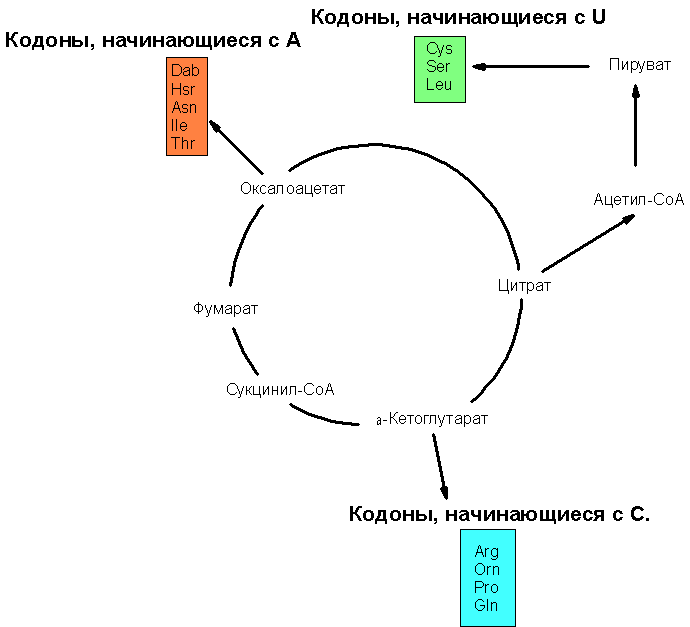
Рис. 2. Связь интермедиатов цикла Кребса с путями биосинтеза некоторых аминокислот. На данной схеме представлены не только 14 (из 20 возможных канонических аминокислот), но и 3 неканонические аминокислоты, являющиеся предшественниками в биосинтезе некоторых канонических аминокислот. Обозначения: Dab – 2,4-диаминобутират; является Hsr - гомосерин (является предшественником в биосинтезе треонина), Orn - орнитин - (является предшественником в биосинтезе аргинина).
Примечательно, что все эти пути биосинтеза аминокислот напрямую привязаны к продуктам цикла трикарбоновых кислот (окислительного или восстановительного), что даёт основание рассматривать этот цикл как один из самых древнейших (см. подробнее Как мог выглядеть архаичный метаболизм?).
Если кодоны начинаются с С, кодируют аминокислоты, синтезируемые из α-кетоглутарата, если с А – то из оксалоацетата, если из U – то из пирувата.
Если с G, то аминокислоты могут быть образованы прямым восстановительным аминированием α-кетокислот: глицин, аланин, аспартат и глутамат могли быть получены восстановительным аминированием из глиоксалата, пирувата, оксалоацетата (ОАА) и α-кетоглутарата (α-KG), соответственно. Эти корреляции особенно потрясающи в свете большого структурного разнообразия аминокислот, имеющих общее первое основание в кодоне.
Этот факт становится ещё более впечатляющим, если учитывать прямую связь гидрофобности со вторым основанием в кодоне [Taylor F.J.R, Coates D. 1989].
Кодоны с корнем U являются наиболее гидрофобными, тогда как кодоны с корнем A являются наиболее гидрофильными.
Эти два типа корреляций можно объяснить, если предположить, что перед появлением макромолекул простые аминокислоты могли синтезироваться из α-кетокислотных предшественников, ковалентно связанных с динуклеотидами, катализирующих реакции, необходимые для синтеза аминокислот (рис. 3).
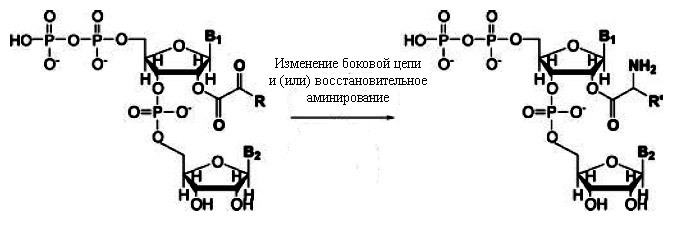
Рис. 3. Модель синтеза аминокислот из α-кетокислотных предшественников, прикреплённых к динуклеотидам. Предполагается, что этот прикреплённый динуклеотид, предопределил первые два нуклеотида кодона будущего генетического кода. Рисунок взят из [Copley S.D. et al. 2005] с небольшими изменениями.
Недавно было показано, что восстановительный цикл трикарбоновых кислот может быть простым автокаталитическим самодостаточным источником для простых α-кетокислот [Smith E., Morowitz H. J 2004]. Подробней о восстановительном цикле трикарбоновых кислот изложено в статье Реликтовые составляющие современного метаболизма. С чего он мог начаться?. Глиоксалат, пируват, оксалоацетат и α-кетоглутарат. α-кетокислоты могут также синтезироваться через путь CoA [Lengeler,J. et al. 1999].
Большинство простых аминокислот могут быть синтезированы из α-кетокислотных предшественников не более, чем за три простых химических трансформаций.
В рамках данной модели предполагается, что тип химических преобразований, происходящих при синтезе аминокислота из α-кетокислотных предшественников, определяется типом динуклеотида.
Пример серии реакций, ведущих от α-кетокислотных предшественников, прикреплённых к соответствующим динуклеотидам, показан на рис. 4
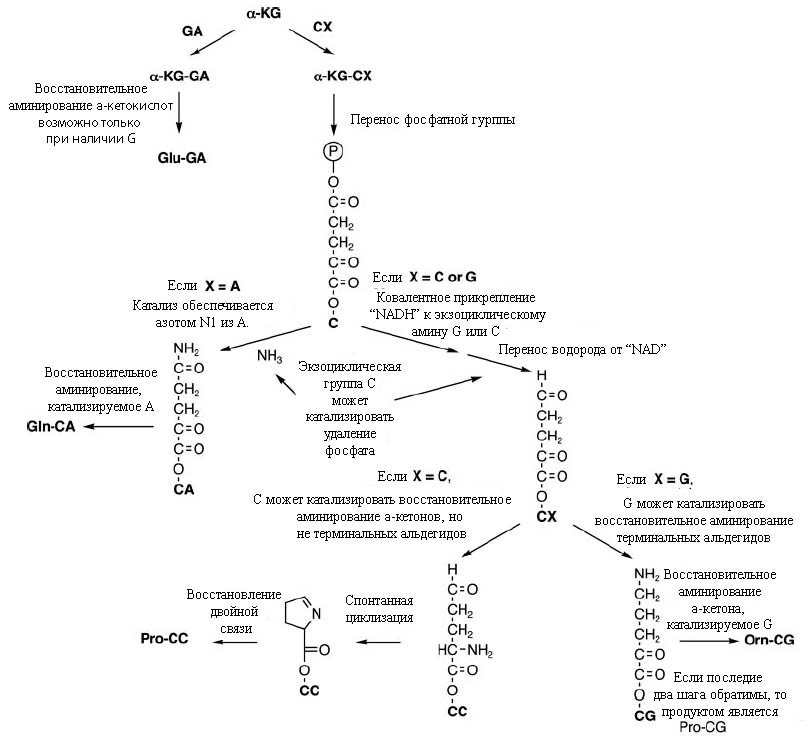
Рис. 4. Прикрепление α-кетоглутарата к динуклеотидам, начинающимся в G или С, приводит к синтезу аминокислот. Постулируется, что при прикреплении этого вещества к А или U могут получаться только тупиковые продукты. Обозначения: α-KG –α-кетоглутарат, Orn – аминокислота орнитин (впоследствии была заменено аргинином). Рисунок взят из [Copley S.D. et al. 2005] с небольшими изменениями.
Предложенный путь синтеза аминокислот соответствует пути синтеза в современных организмах: современный биосинтез аминокислот возник в результате постепенного приобретения макромолекул, способных катализировать аналогичные пути биосинтеза аминокислот в пребиотических системах, в отсутствие макромолекул.
Согласно биохимической (коэволюционной) модели возникновения ГК структурная и биохимическая сложность таких аминокислот, как Trp (UG), Tyr (UA), Phe (UU), Lys (UU), His (AU) и Met (AU) даёт основания считать, что эти аминокислоты были включены в ГК только на поздних стадиях его формирования.
14 оставшихся аминокислот могут быть специфицированы на основе дублетного генетического кода, в котором дублеты соответствуют основам кодонов современного ГК.
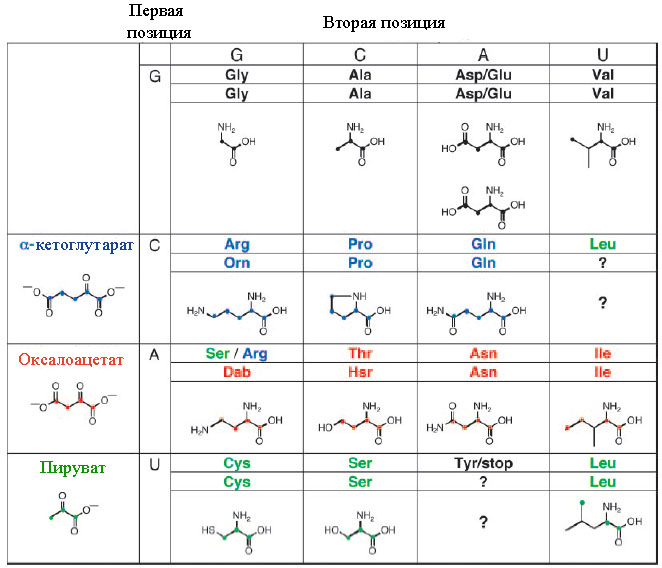
Рис. 5. Гипотетический предковый дублетный ГК, предопределённый динуклеотидами, участвующими в биосинтезе кодируемых дублетами аминокислот.
Обозначения: Dab – 2,4-диаминомасляная кислота, Hsr - гомосерин. Рисунок взят из [Copley S.D. et al. 2005] с небольшими изменениями.
Как видно из рис. 5, для аспартата и глутамата для динуклеотида GA дублетный код проявляет неоднозначность ввиду предполагаемой большой структурной схожести. Дискриминация этих аминокислот в кодировании могла возникнуть позднее.
Далее предполагается, что аргинину предшествовала метаболически более простая аминокислота орнитин (Orn), а треонину – гомосерин (Hsr), являющиеся метаболическими предшественниками данных аминокислот в современных организмах.
Захват серином и аргинином кодонов с основами AG, а также лейцином кодонов с основой CU вероятно отражает кодоновые перестройки, происходившие на этапе уже непосредственного формирования кодируемого пептидного ситеза.
Так как серин синтезируется из пирувата, то U, а не А должно быть первым основанием в динуклеотиде, определившем древний дублетный код. Действительно, 4 из 6 кодонов в современном ГК начинаются с U. Аналогично, аргинин синтерируется из α-KG, которому кодоне соответствует первый нуклеотид C, и 4 из 6 аргининовых кодонов начинаются именно с C.
Таким образом, получается, что именно динуклеотид AG в современном коде неканонически соответствует метаболическим предшественникам аргинина и серина.
Модель катализа аминокислотного биосинтеза динуклеотидами.
В предложенной модели предполагается участие в катализе 2'-гидроксила 5'-нуклеотида (см. рис. 1), который участвует в реакции эстерификации α-кетокислотами. Возможность осуществления реакции эстерификации 2’-гидроксила динуклеотидов демонстрируется рядом работ.
Только три типа реакций требуются для превращения α-кетокислотных предшественников в 15 аминокислот, показанных на рис. 3.
1.Восстановительное аминирование пирувата, глиоксалата, ОАА и α-KG, дающих начало глицину, аланину,аспартату и глутамату, соответственно.
2.Фосфорилирование пирувата, ОАА и α-KG, ведущее к серину, цистеину, гомосерину,2,4-масляной кислоте, аспарагину, орнитину, пролину и глутамину.
3.Декарбоксилирование пирувата и последующая рекация с пируватом или с α-KG, ведущая к валину, лейцину и изолейцину.
Пути, требующие только восстановительного аминирования α-кетокислот.
Аминокислоты, кодоны которых начинаются с G, синтезируются восстановительным аминированим α-кетокислот. Сам катализ может экзоциклической аминогруппой гуанина первого нуклеотида (см.рис. 4) и экзоциклической аминогруппой аденина, гуанина или цитозина второго нуклеотида. Атака экзоциклического амина гуанина на карбонил прикреплённой α-кетокислоты облегчается образованием водородной связи между карбонилом кислорода и экзоциклической аминогруппы второго основания динуклеотида. После атаки NH3 образуется основание Шиффа (так называются замещённые имины с общей формулой R1R2C=NR3), в котором результирующий имин восстанавливается (условно на рис. 6 показано присоединением “H2”.), что было экспериментально продемонстрировано [Papoulis A.et al. 1995].
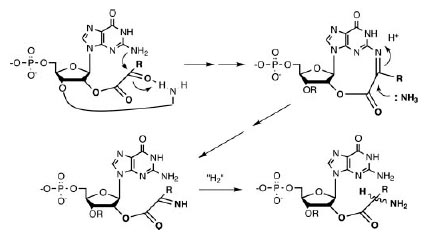
Рис. 6. Восстановительное аминирование α-кетокислот, ковалентно прикреплённых к гуанину в первой позиции динуклеотидов. Восстановление на заключительной стадии условно показано присоединением “H2”. Кривая линия в первой структуре и “R”в последующих структурах условно обозначает второй нуклеотид динуклеотида. Рисунок взят из [Copley S.D. et al. 2005]
Примечательно, что именно гуанин, а не другие канонические азотистые основания, содержит экзоциклический амин в позиции, доступной для α-кетокислот в позиции 2’.
Дальнейшие химические реакции не происходят в случае гицина и аланина, так как эти аминокислоты не имеют реактивных частей. Вслучае аспартата и глутамата потенциально возможно фосфорилирование карбоксильной группы. Возможно, что образование водородной связи между карбоксильной группой аспартата и глутамата и экзоциклическим амином аденина игуанина препятствует фосфорилированию.
Пути, начинающиеся с переноса фосфорильной группы.
Синтез многих аминокислот начинается с фосфорилирования пирувата, ОАА и α-KG, ведущее к серину, цистеину, гомосерину, 2,4-диаминомасляной кислоте, аспарагину, орнитину, пролину и глутамину.
В рамках предложенной модели предполагается, что перенос фосфорильной группы происходит из 5’-позиции первого нуклеотида (см. рис. 6). Переходное состояние может стабилизироваться атакой азотисных оснований на фосфорил, который поляризуется и приобретает отрицательный заряд, облегчающий расщепление связи P-O.
В случае α-KG водородная связь между экзоциклическим амином цитозина (рис. 7A) и кислородом β-фосфата может ускорять реакцию фософорилирования соответствующей ориентацией фосфата и увеличением электофильности фосфора.
Формирование сравнимой водородной связи для экзоциклического амина аденина затруднено, однако при соответствующей ориентации азотистого основания возм ожно образование водородной связи между гироксилом β-фосфата и N7-атомом аденина (рис. 7B). Это взаимодействие должно меньше влиять на электрофильность фосфора и возможно быть менее эффективным по сравнению сдействием экзоциклического амина цитозина.
Урацил не имеет экзоциклического амина. Его N3 может служить донором протона и требует для взаимодействия неблагоприятной syn-ориентации по отношению к основанию рибозы и, таким образом, взаимодействие β-фосфата с С2-карбонилом становится неэффективным (рис. 7С).
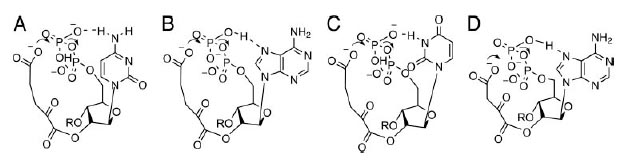
Рис. 7. Потенциальные взаимодействия между нуклеотидами и переходные состояния для переноса фосфорила из 5’-β-фосфатана карбоксильную группу α-KG (A-C) и ОАА (D). Рисунок взят из [Copley S.D. et al. 2005]
Таким образом, ожидаемый порядок реактивности β-фосфата с С2-карбонилом следующий: С>А>U.
Если второе основание G,C или A, то взаимодействие между экзоциклической аминогруппой и α-фосфатом может также способствовать расщеплению P-O-связи. Таким образом, потенциально в реакции фосфорилирования могут принимать участие оба основания, но специфичность взаимодействия в первую очередь обеспечивается взаимодействием первого основания.
Аналогичный анализ для оксалоацетата показывает, что перенос фосфорила легче всего происходит, когда первым основанием динуклеотида является аденин. В этом случае гидроксил на β-фосфате формирует водородную связь с N7-аденина (рис. 5D). В отличие от α-KG взаимодействие между экзоциклическим амином цитозина и β-фосфатом невозможно ввиду более короткой алкильной группы у ОАА по сравнению с α-KG. Взаимодействие с урацилом является неблагоприятным для ОАА по той же причине, что и для α-KG.
Таким образом, ожидаемый порядок реактивности β-фосфата с С2-карбонилом следующий: A>C, U.
Первый шаг в синтезе серина ицистеина является фосфорилирование пирувата до фосфоенолпирувата (PEP). Образуемое вещество также является необходимым для синтеза сахаров. Возможный механизм образования PEP изображён на рис. 7. Предполагаемая реакция происходит в два шага: сначала с помощью Mg2+ стабилизируется енолат, который затем атакует β-фосфат (стабилизация енолатов металлами является распространённым явлением в белковом катализе).
Примечательно, что единственный донор водорода у урацила расположен между двумя карбонилами, которые могут отталкиваться от кислородов фосфатов. Этот факт означает запрет образование пирувата динуклеотидом UU. Действительно, этот динуклеотид связан с совсем другим синтетическим путём.
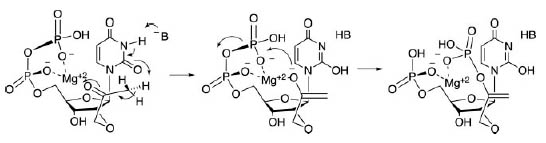
Рис. 7. Потенциальный механизм образования PEP, катализируемый UpU. Рисунок взят из [Copley S.D. et al. 2005].
Пути биосинтеза аминокислот, начинающиеся с декарбоксилирования пирувата.
Пути синтеза аминокислот с разветвлённой боковой цепью – валина, лейцина и изолейцина – начинаются с более сложной серии реакций. Их синтез начинается с декарбоксилирования одной молекулы пирувата, за которой следует нуклеофильная атака другой молекулы пирувата для валина и лейцина, или α-KG для изолейцина. Примечательно, что урацил находится во второй позиции кодонов для каждой из этих аминокислот. Этот факт может означать прямое взаимодействие этих гидрофобных аминокислот с уридином во второй позиции динуклеотидов.
В современных организмах декарбоксилирование пирувата происходит с участием тиамин-пирофосфата. В рамках рассматриваемой модели предполагается, что урацил мог служить примитивным кофактором для выполнения аналогичной реакции. Авторы модели детально рассмотрели возможный механизм синтеза 2-ацетолактата из двух молекул пирувата, катализируемый динуклеотидом UU из [Copley S.D. et al. 2005], который мы не будем здесь рассматривать.
Примеры современного биосинтеза аминокислот, ковалентно связанных с РНК.
В настоящее время известно три примера биосинтеза аминокислот, ковалентно связанных с тРНК:
1. Синтез аспарагина из аспаратата.
2. Синтез глутамина из глутамата.
3. Синтез цистеина из фосфосерила, когда фосфосериловая АРСаза переносит фосфосерил на цистеиновую тРНК с образованием фосфосерил-тРНК- интермедиата для образования цистенил-тРНК у некоторых метаногенных архей [Sauerwald A. et al. 2005].
РНК-олигонуклеотидный мир - предшественник РНК-белокового мира.
Классическая концепция самодостаточного РНК-мира, как живых систем, в которых все основные катализаторы кодировались в виде последовательностей РНК-нуклеотидов имеет ряд очень серьёзных, по видимому практически непреодолимых трудностей. Дело в том, что РНК-молекула, как кодирующая матрица имеет очень высокий мутабильный фон, создающий препятствия для геномов, которые бы были достаточно большими, чтобы кодировать все ферменты минимального метаболизма РНК-организмов. Это прежде всего касается метаболизма синтеза самих РНК-нуклеотидов, а также их метаболических предшественников - аминокислот и интермедиатов промежуточного метаболизма (например, продуктов цикла Кребса).
Ситуация существенно усложняется, если представить, что на базе такого РНК-мира должен был возникнуть кодируемый белковый синтез. В этом случае к пулу минимального набора ферментов следует ещё добавить различные типы тРНК и АРСаз.
Во всех соверменных вирусах длина кодирующей части молекул РНК не превышает нескольких тысяч нуклеотидов. Это означает, что реально молекулы РНК могут стабильно кодировать максимально порядка один или несколько десятков катализаторов. Если бы современные РНК-вирусы имели размер значащей части генома больше 10 тысяч нуклеотидов, то практически каждый потомок вируса имел бы летальную мутацию.
Рассматривая модель биосинтеза аминокислот, можно увидеть, что в наиболее древних ЖС возможен и другой тип наследственности, осуществляемый не через копирование полимерной молекулы нуклеиновой кислоты, а через последовательный синтез относительно более простых в биосинтетическом отношении интермедиатов промежуточного метаболизма и очень коротких олигонуклеотидов (мономеров, димеров и возможно больших по размеру олигонуклеотидов) в автокаталитических циклах.
Заключение.
Эволюцию ГК невозможно рассматривать вне связи с синтезом аминокислот. Предложенная модель предполагает древний синтез аминокислот из α-кетокислот, ковалентно связанных с динуклеотидами. Данная модель объясняет факт существования связи биохимических путей синтзеаз аминокислот с первым нуклеотидом кодона, а также регулярность свойств аминокислот со вторым основанием в кодоне.
Кроме того, факт синтеза аминокислот, ковалентно связанных с динуклеотидами, частично также решают вопрос древнего аминоацилирования тРНК в отсутствие белковых АРСаз. В настоящее время экспериментально подтверждена возможность РНКовых ферментов катализировать аминоацилирование тРНК, но только при условии наличия активированных аминокислот, которые связаны с АМP. В предложенной модели предполагается наличие уже активированных форм аминокислот, которые могли передаваться древним тРНК путём специфической трансэтерефикации (переноса аминокислоты от динуклеотида к тРНК). Специфичность данного процесса была обусловлена как раз комплементарным спариванием.
Предложенная модель также подразумевает наличие в пребиотических системах α-кетокислот, наличие которых могло обеспечиваться автокаталитическими циклами, которые по своей сути представляли другой тип наследования, условно обозначенный как конформационный. Подробнее о происхождении этого цикла будет написано в одной из следующих статей.
Литература.
1. Стейниер Р., Эдельберг Э., Ингрэм Дж. Мир микробов. Т.1. (Перевод с англ. под ред. Е.Н Кондратьевой и С.В. Шестакова). "Мир", Москва, 1979.
2. Copley S.D., Smith D.E., and Morowitz H.G. A mechanism for the association of aminoacids with their codons and the origin of the genetic code. // Proc. Natl.Acad. Sci. USA 2005. V.102. P.4442-4447.
3. Lengeler J., Drews G., Schlegel, H.(1999) in Biology of the Prokaryotes (Blackwell,Oxford), p. 165.].
4. Papoulis A., Al-Abed Y., Bucala R. Identification of N2-(1-Carboxyethyl)guanine (CEG)as a Guanine Advanced Glycosylation End Product, // Biochemistry. 1995. V.34. P.648–655.
Sauerwald A. et al. RNA-dependent cysteine biosynthesis in archaea. // Science. - 2005. - V.307. P.1969–1972.
Smith E., Morowitz H. J. Universality inintermediary metabolism. // Proc. Natl. Acad. Sci. USA. 2004. V.101. P.13168-13173.
Статьи, связанные с темой:
Автотрофное термофильное происхождение жизни
Биохимическая (коэволюционная) модель эволюции генетического кода
Как мог выглядеть архаичный метаболизм?
Реконструирован древний генетический код
Реликтовые составляющие современного метаболизма. С чего он мог начаться?
