СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ
Структура нуклеиновых кислот
Нуклеиновые кислоты представляют линейные полимеры нуклеозидмонофосфатов, то есть полинуклеотиды. Нуклеотиды построены из трех компонентов: пиримидинового или пуринового основания, пентозы и фосфорной кислоты. Нуклеотиды связаны между собой в цепь фосфодиэфирной связью. Она образуется за счет этерификации ОН — группы С—З- пентозы одного нуклеотида и ОН — группы фосфатного остатка другого нуклеотида. В результате один из концов полинуклеотидной цепи заканчивается свободным фосфатом (Р—конец или5-—конец). На другом конце цепи имеется неэтерифицированная ОН — группа у С—З- пентозы (З- — конец).
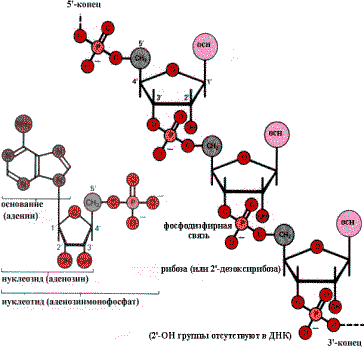
Типичный нуклеотид (АМР)
Структура полинуклеотидной цепи
Первичная структура нуклеиновых кислот определяется как последовательность нуклеотидных остатков в полимерной цепи. Многообразие молекул DNA и RNA объясняется их первичной структурой. Как многие другие биополимеры, нуклеиновые кислоты имеют ещё и вторичную структуру, под которой понимают их пространственную организацию.
Вторичная структура
DNA Молекула DNA представляет собой правозакрученную спираль, состоящую из двух полинуклеотидных цепей с антипараллельным ходом. Это означает, что 3-—концу одной цепи соответствует 5-—конец другой цепи и наоборот.
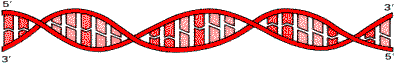
Структура двойной спирали DNA
Остатки оснований направлены внутрь спирали. На один виток спирали приходится 10 пар оснований. Цепи DNA не идентичны, так как нуклеотидный состав их различен, однако первичная структура одной цепи предопределяет нуклеотидную последовательность другой цепи, то есть они комплементарны друг другу. Это связано с существованием комплементарных пар оснований.
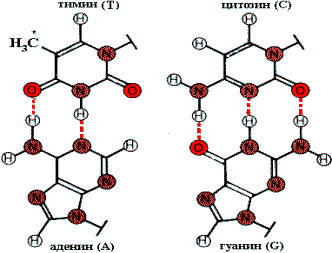
Комплементарные пары оснований. *СН3—группа в тимине (Т) замещается на H в урациле (U).
Физико—химическую основу комплементарности составляют водородные связи, которые могут образоваться только между аденином одной цепи и тимином другой, противоположно направленной цепи (пара А—Т), и аналогично между гуанином и цитозином (пара G—C). Вторичная структура RNA несколько иная. Молекула RNA состоит из одной полинуклеотидной цепи. Отдельные участки этой цепи (до 20—30 нуклеотидных пар) могут быть комплементарны между собой и образовывают спиральную структуру за счет связей между аденином и урацилом (пара A—U) и гуанином и цитозином (пара G—C). Между спирализованными участками располагаются одноцепочечные петли. Существует несколько разновидностей RNA: матричная (mRNA), транспортная (tRNA), рибосомная (rRNA). На рисунке приведена структура tRNA, у которой спирализованные участки определяют специфическую пространственную конформацию: фигуру Lклеверного листа¦.
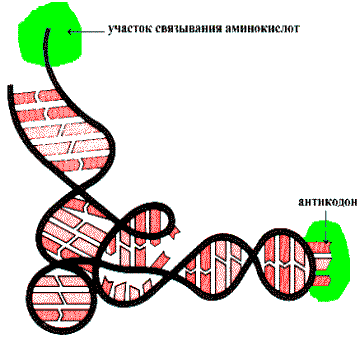
Трехмерная пространственная структура транспортной RNA
tRNA имеет на 3-—конце ССА для связывания аминокислоты, а в средней части молекулы — антикодоновый участок — последовательность нуклеотидов, обеспечивающую взаимодействие tRNA с кодоном mRNA.
Денатурация и ренатурация DNA
Вторичная структура DNA стабилизируется лишь слабыми водородными и гидрофобными связями, следовательно, DNA способна к денатурации (плавлению) при повышении температуры до 80—90о и ренатурации при последующем охлаждении.
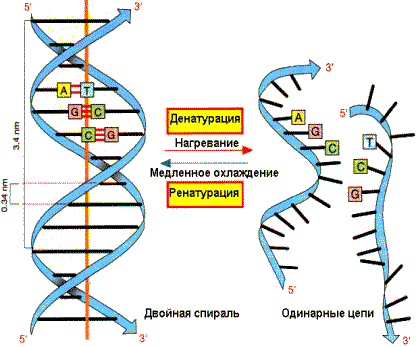
Денатурация и ренатурация DNA
При денатурации двухспиральная молекула DNA разделяется на отдельные цепи. Температура, при которой 50% DNA денатурировано, называется температурой плавления и зависит от качественного состава DNA. Так как пары G—C стабилизированы тремя водородными связями, а пары А—Т только двумя, то чем выше доля G—C пар, тем стабильнее молекула. При денатурации DNA поглощение света при длине волны 260 нм повышается (гиперхромный эффект), что позволяет легко контролировать состояние вторичной структуры DNA. Если раствор денатурированной DNA медленно охлаждать (отжиг), то вновь возникают слабые связи между комплементарными цепями и может получиться спиральная структура, идентичная исходной (нативной). На способности DNA к денатурации и ренатурации основан метод молекулярной гибридизации, который применяют для изучения строения нуклеиновых кислот. Препараты DNA, выделенные из особей, принадлежащих к разным видам, образуют несовершенные гибриды. Спиральная структура получается не по всей длине молекулы. В неспирализированных участках полинуклеотидные цепи не комплементарны друг другу. Следовательно, DNA особей неидентична.
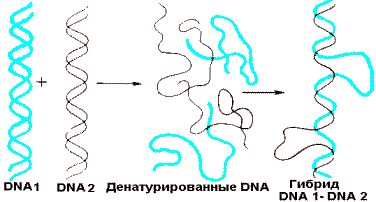
Гибридизация DNA
Нуклеазы
Нуклеиновые кислоты гидролизуются под действием нуклеаз —DNAазы и RNAазы. Гидролиз может быть внеклеточным или внутриклеточным (специфическое функциональное расщепление).
Рестрикционные нуклеазы (рестриктазы)
Бактерии продуцируют набор нуклеаз, которые разрезают нити DNA в определенных сайтах. Эти сайты представляют собой определенную последовательность нуклеотидов, читаемую одинаково в обоих направлениях. Примеры последовательностей, узнаваемых E. coli, Bacillus amyloliquefaciens показаны на рисунке:
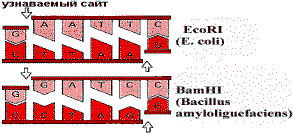
Примеры сайтов, узнаваемых рестрикционными нуклеазами
Разные рестриктазы узнают разные последовательности. Рестриктазы бактерий участвуют в защите от чужеродной DNA, но, кроме того, они используются при изучении первичной структуры DNA. Молекула DNA животных и человека имеет огромные размеры: 130 млн. нуклеотидных пар имеют длину около четырех сантиметров. Такие молекулы неудобны для исследования. С помощью набора рестриктаз, узнающих разные последовательности, можно разрезать молекулу DNA на фрагменты желаемой длины, удобной для исследования.
Структурная организация хроматина
В состав хроматина входят DNA и гистоны — белки с высоким содержанием лизина и аргинина. Предполагается, что аминогруппы радикалов этих аминокислот взаимодействуют с кислотными группами DNA. Цепи DNA обвивают глобулу гистонов, образуя четковидную структуру нуклеосом, которые связаны между собой линкерной цепочкой DNA. В дальнейшем эти нуклеосомы упаковываются в крупные хроматиновые структуры, благодаря чему достигается компактная их укладка в хромосомах.
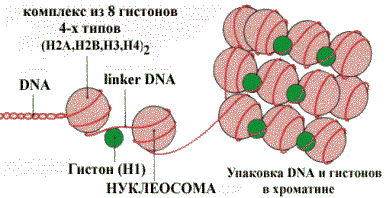
Упаковка DNA и гистонов с образованием хроматина
Поток информации от DNA к структуре белка
Нуклеиновые кислоты и белки называют информационными молекулами, так как в чередовании их мономеров заложен определенный смысл. Последовательность нуклеотидов в DNA определяет структуру всех белков клетки. Участки DNA, кодирующие определенные белки (гены), копируются (транскрибируются) в виде полинуклеотидной цепи матричной RNA (mRNA), которая затем служит матрицей для синтеза белка. Таким образом, генетическая информация, записанная в DNA(в генотипе) обеспечивает образование фенотипических признаков клетки, то есть генотип трансформируется в фенотип. Это направление потока информации включает три типа матричных синтезов:
- синтез DNA — репликация
- синтез RNA — транскрипция
- синтез белка — трансляция.
Репликация DNA
Репликация DNA (воспроизведение генотипа) происходит по полуконсервативному механизму. Каждая нить двойной спирали выступает в роли матрицы для синтеза новой цепи. Следовательно, вновь образованные двухспиральные молекулы состоят из одной Lновой¦ и одной Lстарой¦ цепи.
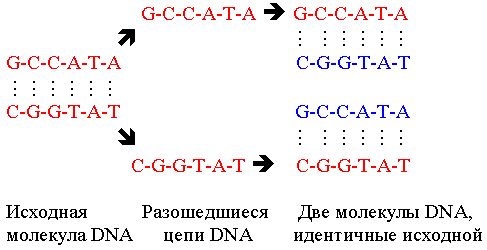
Полуконсервативный механизм репликации DNA
Субстратами синтеза являются дезоксинуклеозидтрифосфаты, выполняющие роль строительного материала и источников энергии. Для репликации DNA необходим большой набор разнообразных ферментов и белков — репликативный комплекс. Далее будет описана функция основных компонентов этого комплекса. Белки, раскручивающие спираль DNA, и белки, стабилизирующие разделенные нити DNA. В результате действия этих белков образуется репликативная вилка — участок DNA, в пределах которого спираль раскручена и разделена на отдельные цепи. DNA—полимераза обеспечивает включение в растущую Lновую¦ цепь нуклеотидов комплементарных Lстарой¦, то есть матричной цепи. DNA—полимераза не способна начинать синтез новой цепи с ее первого нуклеотида. Она может удлинять уже имеющуюся цепь, поэтому для начала реакции требуется затравка (праймер), которая представляет собой короткий полинуклеотид, комплементарный матричной цепи DNA. Фермент присоединяется к матричной цепи DNA и к праймеру в области3-—концевого нуклеотида праймера. Перемещаясь по матрице в направлении ее 5-—конца, DNA—полимераза удлиняет затравку, присоединяя к ней один за другим нуклеотиды. Одноцепочечная затравка — праймер синтезируется при участии DNA— зависимой RNA—полимеразы (праймазы). Синтез новых цепей DNA может протекать только в направлении 5- à 3-. Таким образом, на одной цепи DNA синтезируется непрерывно Lлидирующая¦ цепь, а на другой образуются короткие фрагменты— Lзапаздывающая¦ цепь. Затем последовательность праймера удаляется и образовавшийся промежуток заполняется с помощьюDNA—полимеразы.
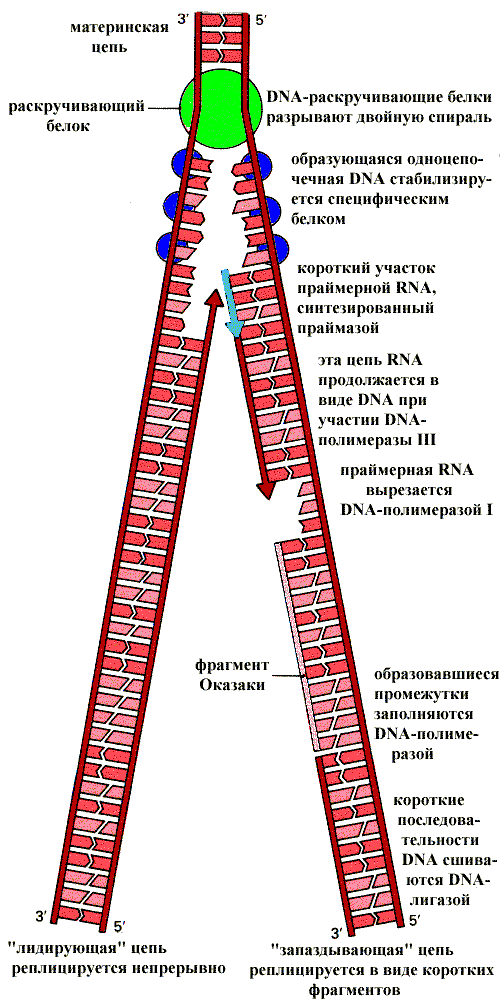
Репликация DNA
DNA—лигаза способна сшивать полученные короткие фрагменты, после чего формируется новая двухспиральная молекула DNA.
Репарация DNA
Поврежденные участки DNA или ошибочно встроенные нуклеотиды удаляются в результате действия специальных эндо — и экзонуклеаз.
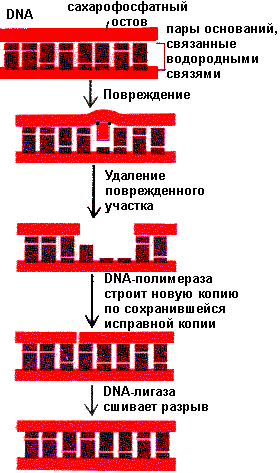
Репарация DNA
Образующиеся промежутки заполняются с помощью DNA—полимеразы и затем сшиваются лигазами с исходной нитью DNA. Причинами, вызывающими повреждение DNA может быть действие факторов окружающей среды: ультрафиолетовое и ионизирующее излучение, определённые химические соединения.
Синтез RNA—транскрипция
Молекула DNA, хранящая генетическую информацию, непосредственного участия в синтезе белка не принимает, но с нее по мере необходимости считывается информация, то есть специфические участки DNA копируются (транскрибируются) в виде RNA с последующей трансляцией в полипептидную цепь белка. Транскрипция, как и репликация DNA, — эндоэргический процесс, сопряженный с использованием нуклеозидтрифосфатов в качестве субстратов и источников энергии.
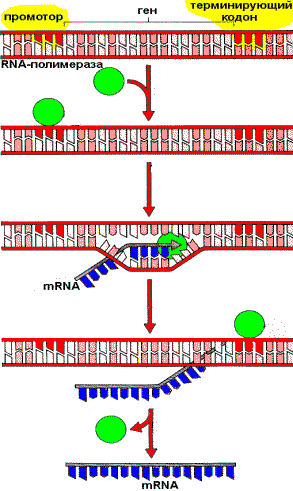
Транскрипция DNA с образованием mRNA
RNA—полимераза катализирует синтез всех типов RNA. Особенностью действия этого фермента является то, что он предварительно Lузнает¦ ту часть DNA, которую необходимо транскрибировать, и присоединяется к ней. Участок, с которым связывается RNA—полимераза, называется промотором. Последовательность оснований по ходу цепи DNA ниже сайта промотора с направлением 3- à 5- используется в качестве матрицы для синтеза RNA. Другая цепь остается нетранскрибируемой. RNA—полимераза вместе с растущей цепью RNA перемещается по матрице, пока не достигнет терминирующего кодона. В эукариотической DNA информация, необходимая для синтеза белка хранится на участках — экзонах, разделенных интронами — участками не содержащими генетической информации (некодирующие участки). При транскрипции гена сначала образуется первичный транскрипт, который затем подвергается Lдоработке¦ — процессингу. Суть доработки заключается в вырезании интронов (сплайсинг) из mRNA перед трансляцией и в присоединении характерных для mRNA концевых последовательностей.
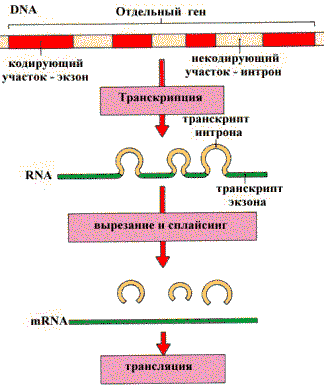
Удаление интронов из mRNA
Синтез белка — трансляция генетической информации
Синтез белка сводится не к переписыванию информации, а к переходу от одной системы информации (нуклеотидная последовательность — четырехбуквенный язык) к другой (аминокислотная последовательность — двадцатибуквенный язык). Это объясняет, почему третий матричный синтез называют трансляцией. В основе передачи информации лежит биологический код — своеобразный словарь для перевода. Он имеет следующие особенности. Код специфический, потому что триплеты нуклеотидов (кодоны) mRNA кодируют каждый одну аминокислоту. Так как нуклеиновые кислоты состоят из комбинации четырех нуклеотидов, то существуют 64 различных триплета, кодирующих 20 аминокислот, поэтому код называется вырожденным. Например, аминокислота серин кодируется триплетами UCU, UCC, UCA, UCG, AGC. Часто при изменении третьего нуклеотида кодона аминокислота не изменяется, что объясняется его меньшей значимостью для трансляции по сравнению с первыми двумя основаниями. Генетический код непрерывный, неперекрывающийся и по существу универсальный — за редким исключением все организмы используют один и тот же код.
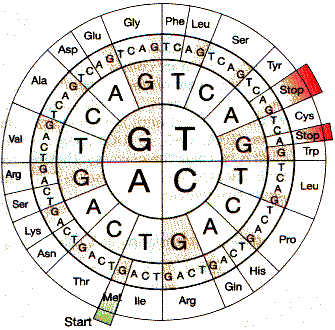
Биологический код (последовательность нуклеотидов кодона считывается от центра к периферии)
Аминоацил—tRNA —cинтетаза и расшифровка кода
Наиболее приспособлена к роли молекулы для расшифровки — tRNA, так как она может служить адаптером между триплетами нуклеотидов на mRNA и соответствующими им аминокислотами. Выполнение адаптерной функции становится возможным после связывания tRNA с определенной аминокислотой. Взаимное узнавание аминокислоты и tRNA происходит с помощью фермента — аминоацил—tRNA—синтетазы. Этот фермент узнает и связывает tRNA, а затем переносит аминокислотный остаток на 3-—ОН группу концевого аденозина, присоединяя ее сложно — эфирной связью: аа—tRNA—синтетазы + аминокислота + tRNA+ ATP à аминоацил—tRNA + АМР + Н4Р2О7 Взаимодействие аа—tRNA с кодоном mRNA обеспечивается тем, что в одной из петель молекулы tRNA имеется триплет нуклеотидов — антикодон, комплементарный определенному кодону mRNA. Рибосомы — это частицы, на которых происходит синтез белка. Рибосомы прокариот имеют две субъединицы: малую — 30S субъединицу, состоящую из одной молекулы RNA и 21 белка, и большую — 50S субъединицу, состоящую из двух молекул RNA и 34 разных белков. Рибосомы эукариот имеют очень похожую структуру, но несколько более крупные — 40S и 60S—субъединицы. Малая субъединица связывается с mRNA, а tRNA соединяется с обеими субъединицами. По мере синтеза белка последовательность кодонов mRNA считывается один раз в процессе движения рибосомы вдоль матрицы. Как только сайт инициации mRNA освобождается одной рибосомой, с ним может связываться другая. Поэтому одна mRNA часто может быть связана с несколькими рибосомами, образуя полирибосому.
Инициация. До того как начнется синтез белка, формируется инициирующий комплекс, состоящий из малой и большой субъединиц рибосом, белковых факторов инициации и аминоацил — tRNA. Инициация запускается специфической последовательностью mRNA, содержащей кодон метионина. Элонгация. Большая субъединица рибосомы несет два рядом расположенных сайта связывания tRNA: один связывается с аминоацил —tRNA (сайт А), а другой — с пептидил — tRNA (сайт Р). Специфичность этих сайтов связывания определяется кодонами mRNA, комплементарными к антикодонам tRNA. Пептидильный остаток (или N—формилметионин на первой стадии) переносится на аминокислотный остаток tRNА, связанной с сайтом А, с образованием пептидил —tRNA в сайте А и Lпустой¦ (свободной) tRNA в сайте Р. Это формирование пептидной связи катализируется рибосомальной пептидилтрансферазой.
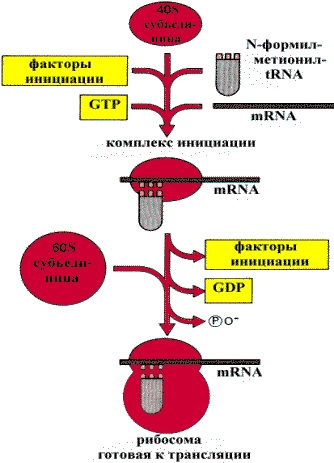
Инициация трансляции у эукариот
LСвободная¦ tRNAпокидает Р—сайт и новая пептидил —tRNA перемещается из А—сайта в освободившийся Р—сайт, а рибосома продвигается по mRNA, чтобы поместить в свободный А—сайт новый кодон. Этот этап называется транслокацией. Этапы инициации, связывания аа—tRNA и транслокации протекают с использованием энергии GTР.
Терминация. Элонгация цепи продолжается до тех пор, пока рибосома не достигнет терминального кодона (UAG, UAA, UGA). Факторы терминации вызывают отделение Lзавершенного¦ полипептида от пептидил —tRNA в Р—сайте.
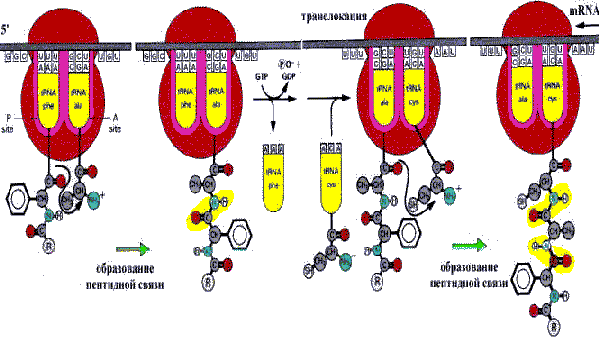
Элонгация
Посттрансляционная модификация. Полипептиды, полученные в результате описанного процесса, спонтанно скручиваются, образуя вторичную и третичную конформацию. В клетках животных многие белки синтезируются в виде молекул—предшественников, требующих модификации для приобретения биологической активности. Например, инсулин синтезируется в виде проинсулина и представляет собой одноцепочечную молекулу. После удаления специфическими протеазами полипептидного сегмента он преобразуется в двухцепочечную молекулу с внутри— и межцепочечными дисульфидными мостиками. Присоединение простетической группы с образованием сложных белков и объединение протомеров в олигомерный белок также происходит после завершения трансляции. Известны многие другие посттрансляционные модификации белков. Например, ковалентные модификации, такие как ацетилирование, фосфорилирование и гликозилирование. Кроме того, может происходить модификация аминокислотных остатков, например превращение пролина и лизина в оксипролин и оксилизин в коллагенах, иодирование тирозина в тирео— глобулине и т.д.
Регуляция синтеза белка
Концентрация многих белков в клетке непостоянна и изменяется в зависимости от состояния клетки и внешних условий. Это происходит в результате регуляции скоростей синтеза и распада белков. Регуляция экспрессии генов может осуществляться на любой стадии на пути от гена до образования функционально—активного белка.
Регуляция транскрипции
Транскрипция генов может подавляться или активироваться, следовательно, синтез белков может репрессироваться или индуцироваться. Оперон — это участок DNA, кодирующий строение, как правило, функционально связанных белков и содержащий регуляторную зону, контролирующую синтез этих белков. На рисунке приведена схема лактозного оперона:
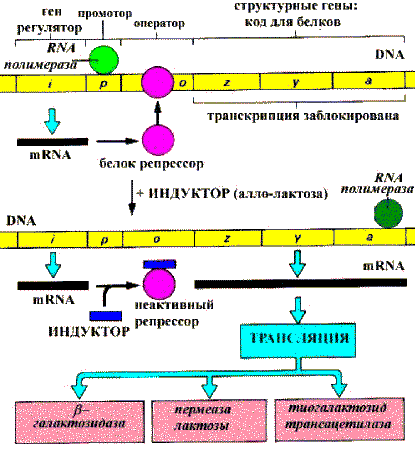
Регуляция экспрессии Lac—оперона E.Coli
Структурные гены, индуцируемые совместно располагаются на молекуле DNA рядом с последовательностями нуклеотидов, называемых промотором и оператором. Для регуляции транскрипции необходим еще один участок DNA — регуляторный ген, не всегда располагающийся вблизи вышеописанной группы. Во время транскрипции RNA—полимераза связывается с промотором и продвигается вдоль DNA, образуя транскрипт генов оперона. Белки—репрессоры — продукты трансляции регуляторных генов, связывающиеся с соответствующими операторными участками и блокирующие продвижение RNA—полимеразы, и, следовательно, препятствующие транскрипции.
Индукторы. Небольшие молекулы, которые могут связываться с белками—репрессорами и ингибировать их способность связываться с операторными участками DNA. Таким образом, транскрипция может происходить только в присутствии индуктора. Индукторами транскрипции служат субстраты метаболических путей. Они стимулируют синтез белков, обеспечивающих их превращения. Корепрессоры — лиганды белков—репрессоров. Корепрессорами, как правило, являются конечные продукты метаболических путей. Роль индукторов и репрессоров могут играть гормоны.
Регуляция действия генов и клеточная дифференцировка
В клетках животных кратковременная адаптивная индукция и репрессиясинтеза белков возникает при изменении концентрации определенных веществ: субстратов, продуктов метаболических путей, гормонов. Однако существуют также длительные, часто сохраняющиеся на протяжении всей жизни индукция и репрессия, возникающие в ходе клеточной дифференцировки. Разные дифференцированные клетки одного организма имеют одинаковый набор генов, но, как правило, отличаются по белковому составу. Различия клеток при дифференцировке возникают в результате репрессии одних генов и дерепрессии других. Молекулярные механизмы регуляции такого типа недостаточно изучены, но общий принцип действия специфических регуляторов сводится к созданию зон DNA, недоступных для транскрипции за счет конденсации хроматина.
Ингибиторы матричных биосинтезов
Использование некоторых лекарственных средств из группы антибиотиков основано на ингибировании матричных биосинтезов, протекающих в микроорганизмах, вызывающих инфекцию. Например, тетрациклин ингибирует элонгацию, блокируя центр связывания аа—tRNA на рибосоме, эритромицин ингибирует транслокацию. Противобактериальные средства отличаются достаточно высокой избирательностью и мало токсичны для человека. Это объясняется тем, что у бактерий рибосомы в целом, а также некоторые ферменты и белки рибосом отличаются по строению от соответствующих белков эукариот. Противоопухолевые антибиотики (актиномицин D, рубомицин и т.д.) нарушают структуру DNA и ингибируют репликацию DNA и (или) транскрипцию. Лекарственные средства этой группы не обладают абсолютной избирательностью по отношению к DNA опухолевых клеток, поэтому они достаточно токсичны. Однако избирательность в их действии всё же имеется, но объясняется не DNA, а другими факторами, например отличиями проницаемости мембран опухолевых клеток, особенностями метаболизма и т.д.
Генные мутации
Различные факторы могут нарушать последовательность нуклеотидов в DNA и, следовательно, изменять генетическую информацию. Такие изменения первичной структуры DNA не исправленные репарирующей системой, называются мутациями. Причинами мутаций могут быть: повреждение DNA ультрафиолетом, ионизирующей радиацией, химическими соединениями окружающей среды и, кроме того, ошибки репликации. Генетические мутации ведут к синтезу измененного, дефектного белка. Мутации, затрагивающие регуляторную зону оперона, приводят к нарушению регуляции или прекращению синтеза белка. Выделяют следующие разновидности мутаций:
- Замена нуклеотида в кодоне. Такое изменение может привести к изменению смысла кодона — миссенс мутации, и появлению в белке новой аминокислоты. Если в результате замены нуклеотида кодон превращается в терминирующий — нонсенс мутации, то синтезируется незавершенный белок, так как его синтез прерывается на этом кодоне. В то же время замена не всегда приводит к изменению смысла кодона. Так как код вырожденный и одна аминокислота кодируется несколькими кодонами, то в результате мутации может получиться новый кодон, но кодирующий ту же аминокислоту.
- Делеция — утрата мономера из цепи. Может быть утрата фрагмента DNA, состоящего из трех нуклеотидов или количества нуклеотидов кратного трем. В этом случае выпадает один кодон или несколько, а в белке утрачивается одна или несколько аминокислот. Если в DNA утрачивается один мономер (или количество нуклеотидов, не кратное трем), то изменяется смысл всех последующих кодонов. Неполный кодон при считывании дополняется недостающим нуклеотидом из соседнего кодона и Lрамка¦ считывания при транскрипции смещается. В результате такой мутации синтезируется белок со случайной последовательностью аминокислот после места мутации.
- Вставка дополнительных мономеров. В случае вставки фрагмента из трех нуклеотидов (или количества кратного трем) синтезируется белок удлиненный на одну или несколько аминокислот. Если же в цепь включается один мономер или количество мономеров не кратное трем, то происходит мутация со сдвигом рамки считывания, как описано выше, и синтезируется белок с измененной последовательностью аминокислот после места мутации, не способный выполнять свои функции. Мутации могут быть нейтральными, полезными и вредными. Мутации в половых клетках передаются по наследству и могут проявляться как наследственная болезнь, связанная со структурными и функциональными изменениями белков. Мутации в соматических клетках могут вызывать различные функциональные нарушения, а иногда трансформацию клеток и развитие опухолей. Если в результате мутации свойства белка изменились в лучшую сторону и повышают жизнеспособность организма, то такие мутации биологически полезны и являются средством естественного отбора.
Полиморфизм белков
При филогенезе происходит усложнение генома по двум причинам: удвоение генов и независимые мутации в них. Получаются варианты генов, которые, образовавшись у отдельных особей, распространяются в популяции в результате наследования. Так формируется генетическая неоднородность, ведущая к неоднородности (гетерогенности) фенотипической. Полиморфизм белков обуславливает существование разных форм белка, выполняющего одинаковые или очень сходные функции. Первый тип полиморфных белков связан с увеличением числа локусов кодирующих определенный белок в хромосоме в результате удвоения и мутаций, то есть имеет место группа сходных локусов в геноме индивида. Гены этих белков не аллельны, они занимают разные локусы (HbA, HbA2, HbF). Второй тип полиморфных белков — продукты аллельных генов (HbA, HbS) — то есть имеет место множество аллелей в генофонде популяции. Полиморфизм белков настолько велик, что можно говорить о биохимической индивидуальности организма.
Методы работы с генным материалом
Трудности в изучении DNA заключаются в следующем:
- молекулы DNA животных и человека имеют огромные размеры. Такие молекулы неудобны для исследования и их предварительно разрезают, фрагментируют с помощью специальных ферментов — рестриктаз, выделяемых из бактерий. Рестриктазы Lузнают¦ определенные последовательности и разрезают DNA в определенных местах;
- количество DNA в клетке невелико, поэтому необходим способ умножения (амплификации) изучаемой DNA in vitro. Таким методом является полимеразная цепная реакция — PCR, которая позволяет амплифицировать DNA или ее фрагмент в миллионы раз за несколько часов.
PCR осуществляют в пробирке с помощью термостабильной DNA—полимеразы (Tag—полимеразы) при участии дезоксинуклезидтрифосфатов — субстратов и коротких олигонуклеотидных затравок — праймеров. Праймер — это короткие, длиной в 20—30 нуклеотидов одноцепочечные фрагменты DNA, комплементарные 3-—концевым последовательностям копируемой DNA—матрицы. Благодаря праймерам ограничивается фрагмент DNA, который будет скопирован Tag—DNA—полимеразой, присоединяющейся к 3-—концам праймеров и достраивающей их до заданной длины. Реакция происходит в несколько стадий:
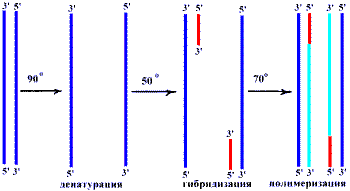
Стадии одного цикла PCR
- Денатурация. Инкубационную смесь нагревают до 90о. При этом происходит разрушение слабых связей в DNA и из одной двухцепочечной молекулы образуются две одноцепочечные.
- Гибридизация праймеров. Температуру снижают до 50о. При этом происходит гибридизация цепей DNA с праймерами.
- Полимеризация. Инкубационную смесь нагревают до 70о. При этой температуре Tag—полимераза удлиняет оба праймера с их 3-—концов. Праймеры дорастают до размеров матрицы. В результате количество DNA удваивается. Tag—полимераза выделяется из термофильных бактерий и отличается устойчивостью к высокой температуре. При температуре 70о гибрид праймер — DNA не денатурирует, а Tag—полимераза способна работать с большой скоростью.
Направления использования PCR
Диагностика болезней (DNA—диагностика). Метод основан на том, что первичная структура DNA разных видов организмов различна. Значит, можно найти последовательности, характерные для DNA возбудителей болезни и подобрать такие праймеры, которые будут гибридизоваться с DNA возбудителя, но не с DNA человека. В этом случае продуктом амплификации будет DNA только возбудителя, а не пациента.
Изучение генома человека. Для этого необходимо выделение и амплификация отдельных генов. Используются праймеры, комплементарные началу изучаемого гена. Последовательность нуклеотидов в таком праймере можно определить по аминокислотной последовательности N—конца и С—конца соответствующего белка и таблице кода. Трудность заключается в том, что код вырожденный и приходится синтезировать несколько праймеров, а затем опытным путем находить праймеры, комплементарные концам гена. Выделение и анализ отдельных фрагментов генов используется для определения мутации и диагностики наследственных болезней.
Клонирование генов
Фрагменты DNA можно вырезать из генома эукариот специально подобранными рестриктазами и встраивать в DNA плазмиды или вируса вскрытую (разрезанную) теми же рестриктазами. Образуется гибридная плазмида или рекомбинантная DNA. Однако таким способом получается очень небольшое количество рекомбинантной DNA. Клонирование — это способ ее накопления. Для этого рекомбинантные плазмиды встраивают в бактерии и получают рекомбинантные бактерии, которые реплицируют, транскрибируют и транслируют Lчужие¦ гены.
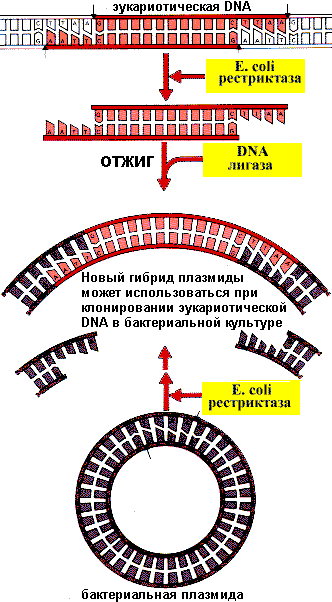
Получение рекомбинантной DNA
Из бактериальной массы можно выделить достаточное количество рекомбинантной DNA.
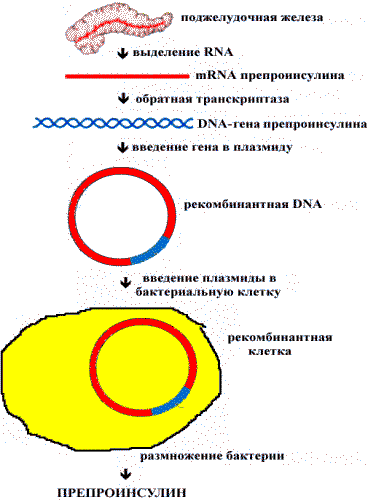
Схема синтеза препроинсулина в трансформированных клетках E.Coli.
Плазмиды кольцевые, двухцепочечные молекулы DNA, содержащиеся в бактериальных клетках и способные к репликации и транскрипции, независимо от клеточных хромосом.
Обратная транскриптаза (RNA—зависимая DNA—полимераза) — фермент, катализирующий синтез DNA, используя в качестве матрицы RNA. Этот фермент необходим для получения последовательности DNA, комплементарной mRNA (kDNA), применяемой в генной инженерии. С помощью обратной транскриптазы можно получить kDNA— копии mRNA, в которой отсутствуют интроны. Следовательно, при включении в плазмиды эта молекула не подвергается сплайсингу. Рекомбинантные микроорганизмы нашли практическое применение как продуценты необходимых человеку веществ: белковых гормонов, биологически активных пептидов.
Белки иммунной системы
Иммунная система человека — это согласованно функционирующая система молекул и клеток, распознающих и удаляющих чужеродные вещества. За иммунитет отвечают В— и Т—клетки. В—клетки вырабатывают антитела — иммуноглобулины (Ig). Т—клетки могут убивать чужеродные клетки или собственные, инфицированные вирусом, и могут быть регуляторами иммунного ответа. Каждая молекула антитела представляет собой белок, имеющий форму буквы Y и состоящий из двух идентичных тяжелых (H) цепей и двух идентичных легких (L) цепей.
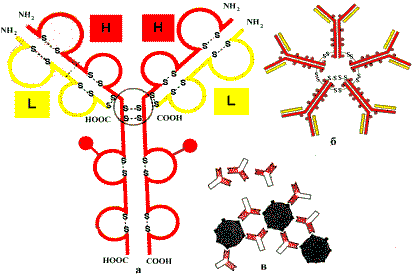
Строение иммуноглобулинов: а — пептидные цепи иммуно—глобулинов (Н — тяжелые, L — легкие); пунктиром обозначены вариабельные области; б — молекула IgM, пять мономеров связаны дисульфидными связями; в — комплексы антиген—антитело.
Существует пять классов антител, имеющих различные константные области Н—цепи. С любым типом Н—цепей могут быть связаны L—цепи любого типа. Каждая L— и Н—цепь Ig состоит из вариабельной области на N—конце и расположенной за ней константной области. Вариабельность аминокислотной последовательности N—концевых участков, как Н — так и L—цепей обеспечивает структурную основу для разнообразия антигенсвязывающих участков. Н—цепи образуют Fc—область (Lхвостовую¦) антител. Разные Н—цепи придают Lхвостовым¦ областям антител различную конформацию, от которой зависит дальнейшая судьба комплекса антиген—антитело. От того, с какими белками будет связываться Fс—область Н—цепей, зависят свойства и функции данного класса Ig. Fc—область Ig может связываться не только с фагоцитирующими клетками, но и с первым компонентом системы комплемента, в результате чего активируется та особая система белков крови, которая способствует разрушению антигена.
Разнообразие антител — результат транспозиции генов. Все В—лимфоциты организма образуют большое число клонов, которые синтезируют антитела только одного вида — имеющие одинаковые вариабельные области. Антиген, присоединяясь к лимфоцитам соответствующего клона, вызывает пролиферацию этого клона и активирует синтез и секрецию антител клетками этого клона. В предшественниках лимфоцитов гены, кодирующие разные области пептидных цепей антител, расположены в разных частях молекулы DNA. При дифференцировке лимфоцитов в процессе онтогенеза происходит рекомбинация — перенос генов из одного места в другое в пределах молекулы DNA (транспозиция). DNA, определяющая вариабельные области антител, составлена из примерно 400 генов V, около 20 генов D и 4 генов J. В результате транспозиции объединяются 3 гена V, D и J в полный ген вариабельной области, который соединяется с любым из генов константной области, и получается полный ген тяжелой цепи. Сходным путем образуются и гены легких цепей антител. Таким способом возникают миллионы разных генов, ответственных за синтез антител.
