Реликтовые составляющие современного метаболизма. С чего он мог начаться?
Относится к разделу Молекулярная биология
" Если эволюция метаболических путей шла путем последовательного добавления новых ферментативных реакций к существовавшим ранее, то, подобно самым старым годовым кольцам на срезе ствола, наиболее древние реакции должны находиться ближе всего к центру "метаболического древа" — там, где синтезируются наиболее существенные молекулярные "кирпичики"".
(Б. Албертс, Д. Брей, Дж. Льюис, М. Рэфф, К. Робертс, Дж. Уотсон. "Молекулярная биология клетки", 2-е издание, "Мир", 1994)
Данная статья является одновременно кратким ликбезом по основам биохимии и введением в анализ древнейших биосинтетических путей.
Метаболизм представлен противоположными, но и взаимосвязанными процессами. Во-первых, происходит распад сложных питательных веществ на более простые, при этом происходит окисление органических молекул и выделяется энергия (рис. 1).
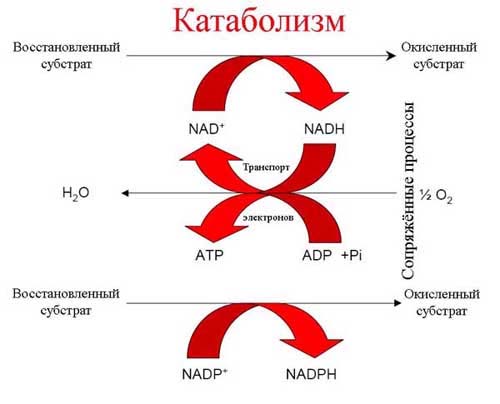
Рис. 1. Процессы, сопряжённые с катаболизмом.
Это звено метаболизма называется катаболизмом. У многих прокариот вместо катаболизма эта часть метаболизма представлена автотрофным типом энергетического обмена). Во-вторых, происходит превращение простых веществ в ходе реакций промежуточного обмена в более сложные низкомолекулярные соединения, из которых далее синтезируются полимерные макромолекулы. Это второе звено метаболизма называется анаболизмом и сопровождается восстановлением органического субстрата и поглощением энергии (рис. 2).
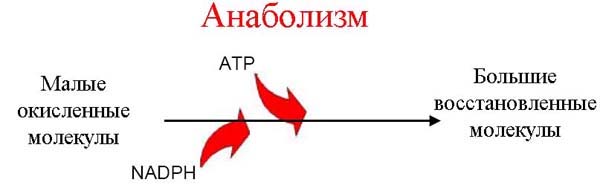
Рис. 2 Процессы, сопряжённые с анаболизмом.
Принципиально, что в метаболизме любого организма мы увидим много черт универсальности в механизмах совершенно различных биохимических реакций.
В чём выражается эта универсальность?
Во-первых, в использовании универсальной энергетической валюты. Живая клетка избегает прямого использования энергии внешних ресурсов для совершения полезной работы. Она сначала превращает их в одну из трех конвертируемых форм энергии ("энергетических валют"), а именно: в форме АТР (свободно в растворе), а также двух видов, связанных с клеточной мембраной: в виде протонного и натриевого потенциала. Эти три вида валюты могут взаимно превращаться друг друга («конвертироваться») и непосредственно обеспечивать все виды полезной работы (механическая, химический синтез, создание осмотического давления и т.д.). Любая живая клетка всегда располагает как минимум двумя "энергетическими валютами": водорастворимой (АТФ ) обязательно и хотя бы одной связанной с мембраной, но могут быть и все три вида.
Примечательно, что АТР является фосфорилированным рибонуклеотидом, то есть компонентом РНК и безусловно была также ключевым компонентом живых систем на стадии РНК-мира.
Как выразился Скулачёв В.П., «клетка предпочитает "денежное" обращение, а не бартер» (подробнее о законах биоэнергетики см. статью Скулачёва В.П. «Законы биоэнергетики»).
Во-вторых универсальными являются переносчики водорода и электронов - проводники окислительно-восстановительных реакций:
К ним относятся никотинаденин (NAD), никотинаденидинуклеотидфосфат (NADP) и флавинадениндинуклеотид (FAD), которые состоят из чисто функциональной части и аденинового нуклеотида (рис. 3). Принципиально, что нуклеотидная часть в реакциях участие не принимает. Почему же она прустутсвтует? Можно предположить, что эти вещества - своеборазные осколки древнего мира РНК, который предопределил современный метаболим, а нуклеотидная часть кофактора выполняла не функциональную роль в осуществлении химических реакций, а ФУНКЦИЮ УЗНАВАНИЯ нуклеотидами из каких-то молекул РНК в период РНК или РНК-белкового мира.
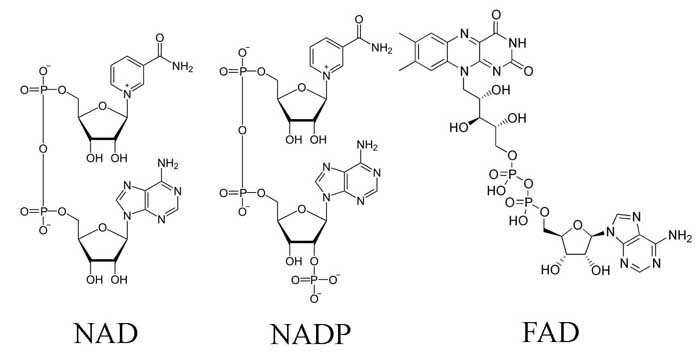
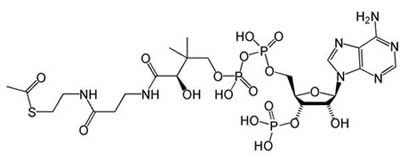 Рис. 3 Строение универсальных переносчиков электронов и атомов водорода.
Рис. 3 Строение универсальных переносчиков электронов и атомов водорода.
В третьих, существует универсальный переносчик ацильной группы, служащий для построения большого количества веществ (аминокислот, липидов, компонентов цикла Кребса) - кофермент А:
Рис. 4. Строение универсального переносчика ацильных групп - кофермента А.
Как и в случае универсальных переносчиков электронов и атомов водорода, кофермент А имеет фукнкиональную часть и нуклеотидную, что мы также можем рассматривать как след метаболизма, контролируемого молекулами РНК.
Таким образом, разнонаправленность двух взаимосвязанных процессов окисления-восстановления субстратов, выделение-запасание энергии и синтез-распад органических биомолекул можно суммировать в виде следующей схемы:
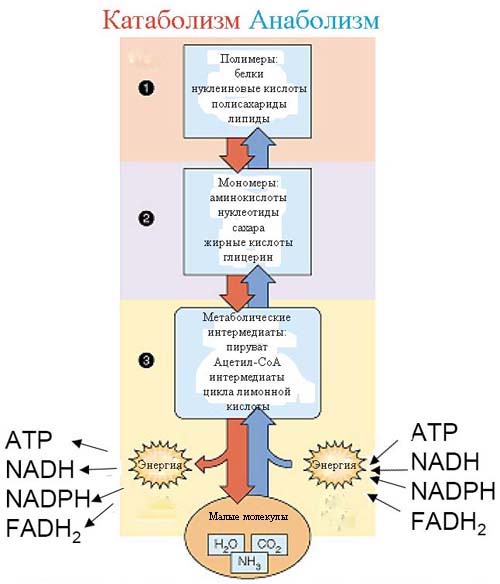
Рис. 5. Блочное разделение клеточного метаболизма по характеру синтезируемых веществ. Третий блок соответствует промежуточному метаболизму.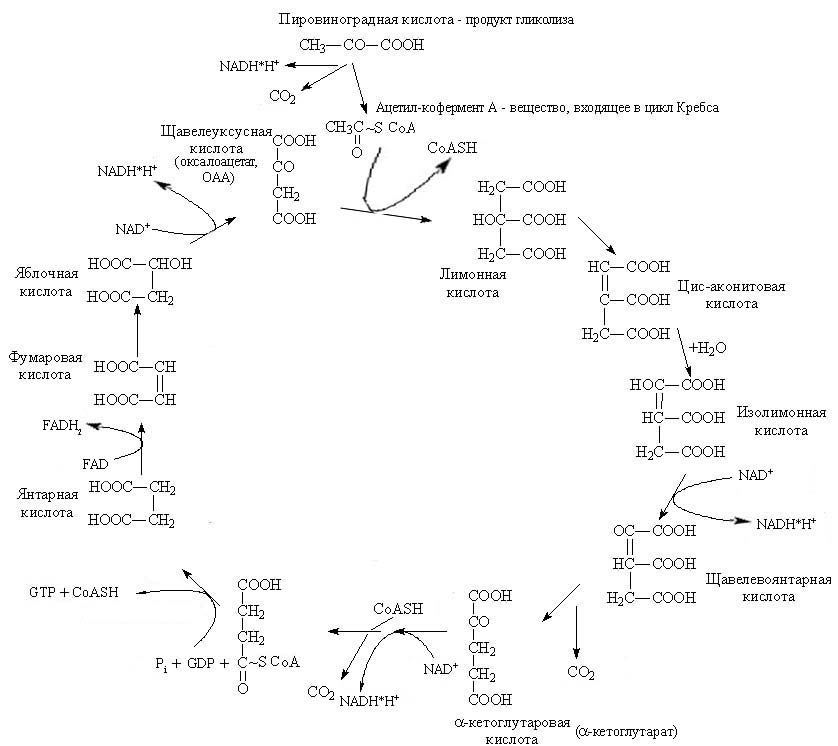
Рис. 6. Цикл трикарбоновых кислот (ЦТК, цикл лимонной кислоты или цикл Кребса).
Взглянем на эту схему и зададимся вопросом, какие из этих метаболических блоков должны быть более древними? Ключевым подходом для данного анализа должен стать принцип - синтез сложных молекул должен был возникнуть позднее синтеза более простых. Известно, что ключевые компоненты живых систем - белки и нуклеиновые кислоты синтезируются из мономеров - нуклеотидов и аминокислот. Сами нуклеотиды могут синтезироваться только из аминокислот и сахаров, соответствующих второму блоку на данной схеме. Но и эти мономеры, в свою очередь не могут рассматриваться как составные части первых метаболических путей, поскольку они синтезируютс из ещё более простых предшественников - так называемых промежуточных метаболитов. Вещества, стоящие по синтетической сложности выше, могут синтезироваться (если они не поступают в готовом виде у гетеротрофов) только из промежуточных метаболитов: все липиды - из ацетата (точнее его активной формы - ацетила-СоА), сахара - из пирувата или 3-фосфоглицерата, все аминокислоты - из кетокислот, как стартового материала, нуклеотиды - из аминокислот и т.д.
Поэтому наиболее древней частью метаболизма мы можем считать только ту часть метаболизма, которая относится к синтезу промежуточных метаболитов - пировиноградную кислоту (пируват), ацетил-коэнзим А и все компоненты так называемого цикла трикарбоновых кислот, или цикла Кребса.
В дальнейшем все модели происхождения жизни будут базироваться на этом важном положении:
Именно промежуточный метаболизм должен был стоять у истоков жизни.
Суммарное уравнение цикла Кребса:
CH3C(O)SСoA+3NAD++FAD+GDP+Pi+2Н2О → 2СО2+3NADН+FADН2+GTP+ 3Н++CoASH
После конвертирования в АТФ в электрон-транспортной цепи получим следующее соответствие:
1 NADH = 3 ATP
1 FADH2 = 2 ATP
1 GTP = 1 ATP
Итого, 12 АDP и 12 Pi в реагентах и 12 АТФ в продуктах.
Казалось бы, ЦТК не имеет отношения к аэробному дыханию, однако отсутствие кислорода у аэробов подавлет его. Почему? Дело в том, что синтезированные в ходе ЦТК NADH и FADH2 далее претерпевают превращения на клеточных мембранах (внутренних или наружных): отдельно переносят положительно заряженные ионы Н+ и отрицательно заряженные электроны на так называемую электроннотранспортную дыхательную цепь, состоящую из набора переносчиков, и восстанавливают молекулярный кислород до воды (или у анаэробов могут быть и другие акцепторы электронов СО2, NO3-, SO42-,SO32- и другие). Образуемый электрохимический градиент сам по себе является уже универсальным клеточным горючим, и он превращается в АТР.
Таким образом, преобразования веществ в данном цикле носят окислительный характер.
Можно представить, что этот цикл действительно был древним, а в исходно анаэробных условиях использовались акцепторы электронов, отличные от кислорода. Однако ещё одим недостатком этого цикла является то, что при нём расходуются атомы углерода, входящие в состав органических молекул. Тогда требование первичности этого цикла автоматически означает доступность восстановленных атомов углерода в органических молекулах в условиях его формирования.
В середине 60-х годов прошлого века было открыто множество анаэробных микроорганизмов, в которых цепь превращений интермедиатов или включала те же вещества, что и в ЦТК, или имела дополнительные звенья цепи, но направленность процессов превращений была обратной: вместо последовательного окисления, интермедиаты подвергались последовательному восстановлению, при этом, происходило связывание углекислого газа, сопряжённое с затратами энергии [Evans M.C., Buchanan B.B., Arnon D.I. 1966]. Поэтому этот цикл получил название восстановительного цикла трикарбоновых кислот (ВЦТК), или восстановительного цикла Кребса, или цикла Арнона. Укороченный вариант цикла с синтезом ацетата представляет собой по существу обращенный цикл трикарбоновых кислот (ЦТК) (рис. 7). Таким образом, 10 компонентов окислительного цикла Кребса и ВЦТК являются универсальными для всех известных форм жизни.
Об эволюционном родстве этих циклов говорит также тот факт, что большинство реакции восстановительного и окислительного варианта ЦТК обратимы и могут катализироваться соответствующими ферментами в обоих направления. Исключение составляют только три реакции, которые и предопределяют направление цикла в восстановительную или окислительную сторон: превращение цитрата в оксалоацетат, конверсия фумарата в сукцинат и превращение 2-кетоглутарата в изоцитрат.
В пользу родства этих циклов также говорит от факт, что некоторые из ферментов (но не все) ВЦТК являются гомологичными ферментам из его окислительного аналога.
Примечательно, что у одного и того же вида было показано наличие как восстановительного, так и окислительного ЦТК: Thermoproteus tenax и Pyrobaculum islandicum.
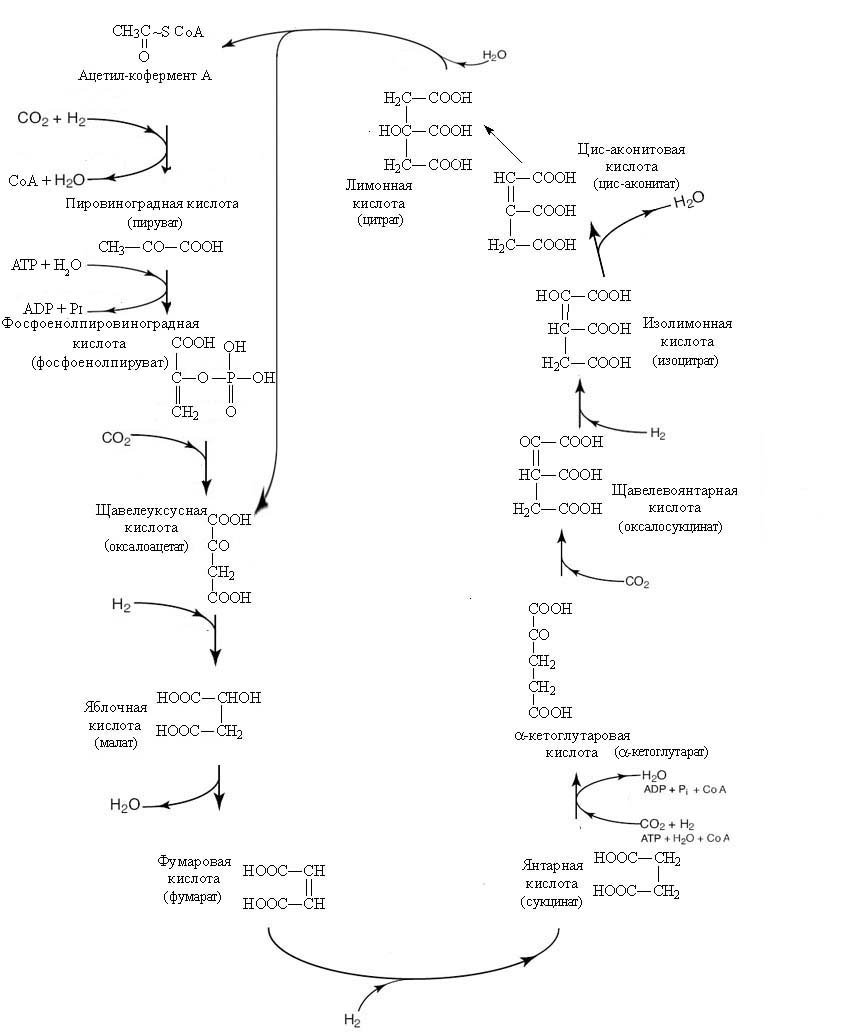
Рис. 7. Восстановительный цикл трикарбоновых кислот (ВЦТК, цикл Арнона). В качестве условного обозначения доноров водорода использовали обозначение "Н2", но фактически донором водорода является ферредкоксин.
Эти организмы получают энергию из окислительно-восстановительной пары, которую они получают из внешней среды, и, таким образом, являются хемоавтотрофами. Донорами электронов у них могут быть H2, NH4+, NO2-, H2S, S2O32-, Fe2+ и др., а акцепторами - СО2, NO3-, SO42-,SO32- и другие. К ним относятся таксономически очень разные организмы из двух разных доменов жизни - бактерий и архей, являющиеся как термофилами, так и мезофилами.Встречается он также и у зелёных водорослей.
В результате одного оборота цикла происходит фиксация СО2 в четырех реакциях, две из которых идут при участии восстановленного ферредоксина. При этом из 4 молекул углекислоты и восстановителя с затратой АТФ синтезируется 1 молекула лимонной кислоты. Ферредоксин - это железосодержащий белок, выполняющий аналогично NADH и FADH2 фукции переноса электронов (и соответственно сопряжённого с ним переноса ионов водорода): в реакциях восстановления степень окисления железа превращается из +2 в +3.
Нетривиальным фактом является то, что ферредоксины функционируют как раз в такого рода окислительно-восстановительных реакциях, которые связаны с изменением степени окисления атомов в неорганических веществах - углекислого газа, водорода и других. Этот факт по-видимому указывает на исключительную древность такого рода фермента (подробнее об этом будет описано в другой статье).
Один из вариантов суммарного уравнения ВЦТК (молекула АТР заменена на эквивалентное количество Н2):
цитрат + 6СО2 + 9Н2 → 2 цитрат + 5Н2О
Принципиально, что данный цикл является автокаталитическим - в нём, в отличие от окислительного ЦТК в результате одного оборота цикла количество реагентов, в том числе акцепторов СО2, увеличивается, а не уменьшается, как в цикле Кребса (о роли автокаталитических реакций в формировании метаболизма будет подробнее написано в отдельной статье).
Немаловажно также, что все реакции в нём первого порядка - это уменьшает ограничения для возможных диффузных барьеров, увеличивающих скорость реакций.
Кроме свойства автокаталитичности, данный цикл является ещё и сетевым, то есть может иметь анастомоз, потенциально повышающий устойчивость этого цикла к внешним воздействиям. В поиске древнего прообраза этого автокаталитического анаболического цикла также можно учитывать возможность появления анастомозов.
Одним из возможных вариантов, обеспечивших энергией древний прообраз ВЦТК могла быть окислительно-восстановительная пара Н2/СО2, наличие которой считается очень правдоподобным согласно данным соверменной геохимии [Wächtershäuser G. 1990, 1992]. Другим источником энергии могут служить фотохимические процессы. Так, сравнительно недавно было показано, что 5 реакций ВЦТК могут катализироваться на поверхности минерала сфалерита (ZnS) фотохимически, то есть с поглощением энергии света [Xiang V. Zhang, Scot T. 2006]. При этом катализируются обе реакции укороченного варианта восстановительного цикла лимонной кислоты, в которой происходит фиксация углекислого газа.Не смотря на то, что в настоящее время известно несколько альтернативных путей фиксации СО2 - три циклических и один нециклический (см. для обзора [Кондратьева Е.Н. 1996], и с учётом новых находок, [Tabita R.F. 2009]) - ВЦТК является лучшим канидатом на роль наиболее древнего цикла фиксации неорганического углерода.
Именно у хемоавтотрофах ВЦТК является стартовой точкой для всех путей биосинтеза. Поэтому одним из вариантов моделирования происхождения первых метаболических путей может служить рассмотрение гипотетических предковых вариантов ВЦТК, в котором имелся какой-то примитивный источник энергии (не обязательно представленный органическими веществами).
Данный факт говорит не столько о первичности самого ВЦТК (хотя его первичность не исключается) в просхождении метаболизма, сколько о необходимости его возникновения уже до стадии биосинтеза аминокислот, а, следовательно, и генетического кода.
Подробнее ключевая роль ВЦТК в эволюции ГК рассмотрена в двух статьях: Древний дублетный генетический код был предопределён путями синтеза аминокислот и Биохимическая (коэволюционная) модель эволюции генетического кода.
Не исключено, что сам ВЦТК мог возникнуть на основе других метаболических циклов, что более подробно рассматривается в статье Как мог выглядеть архаичный метаболиз?
Литература.
Кондратьева Е.Н. Автотрофные прокариоты. - М.: Изд-во МГУ. 1996. - 312 с.
Alber B.E., Olinger M., Rieder A., Kockelkom D., Jobst B., Hugler M., Fuths G. Malonyl-coenzyme A reductase in the modified 3-hydroxypropionate cycle for autotrophic carbon fixation in archaeal Metallosphaera and Sulfolobus spp. // J. Bacteriol. 2006. V.188. P.8551–8559.
Berg, I.A. Kockelkorn D., Fuchs G. A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea. // Science. 2007. V.318. P.1782–1786.
Evans M.C., Buchanan B.B., Arnon D.I. A new ferredoxin-dependentcarbon reduction cycle in a photosynthetic bacterium. // Proc. Natl. Acad. Sci.USA. 1966. V.55. P.928–934.
Hügler M., Huber H., Stetter K.O., Fuchs G., Autotrophic CO2 fixation pathways in archaea (Crenarchaeota). // Arch. Microbiol. 2003a. V.179. P.160–173.
Hügler M., Krieger R.S., Jahn M., Fuchs G. Characterization of acetyl-CoA/propionyl-CoA carboxylase in Metallospaera sedula. // Eur. J. Biochem. 2003b. V.270. P.736–744.
Ishii M., Miyake T., Satoh T., Sugiyama H., Oshima Y., Kodama T., Igarushi Y. Autotrophic carbon fixation in Acidianus brierleyi. // Arch. Microbiol. 1997. V.166. P.368–371.
Ishii M., Chuakrut S., Arai H., Igarashi Y. Occurrence, biochemistry and possible biotechnological application of the 3-hydroxypropionate cycle. // Appl. Microbiol. Biotechnol. 2004. V.64. P.605–610.
Klatt C.G., Bryant D.A., Ward D.M. Comparative genomics provides evidence for the 3-hydroxypropionate autotrophic pathway in filamentous anoxygenic phototrophic bacteria and in hot spring microbial mats. // Environ. Microbiol. 2007. V.9. P.2067–2078.
Morowitz H.J., Kostelnik J.D., Yang J., Cody G.D. The origin of intermediary metabolism. // Proc. Natl. Acad. Sci. USA. 2000. V.97. P.7704-7708.
Pereto J.G., Velasco A.M., Becerra, A., Lazcano, A. Comparative biochemistry of CO2 fixation and evolution of autotrophy. // Int. Microbiol. 1999. V.2. P.3–10.
Russell M.J., Martin W. The rocky roots of the acetil-CoA pathway. // Trends Biochem. Sci. 2004. V.29. P.358–363.
Smith E., Morowitz H.J. Universality intermediary metabolism. // Proc. Natl. Acad. Sci. USA. 2004. V.101. P.13168-13173.
Svetlitchnyi V. et al. A functional Ni-Ni-[4Fe4S] cluster in the monomeric acetyl-CoA synthase from Carboxydothermus hydrogenoformans. // Proc. Natl. Acad. Sci. U.S.A. 2004. V.101. P.446–451
Tabita R.F. The hydroxypropionate pathway of CO2 fixation: Fait accompli. // Proc. Natl. Acad. Sci. USA. 2009. V.106. P.21015–21016.
Wächtershäuser G. Evolution of the first metabolic cycles. // Proc. Natl. Acad. Sci. USA. 1990. V.87. P.200–204.
Wächtershäuser G. Grandworks for an evolutionary biochemistry: the iron-sulphur world. // Prog. Biophysl. Mol. Biol. 1992. V.58. P.85–201.
Xiang V. Zhang, Scot T.M. Driving parts of Krebs cycle in reverse through mineral photochemistry. // J. Am. Chem. Soc. 2006. V.12. P.16032–16033.
Zarzycki J., Brecht V., Müller M., Fuchs G. Identifying the missing steps of the autotrophic 3-hydroxypropionate CO2 fixation cycle in Chloroflexus aurantiacus. // Proc.Natl. Acad. Sci. USA 2009. V.106. P.21317–21322.
Статьи, связанные с темой:
Автотрофное термофильное происхождение жизни
Биохимическая (коэволюционная) модель эволюции генетического кода
Древний дублетный генетический код был предопределён путями синтеза аминокислот
Как мог выглядеть архаичный метаболиз?
Тест: А не зомбируют ли меня? Тест: Определение веса ненаучности
| Обнаружен организм с крупнейшим геномом Новокаледонский вид вилочного папоротника Tmesipteris oblanceolata, произрастающий в Новой Каледонии, имеет геном размером 160,45 гигапары, что более чем в 50 раз превышает размер генома человека. | Тематическая статья: О вере в полеты американцев на Луну |
Рецензия: Комментарии к статье Теория функциональных систем П.Анохина | Топик ТК: Барьеры функционализма |