Генетически модифицированные организмы
Генетически модифицированные организмы
Мои коммнтарии включены фиолетовым цветом
http://elementy.ru/lib/164586
Сегодня уже трудно найти человека, никогда не слышавшего слов «генетически модифицированные организмы» и «трансгеника». Из научных статей и инженерных проектов трансгенные организмы уже перекочевали в карикатуры и анекдоты. Но и по сей день мало кто знает, какие фундаментальные и технические проблемы понадобилось решить для их создания и какие новые проблемы они создают.
|
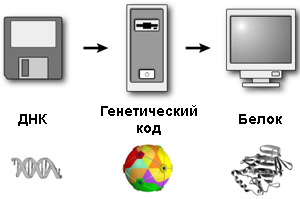
У каждого вида живых существ свой уникальный набор генов. В них записаны все врожденные черты несущего их организма: форма листа или цвет перьев, число щупалец или размер ягод. Записаны в виде последовательности определенных молекул — нуклеотидов, играющих роль букв. Это кажется странным — но не более, чем, скажем, цифровое изображение, точно так же записанное в виде некоторого текста на специальном языке.
Однако в разных компьютерах используются разные коды. А вот генетический код одинаков для всех без исключения живых существ. Гены разных видов — это разные тексты, написанные на одном и том же языке, не знающем ни диалектов, ни даже разных шрифтов. Если ген каким-то образом попадет внутрь чужой клетки, ее аппарат уверенно считает с него никогда прежде не виданный белок. Например, наши клетки, зараженные вирусом гриппа, усердно вырабатывают записанные в его генах белки — скажем, нейраминидазу, вызывающую у нас тошноту и головную боль.
Сеанс игры вслепую
|
Сразу, как только это выяснилось, у ученых возник соблазн поиграть в генетический конструктор: взять ген из одного организма и перенести в другой. Но легко сказать «взять и перенести» — каждая «буква», которыми записан генетический текст, состоит всего из нескольких атомов. Объекты такого размера нельзя увидеть ни в какой микроскоп — их размер намного меньше длины световой волны. А ведь нужно было не только опознать в клетке определенный ген, но и аккуратно вырезать его, перенести внутрь другой клетки, вставить в одну из ее хромосом. И еще сделать так, чтобы он там попал в «считывающее устройство» — ведь в каждый момент в клетке работают лишь немногие из имеющихся в ней генов, и мы до сих пор не вполне понимаем, как она выбирает, какие гены считывать. На обзаведение инструментами, позволяющими хотя бы приступить к решению этих задач, у молекулярной биологии ушло почти двадцать лет.
Первый шаг к созданию трансгенного организма — это определение «донорского» гена. Само по себе это не так уж просто: если, скажем, нас интересует производство какого-нибудь вещества — ну, например, аминокислоты триптофана, — нужно выделить и очистить фермент, который его делает, определить его аминокислотную последовательность, «вычислить» по ней последовательность нуклеотидов в соответствующем гене (что не так-то просто: одну аминокислоту могут кодировать несколько сочетаний нуклеотидов) и найти этот ген. Впрочем, соответствие между интересующим разработчика продуктом и ответственным за него геном можно установить и другими путями, и множество генов было идентифицировано еще до возникновения трансгеники. Что до их расшифровки, то с этой задачей, за решение которой в 70-е годы давали Нобелевские премии, сегодня успешно справляется автоматика.
Но вот нужный ген опознан, прочитан, установлено его место в геноме донора. Теперь надо его вырезать. С этого и начинается собственно генная инженерия. Ножницами для вырезания нужного гена служат специальные ферменты-рестриктазы. Вообще-то ферментов, умеющих разрезать нить ДНК, очень много, но рестриктазы рассекают ее по строго определенному сочетанию букв-нуклеотидов — своему для каждой рестриктазы (а их известно сейчас более сотни). Конечно, никто не гарантирует, что границы интересующего нас участка будут отмечены каким-либо из этих ключевых сочетаний, но, зная текст искомого гена, можно так выбрать рестриктазы, чтобы среди нарезанных ими кусочков были и те, что содержат его целиком. Кроме него в состав этих фрагментов будут, вероятно, входить обрезки соседних участков ДНК, но их можно убрать экзонуклеазами — ферментами, откусывающими по одному нуклеотиду с конца нити ДНК.
Впрочем, в последнее время появился способ скопировать нужный участок, не вырезая его, — полимеразная цепная реакция. Для нее достаточно иметь лишь затравку — маленький кусочек ДНК, соответствующий началу нужного гена. При определенных условиях эта затравка может послужить сигналом для фермента полимеразы — снять копию с гена, начинающегося этим фрагментом. Мало того — когда копия будет готова, полимеразы примутся снимать копии и с нее, и с участка, послужившего ей образцом. Копии начнут множиться лавинообразно, пока в системе не исчерпается запас свободных нуклеотидов. Это выглядит примерно как если бы в собрание сочинений Пушкина подкинули россыпь печатных букв и клочок бумаги с единственной строчкой «У лукоморья дуб зеленый...» — а через короткое время получили бы несколько сот экземпляров полного текста пролога к «Руслану и Людмиле»!
Но вот нужный ген так или иначе выделен. Теперь надо его упаковать в конверт, который доставит его внутрь чужой клетки. Обычно для этого используются природные переносчики генетической информации — вирусы и плазмиды. Последние представляют собой небольшие кольцевые молекулы ДНК, существующие в бактериальных клетках отдельно от их основного генома. Они способны проникать из одной клетки в другую и служат бактериям чем-то вроде почтовых вирусов, позволяя им передавать друг другу полезные признаки — например, устойчивость к тому или иному антибиотику. Именно эта способность переносить гены из клетки в клетку и сделала плазмиды излюбленным инструментом генной инженерии.
Особенно удобны так называемые Ti-плазмиды, получаемые из микроорганизма Agrobacterium tumefaciens. Эта бактерия поражает стебли и листья некоторых растений, причем ее Ti-плазмиды умеют встраивать часть своей ДНК — несколько генов — в хромосому растительной клетки. Получив такой подарок, клетки начинают бурно делиться, превращаясь в разрастание рыхлой ткани (корончатый галл), и вырабатывать ряд экзотических веществ, которыми и питаются трансформировавшие их бактерии (для прочих почвенных микроорганизмов эти вещества несъедобны). По сути дела, бактерия выступает здесь как биотехнолог, вводя в геном растения гены полезных для себя признаков. Для человека же Ti-плазмиды особенно ценны именно тем, что умеют не просто доставлять нужные гены в растительную клетку, но и встраивать их внутрь ее родных хромосом.
Однако вирусы и плазмиды почти никогда не используются в биотехнологии в своем натуральном виде. Например, Ti-плазмида содержит гены растительных гормонов, заставляющих клетки растения разрастаться в рыхлую опухоль и не дающих им специализироваться — в то время как разработчики должны вырастить из генно-модифицированной клетки целое растение. Другие гены Ti-плазмиды кодируют ферменты, синтезирующие бактериальную еду — если их оставить, часть ресурсов будущего трансгенного растения будет уходить на производство этих ненужных человеку веществ. Кроме того, все эти гены занимают место, а оно в генетических «конвертах» дорого — увеличение размера участка ДНК, который надо доставить в клетку-мишень, резко снижает вероятность успеха. Так что перед использованием из Ti-плазмиды (как и из любого другого генетического переносчика) уже знакомыми нам инструментами вырезается всё лишнее — остаются только гены, обеспечивающие доставку «груза» по назначеннию.Такие искусственные конструкции для переноса генов на биотехнологическом жаргоне называются «векторами». Иногда, впрочем, в процессе превращения плазмиды или вируса в вектор в них кое-что и добавляют. Так, например, в векторы, созданные на основе Ti-плазмиды, добавлены регуляторные участки, позволяющие им размножаться в клетках кишечной палочки, выращивать которую в лаборатории куда проще, чем Agrobacterium tumefaciens, питающийся редкими аминокислотами.
Векторы, созданные из природных переносчиков генетической информации, решают за конструкторов еще одну задачу. Как уже говорилось, мало перенести нужный ген в другую клетку — надо еще, чтобы он там начал работать. У каждого организма есть тонкая и сложная система регуляции активности генов, следящая за тем, чтобы работали лишь те гены, продукт которых необходим в данный момент. Продукт же чужого гена клетке не нужен по определению, и никаких резонов считывать этот ген у нее нет.
С той же проблемой столкнулись когда-то и вирусы, для которых это вопрос жизни и смерти: не убедив клетку немедленно начать их считывать, они не смогут размножиться. Поэтому структурные гены вируса снабжены промотором — участком ДНК, который ферментными системами клетки воспринимается как команда начать считывание. Промотор — обычный элемент любого генетического аппарата, свои промоторы есть и у клетки-хозяина, которая регулирует активность генов, открывая и закрывая их промоторы для считывающих ферментов. Однако вирусные промоторы не подчиняются клеточным регуляторам и всегда открыты для ферментов. Так же ведут себя промоторы вышеупомянутой Ti-плазмиды. При этом один промотор заставляет клетку считывать целый ряд примыкающих к нему генов. Вектор с таким промотором не только вставляет нужные генетические тексты в геном клетки-мишени, но и заставляет ее немедленно приступить к их чтению.
Закладка «письма» в «конверт» происходит так: вектор, физически представляющий собой кольцевую молекулу ДНК, разрезают в нужном месте рестриктазами, приводят в контакт с копией выделенного гена и добавляют сшивающий фермент — лигазу. Она соединяет два отрезка ДНК — ген и вектор — снова в колечко. Теперь остается только внедрить полученную рекомбинантную ДНК в клетку-мишень. Как мы уже знаем, векторы умеют делать это сами, но им можно помочь, повысив проницаемость клеточной мембраны с помощью некоторых солей или электрического тока. Если мишенью является бактерия, то не обязательно даже встраивать нужный ген в основной геном — он может работать и в плазмиде-векторе...
Тут возникает очередная трудность: молекулярные конструкторы работают сразу с большим количеством объектов — генов, векторов, клеток-мишеней. Понятно, что каждая операция имеет не стопроцентный выход, и в итоге далеко не все клетки-мишени получают донорский ген. Трансгенные клетки нужно отделить от неизмененных. Для этого еще при создании рекомбинантной ДНК в вектор вместе с нужным геном встраивают ген устойчивости к какому-нибудь антибиотику. А после воздействия таких векторов клетки-мишени высевают на питательную среду, содержащую этот антибиотик. Тогда все клетки, в которые вектор не внедрился или не работает, погибнут, и останутся только трансгенные.
Если объектом работы были микроорганизмы, то задача выполнена: создана популяция трансгенных клеток, которые теперь нужно только размножить. С растениями сложнее: из культуры клеток надо вырастить целостный организм. Но делать это растениеводы научились задолго до появления генной инженерии. Сложнее всего с животными: у них генной модификации приходится подвергать оплодотворенные яйцеклетки, причем при работе с млекопитающими их еще надо потом имплантировать суррогатной матери. Именно поэтому трансгенных животных создано во много раз меньше, чем растений и микробов. А до массового коммерческого разведения пока не дошло ни одно. Впрочем, последнее обстоятельство, возможно, имеет и другие причины.
Доверяй, но проверяй
|
Представьте себе, что в зоопарке вы подходите к большому вольеру, огражденному глубоким рвом, высоченной стеной и решетками, способными остановить танк. И с трудом различаете где-то в дальнем его углу симпатичного пушистого зверька размером с белку. Примерно такое впечатление производят нормы, принятые рядом стран (в частности, Евросоюзом) для обращения с генетически модифицированными организмами (ГМО) и продуктами из них. Прописанные в них меры безопасности мало отличаются от тех, что соблюдаются при работе с возбудителями чумы или сибирской язвы. Судя по опросам социологов, о «потенциальной опасности» ГМО слыхали практически все, но мало кто способен сформулировать, в чем именно она состоит. И неудивительно: трансгенные организмы существуют уже около 30 лет. В последние 10 лет трансгенные растения выращиваются в разных странах мира на полях, общая площадь которых в прошлом году достигла 80 млн га. Миллионы людей и бессчетное число животных ели и едят продукты из них — и за все эти годы не было получено свидетельств, что процедура генной модификации делает продукт более вредным или опасным, чем он был без нее. Напротив, согласно прошлогоднему докладу Союза германских академий наук и Гуманитарной комиссии по зеленым биотехнологиям, содержание токсичных и аллергенных веществ в продуктах из ГМ-растений оказалось ниже, чем в таких же продуктах из традиционных сортов — за счет более жесткого контроля и меньшей загрязненности паразитическими грибками.
Доводы против трансгенных организмов и продуктов в огромной степени состоят из «черного пиара», порожденного конкурентной борьбой агропромышленных корпораций, а также принципиально не проверяемых религиозно-идеологических утверждений (вроде тезиса о «вмешательстве в божественный замысел») и обычных бытовых страхов перед неизвестным. Но помимо этой информационной грязи в дискуссиях о безопасности ГМО можно разглядеть и реальные проблемы.
Самая серьезная из них — это угроза естественному биоразнообразию. Пыльца с ГМ-растений может попадать на цветы их диких предков, выпуская тем самым чужой ген в свободное плавание по дикой популяции. Если этот ген обеспечивает своим обладателям какое-нибудь жизненное преимущество (а ГМ-сорта часто отличаются от традиционных именно устойчивостью к засухе, морозу, вредителям и т. д.), то он очень быстро распространится в дикой популяции, полностью вытеснив дикую форму, — и мы, по сути дела, потеряем один из видов живых существ, восстановить который потом будет невозможно никакими мерами. То, что на месте утраченного вида будут расти его трансгенные родственники, дела не меняет: домашние лошади и коровы не могут заменить нам своих истребленных предков — тарпана и тура.
|
Впрочем, культурные растения часто могут скрещиваться не только со своими прямыми предками, но и с близкородственными видами, многие из которых — злостные сорняки. Если к ним попадет, скажем, ген устойчивости к гербициду (а более половины всех промышленно выращиваемых в мире ГМ-растений — это сорта, устойчивые к препарату «раундап»), получится «суперсорняк», бороться с которым будет очень сложно.
Реальный способ предотвращения этих эффектов был предложен еще в 1998 году, когда лидер трансгенных технологий в растениеводстве компания Monsanto разработала сорт ГМ-пшеницы, который помимо устойчивости к вредителям обладал также специальным геном-терминатором: содержащие его зерна по вкусовым и питательным свойствам ничем не отличались от обычных, но при высевании не прорастали. Бесплодными были и гибриды этого сорта с традиционными пшеницами, что исключало бесконтрольное распространение трансгенного наследственного материала. Компанию тут же обвинили в попытке «подсадить» фермеров на ежегодные закупки семян, и на следующий год она заявила об отказе от вывода на рынок технологии гена-терминатора. Однако биотехнологи не оставили эту многообещающую идею: в нескольких лабораториях созданы хитрые генетические механизмы, позволяющие ГМ-растениям успешно скрещиваться между собой, но делающие бесплодными семена, у которых только один из родителей был трансгенным.
Еще острее проблема предотвращения выхода сконструированных генотипов в окружающую среду стоит, если трансгенные технологии применяются к животным. Рыбоводы знают: если рыбное хозяйство использует естественный водоем, то как его ни ограждай, а рано или поздно тот вид, который в нем выращивают, будет встречаться по всей реке. Между тем сейчас из уже созданных ГМ-животных ближе всего к коммерческому использованию быстрорастущий трансгенный лосось компании Aqua Bounty. С самого начала в его геноме было изменено число хромосом. Это позволяет исключить его скрещивание с рыбами из природных популяций — но не размножение его в природных водоемах, если он в них попадет.
Пока, однако, прецедентов генетического загрязнения окружающей среды не зафиксировано — известны только случаи появления трансгенных растений на полях, засеянных обычными сортами (обычно за счет переноса пыльцы). Хотя масштабы разведения трансгенных организмов уже сейчас огромны (помимо сельского хозяйства ГМО широко применяются в фармацевтической промышленности — в развитых странах многие препараты белковой природы, в том числе такие важнейшие, как интерферон и инсулин, производятся микроорганизмами, которым вставлены соответствующие человеческие гены), и наблюдения за ними были тщательными, а порой и пристрастными (стоит заметить, что в России пока не принят закон, разрешающий выращивать ГМ-культуры, однако можно использовать импортные трансгенные культуры; для этого продукт должен пройти медико-биологическую, медико-генетическую и технологическую экспертизы. — Ред.). Не подтвердились и другие теоретические опасения, высказывавшиеся специалистами на заре «трансгенной эры». Предполагалось, например, что внедренный ген в чуждом для себя окружении может оказаться неустойчивым, склонным покидать «новую родину» и посредством вирусов распространяться по другим организмам. Вообще-то такое происходит и с «родными» генами, но ожидалось, что донорские гены будут делать это гораздо чаще. Однако прямые исследования интенсивности «горизонтального переноса» (так генетики называют обмен генетическим материалом между организмами разных видов) не выявили каких-либо отличий трансгенных сортов и штаммов от обычных.
Немало подозрений вызвало и то, что большинство трансгенных организмов несет в себе гены устойчивости к антибиотикам. Само собой напрашивалось предположение, что при поедании продуктов из таких ГМО эти гены могут быть переданы бактериям, находящимся в теле человека. Пусть даже не болезнетворным, а симбиотическим, вроде кишечной палочки, — бывает, что обычная микрофлора человеческого организма вдруг становится патогенной, и если мятежные бактерии окажутся устойчивыми к антибиотику, это сильно затруднит лечение. В начале 90-х даже появились работы, в которых сообщалось о том, что у людей, употреблявших ГМ-продукты, устойчивость патогенных микроорганизмов к антибиотикам обнаруживается чаще. Однако более тщательные исследования не подтвердили этого эффекта. Вообще до сих пор все сообщения о вреде, нанесенном людям или животным употреблением ГМ-пищи, оказывались либо выдумкой, либо неверной интерпретацией фактов. Скажем, в выступлениях против использования ГМО до сих пор встречаются ссылки на канцерогенность популярного производителя аспартама, производимого при помощи трансгенных бактерий. На самом деле аспартам первоначально производился двумя способами: биотехнологическим и чисто химическим. К настоящему времени второй способ полностью вытеснил первый, и весь производимый сегодня в мире аспартам — синтетический. Его канцерогенность от этого, естественно, никуда не делась, но она, как и следовало ожидать, связана со свойствами самого вещества. А не со способом его получения и уж тем более — не с трансгенностью производящих его бактерий.
Другое дело, когда объектом генно-инженерных манипуляций становится сам человек. В последние годы большие надежды медиков были связаны с генной терапией, позволяющей исправлять генетические дефекты в клетках человеческого тела. Такое лечение уже применялось при некоторых заболеваниях — в частности, при комбинированном врожденном иммунодефиците. Эта болезнь исключает развитие у ребенка иммунной системы, обрекая его на смерть от первой попавшейся инфекции. До появления генной терапии медицина ничем не могла помочь таким младенцам.
Однако программа генно-терапевтического лечения этой болезни была закрыта в 2002 году, когда у двух из проходивших ее 11 детей была обнаружена лейкемия. Видимо, это не было случайным совпадением. Вектор с доставляемыми генами может внедриться в любой участок генома, и у пострадавших малышей он оказался соседом гена LMO2, о котором давно известно, что его избыточная активность (которую вполне может обеспечить входящий в состав вектора мощный вирусный промотор) приводит к лейкемии. Конечно, вероятность того, что вектор внедрится именно рядом с LMO2 или другим протоонкогеном, весьма мала. Но каждому пациенту вводили примерно миллион «генетически отремонтированных» клеток, а для развития лейкемии может хватить и одного рокового попадания.
Этой истории оказалось достаточно, чтобы скомпрометировать применение в медицине вирусных векторов — но не саму идею генной терапии. Сегодня медики рассматривают возможность безвирусной доставки в клетку нужных генов. В биотехнологии такие методы давно известны: например, использование липосом (жировых пузырьков-капсул, способных проникать через клеточную мембрану) или «генной пушки» — прямого обстрела клеток микрочастицами золота с зафиксированными на их поверхности генами. Правда, эти пути свободны не только от опасностей, но и от удобств векторного переноса: вероятность встраивания переносимого таким образом гена в хромосому клетки-мишени намного меньше и при этом нет никаких гарантий, что даже в случае успешного попадания он начнет там работать. Тем не менее, по единодушному мнению медицинского сообщества, через 10-15 лет «генетический ремонт» превратится в массовую процедуру.
Конечно, никто не может сказать, что ему известны все последствия использования трансгенных технологий и что они ни при каких условиях не могут принести вреда. Но ведь любое из великих изобретений, легших в основу человеческой цивилизации, — огонь, топор, домашние животные, колесо, лодка — никогда не было абсолютно безопасным, и никто не мог предвидеть всех последствий его применения.
Верстовые столбы
1944 — Эвери, Мак-Леод и Маккарти показали, что «вещество наследственности» — это ДНК.
1953 — Джеймс Уотсон и Фрэнсис Крик определили структуру молекулы ДНК — двойную спираль.
1961-1966 — расшифрован генетический код — принцип записи в ДНК и РНК последовательности аминокислот в белках.
1970 — выделена первая рестриктаза.
1973 — Гобинда Корана синтезировал полноразмерный ген; Герберт Бойер и Стэнли Коэн предложили стратегию создания рекомбинантных ДНК.
1976-1977 — разработаны методы определения нуклеотидных последовательностей (секвенирования) любых ДНК.
1978 — фирма Genentech выпустила рекомбинантный инсулин, производимый человеческим геном, введенным в бактериальную клетку.
1980 — Верховный суд США вынес вердикт о законности патентования трансгенных микроорганизмов.
1981 — поступили в продажу автоматические синтезаторы ДНК.
1982 — в США впервые поданы заявки на проведение полевых испытаний трансгенных организмов; в Европе разрешена первая вакцина для животных, полученная методами генной инженерии.
1983 — для трансформации растений применены гибридные Ti-плазмиды; компания Monsanto начала создание трансгенных растений.
1985-1988 — разработан метод полимеразной цепной реакции (ПЦР).
1990 — в США утвержден план испытаний генной терапии с использованием человеческих клеток; официально начаты работы над всемирным проектом «Геном человека» (завершен в 2000 году).
1994 — получено первое разрешение на возделывание трансгенного растения (помидора сорта FlavrSavr).
1996 — началось массовое выращивание трансгенных растений.
1998 — Европейский Союз ввел мораторий на регистрацию новых ГМ-культур, действовавший до 2002 года.
2000 — принят Картахенский протокол по биобезопасности (вступил в силу в 2003 году), установивший наиболее общие международные нормы обращения с трансгенными организмами.