В первой части нашего повествования мы рассмотрели достаточно много разнообразных вариантов синтеза органических молекул различного уровня сложности и немного ковырнули проблемы, связанные с гипотезой РНК-мира. Вот второй части мы продолжим осаду крепости, за стенами которой скрывается великая тайна Происхождения Жизни. И, в частности, в качестве одного из стенобитных орудий попробуем использовать гипотезу Снытникова и Пармона. Она удивительным образом связывает воедино две, казалось бы, совершено несвязанные между собой проблемы - происхождение жизни и формирование планет около формирующихся молодых звёзд. Основу данной гипотезы заложил тот факт, что, как показывают результаты численного моделирования процессов, происходящих при конденсации исходного газово-пылевого облака, при этом формируются практически идеальные условия для синтеза в огромных масштабах достаточно сложных органических веществ (в основном, в виде углеводородов, но и не только их). В свою очередь, обладающие повышенной липкостью синтезированные жироподобные вещества, выступающие в данном случае в роли своеобразного клея, способствуют ускорению процесса слипания пылинок и прилипания их к частицам большего размера, приводя в итоге к формированию объектов всё большего размера. Наиболее близкая аналогия данного процесса - формирование буквально за несколько десятков оборотов внушительных размеров снежного кома из небольшого снежка, который катят по мокрому снегу. Интересно, что не лишним в этом процессе оказывается и вроде-бы бесполезный на последующих уровнях биологической эволюции, но широко распространённый в космосе гелий, так как он в данном случае выполняет функцию эффективного отводя излишков тепла, выделяющегося в процессе происходящих химических реакций. С точки зрения теории нелинейных сред гипотеза Снытникова-Пармона предсказывает появление в результате развития процессов коллективной неустойчивости волн плотности газово-пылевого облака, ведущих себя как псевдочастицы - солитоны, что в итоге приводит к постепенному гравитационному сжатию некоторых его областей и формированию из них зародышей планет. Ещё одна отличительная черта данной гипотезы - она предсказывает гораздо более быстрое, чем это следует из "классической теории", образование планетных систем вокруг молодых звёзд. Есть ли какие-нибудь экспериментальные подтверждения данного предсказания? Возможно, недавно их добыл знаменитый американский телескоп Хаббл. Он обнаружил около совсем недавно сформировавшейся звезды TW Hydrae планету на очень удалённой орбите, что явно не согласуется с общепринятой сейчас теорией формирование планетных систем у молодых звёзд. Будущие наблюдения за другими формирующимися планетными системами должны прояснить, насколько типично обнаруженное явление, и, соответственно, подтвердить или опровергнуть необходимость внесения корректировок в современную теорию формирования планет из газово-пылевого облака, окружающего молодые звёзды. Если это окажется действительно актуальным, то, думается, идея Снытникова-Пармона выглядит удачным кандидатом на возможную альтернативу.
Ещё одним интересным свойством рассматриваемой гипотезы является одновременный синтез в протопланетном облаке как углеводородов, так и воды, ибо именно она выделяется в качестве побочного продукта при полимеризации цепочек органических молекул. Таким образом, складываются благоприятные условия для образования везикул, которые многими учёными рассматриваются в качестве архаичных предшественников современных клеток. Далее, как было показано в первой части, очень важную роль на первых этапах эволюции могли играть такие вещества, как формальдегид и формамид. На Земле в настоящее время они практически не встречаются, а вот в космическом пространстве это одни из самых распространённых веществ (см., например, здесь и здесь). Всё это, а так же недавнее открытие в ещё одном марсианском метеорите возможных следов жизнедеятельности бактерий указывает на перспективность проработки гипотезы исходного зарождения жизни в космическом пространстве, в частности, на этапе формирования планетных систем вокруг молодых звёзд, после чего она может быть занесена на уже сформированные к тому времени планеты метеоритами, но данная тема заслуживает отдельной статьи, так что поставим пока в этом месте многоточие...
Вернёмся от астрофизики к вопросу возможной цепочки химических реакций, постепенно превратившей костную материю в форму, активно сопротивляющуюся попыткам её уничтожения. Напомним вкратце об одной из возможных тропинок на пути к свершению данного чуда, о которой уже кратко упоминалось в первой части. Если высыпать в воду порошок, содержащий смесь сульфидов железа и никеля, а так же совсем немного селена, и пропускать через него угарный газ и сероводород (нервных просим одеть отсекающий противогаз), то на выходе получим метантиол и простейшее органическое вещество - ацетат:
CO + H2S → CH3COOH + CH3SH
Если теперь прекратить доступ к смеси сероводорода, то он начинает вырабатываться системой реагентов из угарного газа и метантиола самостоятельно, производя при этом в качестве побочного продукта ацетилтиоэфир:
2CH3SH + CO → CH3CO(SCH3) + H2S
Более подробно и с картинками про эту серию реакций можно почитать у LUCA (см. раздел Древним аналогом Ацетил-СоА мог служить ацетилтиоэфир), так же обратите внимание на Рис. 5 в его статье, наглядно демонстрирующий, что метильную группу в составе ацетилтиоэфира действительно можно рассматривать как некий упрощённый аналог, пожалуй, самого вездесущего биологического кофермента - CoA). Итак, в результате вполе естественного природного процесса мы получили, с одной стороны, простое органическое вещество - ацетат, а с другой стороны, ацетилтиоэфир, который на ранних этапах эволюции мог выступать в качестве аналога современной молекулы Acetyl-CoA. Известно, что у современных бактерий ацетогенов и метаногенов комплекс Acetyl-CoA в итоге преобразуется в Aсуtyl-P, где P это фосфатная группа. Любопытно, что при этом в эфирной связи запасается даже примерно на треть больше энергии, чем выделяется в "классической" реакции гидролиза молекулы АТФ! Данная реакция катализируется ферментом фосфотрансацетилазой, причём её кофактором выступает калий, а натрий наоборот её ингибирует, то бишь, угнетает. Ага, сказали мы с Петром Иванычем, а не есть ли это один из вариантов ответа на вопрос, почему все живые клетки так настойчиво стремятся поддерживать внутри себя концентрацию калия как минимум на порядок большую, чем натрия (в неживой природе, в том числе, "за бортом" клетки, соотношение, как правило, ровно обратное)? Не мог ли механизм "откачки" натрия за пределы клетки изначально возникнуть для увеличения эффективности фосфорилирования молекулы Acetyl-CoA (или её более простого аналога), и лишь впоследствии быть использованным для других целей (натриевые АТФ-синтазы, катализ рибосомного синтеза протеинов)? Итак, учитывая, что обычно за катализ реакции отвечает именно кофактор, а белок лишь усиливает её эффективность (конкретно про реакции переноса фосфатной группы и зависимость их эффективности от наличия в растворе ионов калия см., например, здесь), а так же принимая во внимание, что ацентилтиоэфир по крайней мере в некоторых реакциях может заменять CoA, можно предположить, что при определённых условиях синтез комплекса ацетил-фосфат может идти и в неживой природе. Если это действительно так, то значение данного факта трудно переоценить, ведь концентрация данной молекулы в любой клетке является универсальным индикатором, переключающим функционирование клетки из режима роста в режим сбережения энергии и наоборот (подробнее см. здесь). Соответственно, данный регуляторный контур без сомнения должен был появиться уже на заре появления жизни. Что бы продвинуться дальше давайте вспомним, что роль своеобразной системы кровообращения клетки как правило выполняет полная или частично купированная версия так называемого цикла трикарбоновых кислот (или одного из его многочисленных "диалектов"). Суть его, как ясно из самого названия, заключается в преобразовании одних карбоновых кислот в другие, причём различные вещества, появляющиеся на разных стадиях цикла, впоследствии используются при синтезе практически всех базовых элементов клетки - нуклеиновых оснований, аминокислот, углеводов (включая глюкозу), углеводородов (включая жирные кислоты и изопреноиды, из которых состоит клеточная мембрана). На Рис. 1 приведена схема типичного цикла трикарбоновых кислот вместе с основными органическими молекулами, синтезируемыми в процессе его круговорота.
Рис. 1. Круговорот органических молекул в клеточном цикле трикарбоновых кислот, взято отсюда.
Мог ли и какой-нибудь упрощённый аналог цикла трикарбоновых кислот (он же цикл Кребса) сформироваться в благоприятных условиях абиогенно, явившись впоследствии, так сказать, закваской для сформировавшегося позже полноценного цикла? Обратимся в очередной раз к уже упомянутой выше статье LUCА. На Рис. 3 этой статьи он приводит расчёт свободной энергии Гиббса для основных реакций рассматриваемого цикла. Как легко убедиться, большинство реакций теоретически могут идти самопроизвольно, так как соответствующая им энергия Гиббса либо отрицательна (что де факто означает, что данная реакция с термодинамической точки зрения "выгодна"), либо близка к нулю (что означает, что она в термодинамическом смысле почти нейтральна). Единственным исключением из этого правила является реакция синтеза оксалоацетата из пирувата, требующая существенного внешнего источника свободной энергии. Если абиогенный путь от ацетилтиоэфира (как аналога ацетил-КоА) до оксалоацетата действительно найдётся, то это будет означать, что сеть взаимных превращений карбоновых кислот и их производных вполне могла появиться ещё до появления механизмов репликации ДНК/РНК, а регулирующие происходящие при этом процессы катаболизма и анаболизма органические молекулы могли стать точками кристаллизации первых метаболических реакций будущих клеток. Можно привести такую аналогию - если за счёт какого-то процесса (например, атмосферного) происходит постоянное наполнение водных бассейнов на некой возвышенности, то накапливающаяся в них вода будет, в конце концов, через сеть разных протоков (от ручейков до полноводных рек) и промежуточных озёр стекать в море. Если при этом как-то упорядочить указанные естественные процессы, где-то установив запруды, где-то организовав искусственные водохранилища, а где-то и придумав способы при необходимости через систему насосов иметь возможность поднимать воду немного наверх, то можно достаточно эффективно использовать бессмысленно рассеивающуюся до этого потенциальную энергию для выполнения механической работы (скажем, при помощи водяной мельницы), запасения энергии в другой форме (например, путём постройки гидроэлектростанций), или просто орошения полей по мере необходимости. Примерно аналогичным образом и обеспеченный достаточным количеством энергии цикл Кребса (точнее, его, вероятно, гораздо более примитивный предшественник) мог взять на себя поддержку многих жизненного важных для протоклетки процессов. Интересный вариант предполагаемого абиогенного автокаталитического цикла, который мог в итоге стать прототипом цикла Кребса, рассматривается вот в этой статье, на которую обратил внимание всё тот же LUCA, обладающий удивительным даром находить в огромном потоке информации действительно интересные публикации. Предложенный авторами архаичный цикл фиксации углерода состоит из двух конкурирующих путей, причём выбор системой одного или другого из них, как преимущественного в данных условиях, зависит от степени кислотности среды. При изменении внешних условий от окислительных к восстановительным (или наоборот) происходит переключение с одного пути на другой, что можно рассматривать как зачаточную систему саморегуляции. Благодаря переключению между метаболическими путями этот цикл мог, с одной стороны, обладать высокой степенью устойчивости (образно говоря "выживаемости") по отношению к изменению условий внешней среды, а с другой стороны, благодаря его автокаталитичности, он мог как бы самоорганизоваться в среде как самостоятельный процесс, способный к экспансии и "захвату" окружающих районов, имеющих схожие физико-химические условия, а это уже один из основных признаков жизни.
Итак, возвращаясь к вышеописанной аналогии, поставим вопрос таким образом - как мог выглядеть тот абиогенный "насос", который мог бы постоянно подкачивать воду на возвышенность, непрерывно синтезируя оксалоацетат? Самый простой путь для этого - вначале трансформировать ацетилтиоэфир в пируват, а потом за счёт источника энергии в виде АТФ или пирофосфата "проапгрейдить" пируват до оксалоацетата. Первая из указанных реакций в живой природе осуществляется при помощи фермента пируват-ферроредоксин оксидоредуктазы. Данный фермент "приклеивает" к ацетилу молекулу углекислого газа, используя при этом в качестве коферментов КоА (к которому изначально и прикреплён ацетил) и железо-серный кластер (атом железа в котором при этом переходит из окисленного состояния Fe+3 в восстановленное Fe+2). Впрочем, ничего неожиданного в данном факте нет, ибо именно железо-серные активные центры катализируют очень многие реакции цикла Кребса. Кроме того, напомним, что в большинстве случаев указанные кластеры в активных центрах белков попросту повторяют структуру фрагментов кристаллических решёток широко встречающихся в природе минералов, так что могут рассматриваться просто как захваченные белками мельчайшие фрагменты породы, растворённые в воде. Более подробно об этом по традиции можно почитать в соответствующей статье LUCA. Фермент ускоряет реакцию в обе стороны, но если синтезированный пируват будет быстро расходоваться на другие цели, а запасы ацетила, наоборот, пополняться из внешних источников, то в соответствии с принципом Ле-Шателье можно ожидать, что равновесие реакции будет смещено в сторону синтеза пирувата.
Для того, что бы на следующем этапе преобразовать пируват в оксалоацетат можно воспользоваться ферментом, присутствующим в митохондриях животных - пируваткарбоксилазой. В полном соответсвии со своим названием, он "пришивает" молекулу углекислого газа к пирувату, превращая его тем самым в оксалоацетат. Данная реакция является эндотермической (она идёт за счёт гидролиза одной молекулы АТФ), а в качестве активного центра фермента в реакции выступает биотин, причём её равновесие смещено в сторону синтеза оксалоацетата. Судя по всему, биотин является одним из древнейших органических коферментов. В частности, как пишет Е.Кунин в недавно вышедшей на русском языке своей последней книге "Логика случая", ген белка биотин-синтазы принадлежит к одному из двух наиболее распространённых в биоте семейств генов, характеризующихся укладками, типичными для аминоацил-тРНК-синтетаз (если говорить более точно, то она гомологична аминоацил-тРНК-синтетазам II-го класса; те читатели, которые уже знакомы с первой частью статьи, вероятно помнят, что укладкой, гомологичной аминоацил-тРНК-синтетазам I-го класса обладают, в частности, ферменты с так называемой укладкой Россмана, связывающие нуклеотиды). С другой стороны, сама молекула биотина довольно проста. Жирные кислоты, одна из которых пришита к ней в виде своеобразного "хвоста", являются одной из самых легко синтезирующихся в подходящих условиях разновидностей органических молекул. В оставшемся скелете находится 7 атомов углерода, 2 атома азота, один атом кислорода и один атом серы (водород, однозначным образом "налипающий" на оставшиеся свободными валентности, для наших целей можно не учитывать). Все вышеназванные химические элементы входят в группу самых распространённых во Вселенной. Принимая в качестве нулевого приближения предположение, что они присутствовали в исходом "супе" в примерно равных пропорциях, можно оценить по порядку величины условную вероятность самосборки "скелета" молекулы биотина за одну попытку как 4-11 ≈ 2.4*10-7. С чем можно сравнить данную величину? Попробуем, например, оценить аналогичным образом вероятность самосборки наиболее простых пиримидиновых нуклеотидов - ЦМФ и УМФ. Предполагая, что молекулы фосфата широко представлены в среде, нам остаётся оценить лишь сложность сборки "скелета" нуклеозидов - цитидина и уридина. Учитывая, что в состав "скелета" пиримидинов входят углерод, кислород и азот, а общее количество атомов в нём равно 17, мы получим оценку 3-17 ≈ 7.7*10-9. Таким образом, при прочих равных биотин должен собираться примерно на один-два порядка чаще, чем ЦТФ и УТФ. Несомненно, данная оценка носит очень и очень абстрактно-приблизительный характер, и для более уверенных выводов нужны прямые опыты по абиогенному синтезу биотина в умеренно восстановительных условиях. Так или иначе, гипотеза возникновения жизни, как процесса постепенно усложняющейся сети устойчивых к внешним возмущениям автокаталитических реакций, в процессе которых воспроизводятся некоторые относительно простые органические молекулы, представляется весьма плодотворной.
Попробуем теперь зайти с другой стороны. По ряду признаков (см. первую часть) на определённом этапе зарождения феномена жизни существовал некий симбиоз между относительно короткими цепочками полинуклеотидов (предшественниками современных тРНК) и короткими цепочками аминокислот (предшественниками современных белков). Они взаимно помогали друг другу самовоспроизводиться в автокаталитических циклах. Очевидно, что при этом про-тРНК должны были выступать сразу в двух качествах - как информационные матрицы для самовоспроизводства и как средства для катализации синтеза коротких пептидов из аминокислот. Каким образом они умудрялись выполнять обе функции? В настоящее время считается уже более-менее общепринятой гипотеза, что наиболее древней является верхняя половина тРНК, включающая акцептерный стебель к которому прикрепляется аминокислота, и так называемую Т-петлю. Попробуем восстановить наиболее вероятную предковую последовательность этой части тРНК (акцептерного стебля и Т-петли) то есть, участка с 1-го по 7-й нуклеотид и с 49-го по 72 нуклеотид (см. рис. 2.).
Рис. 2. Схематичная модель вторичной структуры тРНК.
Для этого можно подсчитать статистическую встречаемость различных нуклеотидов на соответствующих позициях молекулы тРНК. Воспользовавшись базой данных отсеквенированных геномов бактерий и архей, и написав простенькую программку для примитивного статистического анализа, мы получим следующие консенсус-последовательности нуклеиновых оснований: GGGGGCG для позиций 1-7 и GCGGGUUCGAAUCCCGCCGCCCCCA для позиций 49-73. Так как ССА "хвост", к которому прикрепляется аминокислота, во многих случаях не кодируется непосредственно ДНК, а "пришивается" впоследствии специальным ферментом, то его можно пока не учитывать. "Честно" полученная нами путём "молекулярных раскопок" предполагаемая последовательность "прабабушки тРНК" обладает интересным свойством. Её можно представить в виде двух почти идеально взаимно комплиментарных РНК-цепочек. Причём, если взаимная комплиментарность в районе, соответствующем акцепторным стеблям "классических" РНК в общем-то вполне ожидаема, то её наличие в нижней части молекулы, соответствующей Т-петле современных тРНК, факт весьма нетривиальный. Единственный "непарный" нуклеотид соответствует позиции номер 60 на Рис. 2.
Как можно интерпретировать полученный результат? Один из возможных вариантов состоит в том, что исходно на олигомер длиной порядка дюжины но, состоящий в основном из цитидин-фосфатов, налипли комплиментарные нуклеотиды, и получилась короткая двойная спираль РНК с единственным дефектом (неспаренным нуклеотидом U, см. левую часть рис. 3). Из-за указанного дефекта, а так же преобладания на одном из её концов пар A-U, скрепляемых не тремя, а лишь двумя водородными связями, "слабый" участок олигомера в какой-то момент частично расплёлся, и "концевые" нуклеотиды соединились между собой. В итоге получилась классическая структура типа "шпилька" со стеблем, состоящим исключительно из пар C-G, и петлёй, состоящей преимущественно из нуклеотидов U и А (см. правую часть рис. 3). При этом, крайная пара нуклеотидов стебля G-C, вплотную примыкающая к петле, оказывается "слабым звеном" всей конструкции, так как указанные нуклеотиды вследствие существования хаотичных тепловых флуктуаций местоположения их неспаренных соседей по нуклеотидной цепочке цепочке непрерывно подвергаются дополнительным усилиям на разрыв водородных связей. В результате, при определённых условиях (скажем, повышении температуры) цепочки стебля могли начать постепенно расходиться по направлению снизу-вверх.
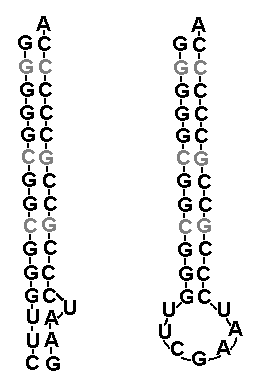
Рис. 3. Предполагаемая (восстановленная) структура про-тРНК, которая предположительно могла существовать в двух псевдостабильных состояниях - в виде двойной цепи с одним дефектом (слева) и структуры типа стебель-шпилька (справа). Три пары C-G, вычисленные со слабой статистической достоверностью, показаны серым цветом. В них комплиментарные пары нуклеотидов С и G вполне могли быть инвертированы (CG<=>GC) по сравнению с теми вариантами, которые указаны на рисунке.
Если на освобождённые в результате разорванных связей гуанинове нуклеотиды достаточно быстро налипали свободно плавающие в растворе комплиментарные им цитозиновые, то они могли "деактивироваться" быстрее, чем расплеталась двойная спираль. Это очень важный момент, так как одним из основных факторов, которые мешают неферментативной репликации РНК, является как раз склеивание между собой содержащих преимущественно гуаниновые основания фрагментов одной из цепочек РНК, что делает невозможным синтез комплиментарных копий (см. первую часть). Но если "высвободившиеся" G-нуклеотиды быстро "обезвреживаются" C-нуклеотидами, то процесс синтеза комплиментарной копии может успешно дойти до конца. Это представляется тем более реальным, что цитозины по сути являются основным продуктом открытой недавно возможной реакции абиогенного синтеза пиримидиновых нуклеотидов (опять см. первую часть), а уридины появляются в смеси лишь как побочный эффект основной реакции, возникающий из-за деаминирования некоторых цитозинов под действием ультрафиолета. Таким образом, можно предположить, что в условном "органическом бульоне" действительно превалировали именно цитозиновые основания. Параллельно, но уже в гораздо более низком темпе, могла достраиваться и остальная часть комплиментарной нити, соответствующая бедному G-нуклеотидами участку исходной. При понижении температуры состоящие почти целиком из взаимно комплиментарных участков "материнская" и "дочерняя" цепочки могли вновь свернуться в структуры типа "шпилька". Таким образом, из единственной "затравочной" структуры в виде небольшой молекулы РНК мы в итоге получили две. Процесс мог повторяться многократно, быстро размножая наш рибозим до астрономического количества его копий (вспомним знаменитую легенду про мудреца, придумавшего шахматы, и наивного шаха). Впрочем, может быть, мы зря назвали полученную миниатюрную РНК-молекулу рибозимом? Способна ли она катализировать хоть какие-нибудь полезные предбиологические химические реакции?
Для ответа на этот вопрос можно вспомнить про проблему нерибосомного синтеза небольших протеинов в "дорибосомную эпоху", рассмотренную в первой части. Не могла ли наша крохотная РНК как-то участвовать в этом процессе? Напомним, что во всех современных организмах синтез белков идёт в самом "сердце" рибосомы, где в соответсвии с информацией, кодируемой с помощью информационной РНК, две молекулы тРНК тесно сближаются, после чего растущая цепь аминокислотных остатков, составляющая синтезируемый белок, сначала снимается с CCA конца одной тРНК, а потом присоединяется к аминокислоте, прикреплённой к CCA концу другой молекулы тРНК. При этом длина цепочки аминокислотных остатков, составляющих протеин, увеличивается на единицу. Там же были приведены аргументы в пользу того, что изначально аминокислоты в древних протеинах могли располагаться не в однозначной, кодируемой в настоящее время молекулой иРНК последовательности, а псевдослучайным образом, когда последовательность аминокислот (точнее, их остатков) формируется, подчиняясь лишь статистическим закономерностям, причём одним из главных определяющих факторов является вероятность парной встречаемости аминокислот в последовательности. В таком случае можно было бы обойтись вообще без иРНК, так как возможность того, что аминокислота Б будет следовать после аминокислоты А, могла зависеть исключительно от вероятности тесного сближения соответствующих молекул про-тРНК, включая несущие одну или более аминокислот их 3 концы. Но, как легко понять, петлевые участки у исходной про-тРНК и её комплиментарного "слепка" при их взаимном сближении будут стремиться склеиться, образовав участок, скрученный в двойную спираль. Это, в свою очередь, должно тесно сблизить и их стебли, ибо под действием крутильных сил они будут поворачиваться по направлению друг к другу до тех пор, пока не упрутся друг в друга. Подобная конфигурация, в свою очередь, приведёт к достаточно близкому сближению аминокислот (или их цепочек), расположенных на концах стеблей, что может облегчить их взаимный перенос с конца стебля одной про-тРНК на аминокислоту другой про-тРНК подобно тому, как это сейчас происходит в активном центре рибосомы. Дополнительному сближению стеблей молекул про-тРНК могли способствовать так же водородные связи, устанавливающиеся между оставшимися свободными валентностями гуанина (теми самыми, которые являются одним из основных препятствий для неферментативной репликации РНК, имеющей ощутимый процент гуаниновых азотистых оснований!). И здесь можно выдвинуть интересную гипотезу. В настоящее время весьма популярной является точка зрения, что изначально аминокислоты, которые несёт тРНК, кодировались не последовательностью оснований в антикодоновой петле (нуклеотиды номер 34, 35, 36 на Рис. 2), а так называемым протокодоновым участком акцепторного стебля (нуклеотиды номер 3, 4, 5 на Рис. 2). Очевидно, что если водородные связи, образуемые между нуклеотидами в концевой области стеблей, действительно помогали сблизиться молекулам про-тРНК и осуществить, тем самым, реакцию соединения двух аминокислот (или одной аминокислоты и одной пептидной цепочки), которые они несли на своих концах, то вероятность указанной реакции должна была существенным образом зависеть от конкретных последовательностей нуклеотидов как раз примерно в области протокодонового участка. Если комбинации данных последовательностей были таковы, что они способствовали взаимному "притяжению" стеблей конкретных молекул про-тРНК, то аминная связь возникала с высокой вероятностью. Если же последовательности были "не подходящими", то в большинстве случаев эти молекулы просто в конце-концов расходились, так и не склеив свои прикреплённые к стеблям аминокислоты. Это могло служить с одной стороны неким примитивным механизмом формирования псевдослучайных "ди" и "поли" пептидных цепочек с регулируемыми пока ещё только в чисто статистическом смысле последовательностями аминокислотных остатков, а с другой стороны, могло помочь создать петлю обратной связи, позволившую постепенно "притереть" друг к другу различные модификации молекул про-тРНК и синтезируемые с их помощью цепочки про-протеинов, способные существенно повысить как "выживаемость" про-тРНК (например, защищая их наиболее уязвимые участки), так и эффективность их репликации.
Как уже отмечалось в первой части, наиболее вероятным можно считать сценарий, при котором РНК и аминокислоты, или их короткие цепочки (протеноиды), с самого начала тесно взаимодействовали. Без помощи аминокислот спектр реакций, которые могут катализировать РНК, весьма ограничен. Это ясно даже из чисто комбинаторных соображений, набор активно используемых в биологических процессах аминокислот содержит как минимум 20 наименований, в то время как в состав "классических" РНК входит лишь четыре нуклеотида. Если бы цепочки нуклеотидных остатков, составляющих РНК, можно было разнообразить дополнительными нестандартными нуклеотидами или вкраплениями аминокислот, то дело явно пошло бы гораздо веселее. Возможно, оба этих способа были задействованы на ранних этапах эволюции. О потенциальной возможности реализации первого варианта косвенно говорит факт посттранскрипционных модификаций некоторых нуклеиновых оснований в тРНК. О возможности использования второго варианта намекает существование кофакторов, похожих на связку нуклеотидов с аминокислотами (SAM и т.д.). В этом случае РНК могла бы формировать трёхмерный "скелет" рибозима, а точечные вкрапления аминокислот в области её активного центра обеспечивали бы непосредственный катализ реакции. Впрочем, подобные конструкции, пожалуй, уже неправильно называть рибозимами, более подходит, скажем, слово аминорибозим. Каким же образом аминокислоты могли крепиться к нуклеиновым основаниям? Тут возможны несколько вариантов, и не исключено, что все они в той или иной степени могли использоваться в "добелковую" эпоху.
Например как было показано, у бактерий существует протеин, имеющий высокую степень гомологии с Gly-тРНК синтетазой, добавляющий активированную аминокислоту во-первых к "чужой" (Asp) тРНК, а во-вторых, вовсе не к концу её акцепторного стебля, как все "воспитанные" аминоцил-тРНК синтетазы, а в третью позицию её антикодона. При этом, в данной позиции находится модифицированное нуклеиновое основание куеуозин (queuosine), представляющее собой "проапгрейденный" гуанин. Примечательно, что глутамат присоединяется таким образом, что теоретически не мешает образованию водородных связей гуанина, что позволяет предположить возможность нахождения присоединённого таким образом глутамата и на спаренных (стебельковых) участках РНК. Так же весьма интересно, что первые две буквы генетического кода глутамата и аспарата совпадают, а третья буква, позволяющая их различать, для глутамата соответствует именно гуанину (или аденину). Таким образом, можно предположить, что на начальных стадиях эволюции часть аминокислот могла располагаться не только на конце акцепторного стебля про-тРНК, как это, как правило, происходит сейчас, но и непосредственно в районе антикодонного триплета. Возможно, что это даже более древний способ расположения аминокислотного остатка, по крайней мере, совмещение на физическом уровне нуклеотидного триплета и аминокислоты, им кодируемой, хотя бы на первых порах, выглядит более естественным, чем разнесение их в пространстве на противоположные стороны прото-тРНК.
Другой способ возможной "инкрустации" РНК аминокислотами заключается в удержании их в петлях, образуемых РНК, за счёт водородных связей примерно на то же принципе, на котором удерживаются рядом друг с другом нуклеотиды на комплиментарных нитях РНК и ДНК. И для этого способа есть достаточно веские экспериментальные подтверждения. Ещё в 1988-м году было обнаружено, что в интроне рибосомной РНК гриба тетрахимены был обнаружен петлеобразный фрагмент, способный специфически связывать аминокислоту аргинин, причём, "вздутие" одной из нитей РНК, помогающее удерживать данную аминокислоту в точности соответствовало одному из её кодонов в стандартном генетическом коде - CGA! Вдохновлённые этим успехом учёные принялись активно искать в живой природе примеры других возможных соответствий трёхнуклеотидных участков РНК и соответствующих им в стандартном генетическом коде аминокислот. И результаты не замедлили сказаться. Особенно плодотворным оказалось изучение соответствия последовательностей нуклеотидов и связывающихся с ними аминокислот в рибопереключателях как типичных биологических структурах, в которых наблюдается тесное взаимодействие аминокислот с фрагментами цепочек нуклеотидов. Кроме того, рибопереключатели обычно расположены на переднем конце иРНК, что геометрически как раз примерно соответствует локализации активированной аминокислоты в современных тРНК. Более того, учитывая, что у акцепторного стебля тРНК вблизи его конца как раз в начале не хватает трёх-четырёх (в качестве "нулевого" элемента на рис. 2 как правило выступает просто остаток ортофосфорной кислоты) "купированных" нуклеотидов, комплиментарных своим "концевым" собратьям номер 73-76, само собой напрашивается предположение, что именно там изначально и располагалась захватывающая аминокислоту петля, а после перемещения аминокислоты на свою современную позицию левая половинка петли стала ненужной и атрофировалась. Так вот, в результате статистического исследования большого числа рибопереключателей, было выявлено, что для семи аминокислот "стандартного пула" соответствие по крайней мере одного из вариантов кодона или антикодона данной аминокислоте подтверждается с вероятностью, исключающей случайное совпадение (подробнее см. табл. 1 вот в этой статье).
Кроме всех перечисленных выше вариантов, ещё одна возможность взаимодействия древних РНК с синтезированными абиогенно короткими цепочками аминокислот (протеноидами) просматривается в следующем. Обратим внимание, что в одной из двух самых распространённых из укладок белков, так называемом бета-листе расстояние между аминокислотами в одной цепи составляет величину примерно от 0.30 нм (когда данный участок белка находится в складке) до 0.38 нм (когда он находится в расслабленном состоянии). С другой стороны, как известно, расстояние между нуклеотидами в двухнитиевых участках ДНК и РНК составляет величину около 0.34 нм, что примерно соответствует шагу аминокислот при бета-укладке, Более того, оказывается, что и сама укладка формируется на основе взаимодействий, весьма напоминающих взаимодействия нуклеиновых оснований в ДНК/РНК, а именно - за счёт образования водородных связей между аминогруппой и кислородом карбоксильной группы (см. Рис. 4).
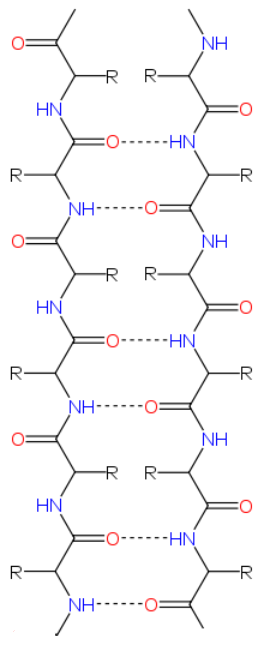
Рис. 4. Структура укладки белка типа бета-лист с образованием водородных связей между аминогруппой и кислородом карбоксильной группы. Символом R обозначена боковая группа любой аминокислоты. Взято из соответствующей статьи в Википедии.
Данный факт открывает ещё одну интересную перспективу. Она заключается в том, что, в принципе, нельзя исключать возможности образования гибридных спиральных структур, в которых одна нить состоит из олигомера РНК или ДНК, а другая из небольшой пептидной цепочки. Обе цепочки будут связаны между собой водородными связями. При этом, боковые ветви аминокислот, обычно наиболее важные для каталитических свойств белка, должны как бы торчать наружу. Но даже в тех случаях, когда в состав белка входит лишь простые, обычно не проявляющие каталитической активности аминокислоты типа глицина или аланина, он может выполнять, например, защитные функции, предохраняя "оголённые" однонитиевые участки РНК от гидролиза и других нежелательных реакций. В этом плане их роль могла бы быть примерно аналогичной той роли, которую сейчас выполняют при репликации ДНК ssb белки. Можно отметить так же ещё один интересный факт - самый большой универсальный оперон, содержащийся в геноме практически всех прокариот, состоит в основном из генов, кодирующих белки, необходимые для сборки рибосомы, транскрипции и трансляции. Другими словами, это система синтеза как других белков, так и самих себя (говоря языком марксистской политэкономии - производство средства производства). В то же время гены, необходимые для репликации ДНК, не образуют оперона, они разбросаны по всей хромосоме. Данный факт позволяет высказать предположение о том, что "кристаллизация" генов хромосомы могла начаться именно с её "рибосомного" участка. При этом, первоначально РНК могла использоваться как для синтеза протеинов, так и для хранения и репликации генетической информации. Тот факт, что гены из рибосомного оперона часто имеют ощутимую степень гомологии с генами, отвечающими за метаболизм, позволяет так же предположить, что изначально многие ассоциированные с рибосомой протеины могли совмещать "каркасообразующие" рибосому функции с каталитическими. При этом, белки могли крепиться к телу рибосомы путём заякоривания их концевой аминокислоты к рРНК одним из описанных выше способов.
В свете всего вышеизложенного можно предположить следующий гипотетический сценарий событий, происходивших на ранних этапах эволюции.
1. В условиях умеренно восстановительной среды при условии подвода к ней в той или иной форме энергии синтезируются органические молекулы. В частности, аминокислоты, сахара, углеводороды, жирные кислоты, нуклеотиды.
2. Указанные молекулы частично полимеризуются, создавая небольшие макромолекулярные комплексы, включая олигомеры. Начинается естественный отбор указанных комплексов, в котором накапливаются в основном макромолекулы, способные катализировать реакции, приводящие (прямо или косвенно) к синтезу собственных копий, либо увеличению степени их устойчивости к эффектам распада (деградации).
3. Одна из подобных молекул (РНК длиной в несколько десятков нуклеотидов, предшественник современных тРНК) оказывается способной как к неферментативной саморепликации (через синтез комплиментарной копии), так и к катализу цепочек, состоящих их двух или более аминокислотных остатков.
4. Начинает действовать дарвиновский отбор, происходит селекция молекул прото-тРНК с удерживаемыми ими в петлях, на концах стеблей и/или другим способом аминокислотами на предмет выживаемости в условиях ограниченных ресурсов (свободных нуклеотидов, аминокислот и т.д.).
5. Указанный в предыдущем пункте отбор и мутации при копировании РНК приводит к постепенному улучшению скорости и точности репликации аминорибозимов. В частности, известно, что в современных РНК полимеразах в активном центре фермента располагаются три остатка аспаргиновой кислоты (см. например, здесь), удерживающих в необходимой для эффективного прохождения реакции позиции ион магния. Вполне возможно, что аналогичным образом расставленные в "правильных" местах РНК (или входящие в состав коротких протеноидов, удерживаемых РНК за счёт водородных связей, см. выше) эти легко синтезируемые абиогенно аминокислоты могли существенно улучшать способность РНК к самокопированию. Аналогичным образом постепенное"обрастание" взаимодействующих при образовании пептидной связи прото-тРНК дополнительными петлями, аминокислотами и небольшими белками могло в результате пошаговой эволюции привести к появлению большой единицы рРНК. Когда эффективность и точность синтеза протеинов достигла таких уровней, что уже не было смысла в "привязке" к рРНК отдельных аминокислот, соответствующие её участки, селективно связывающие определённые аминокислоты, стали анахронизмом, лишь мешающим "возмужавшим" рибосомным протеинам наиболее эффективно делать свою работу, и, как следствие, начали вырезаться в процессе созревания рРНК, но соответствующие следы в интронах остались, и теперь доносят до нас весточки от тех древних времён.
6. Отделение рибосомных протеинов от их собратьев, выполняющих метаболические функции, начало их независимой эволюции и окончательный разрыв (в том числе, чисто механический, в смысле отсоединения от тела рибосомы) "метаболической" компоненты от "рибосомной", появление малой единицы рРНК и "классической" трансляции белков. Начало собственно клеточной эволюции.
Насколько описанный выше сценарий совпадает с реально происходившими несколько миллиардов лет назад событиями пока сказать трудно, но, так или иначе, можно констатировать, что наука медленно но верно приоткрывает всё новые страницы в таинственной книге под названием "происхождение жизни".
