Ещё немного про происхождение хлорофилльного фотосинтеза в свете последних данных
Относится к разделу Молекулярная биология
С момента моей последней публикации на обсуждаемую тему прошло ещё совсем немного времени, но вышедашая недавно , обобщающая последние данные по метаболическим путям синтеза тетрапирролов предоставила мне хороший повод её дополнить, тем более, что новые данные вполне укладываются в идеи, в ней изложенные.
Почему нам так интересен этот класс органических молекул и пути их синтеза? Дело в том, что именно основанные на них кофакторы играют очень важную роль в древнейших метаболических циклах. В качестве примеров можно назвать витамин B12, являющийся одним из ключевых кофакторов цикла ацетогенеза (он же путь Вуда-Люнгдаля), кофермент F430, без которого невозможен метаногенез, всевозможные гемы, без которых обходится лишь небольшое число, в основном, весьма архаичных метаболических циклов, а так же хлорофиллы и бактериохлорофиллы, основные коферменты и пигменты цепочек хлорофилльного фотосинтеза. Что же сделали авторы новой статьи? Они обобщили все данные о путях синтеза указанных коферментов, накопленные за последние годы, в результате чего им удалось построить общую схему, отображающую ветвящееся дерево вариантов построения этих важнейших молекул. Эту схему можно сравнить с филогенетическим деревом, построенным на основе сравнения геномов различных организмов. Соответственно, её анализ может помочь нам в восстановлении очерёдности происхождения и родственных связях наиболее древних метаболических путей.
Итак, посмотрим, что же получилось у авторов. Во-первых (что, впрочем, было известно уже достаточно давно), все цепочки имеют общий корень и отходящий от него общий ствол. В результате реакций, соответствующих движению снизу-вверх по данному стволу, из глутаминовой кислоты и глицина постепенно, шаг за шагом, синтезируется уропорфириноген III. Тот факт, что первые реакции данного синтеза идут на тРНК и коферменте А дополнительно подтверждает его архаичность. На Рис.1 молекула уропорфириноген III, соответствующая первой точке ветвления дерева метаболических реакций, изображена в самом низу, а все предыдущие шаги ведущей к ней цепочки для упрощения восприятия опущены. Дальше, как уже было сказано, дерево раздваивается. Одна его ветка ведёт к синтезу коферментов B12, F430, сирогема, переносящего электроны к активному центру сульфит и нитрит редуктаз, гема d1, играющего важную роль в восстановлении нитрита, а так же непременного участника многих метаболических циклов гема b. Условный "последний общий предок" у всех перечисленных коферментов - сирогидрохлорин. Далее в него вставляется либо атом кобальта, либо атом никеля, либо атом железа, и в зависимости от помещённой в центр молекулы металла, продолжается синтез соответствующего кофактора. Кстати, читая обсуждаемую статью, я не без удовольствия узнал, что, наконец, определена полная цепочка синтеза кофермента F430. Как выяснилось, все протеины, которые участвуют в его сборке, кроме одного, я из общих соображений правильно определил в статье, написанной ещё в 2012-м году (сам себя не похвалишь - никто тебя не похвалит ). Последним недостающим ферментом оказался гомолог пептидогликан лигазы MurF из цепочки сборки клеточной стенки бактерий (как он попал к археям, отдельный интересный вопрос!). Но вернёмся к "нашим баранам". Вторая ветка, начинающаяся от уропорфириногена III ведёт к альтернативному пути синтеза гема b, и его производных (гемы c, d, о и a), хлорофиллов и бактериохлорофиллов, а так же фоторецепторов и вспомогательных пигментов антенн хлорофилльного фотосинтеза цианобактерий и растений (фикоцианобилин и другие билины). Начнём наш анализ с первой ветки (они изображена в правой части Рис. 1), так как она, предположительно, более древняя, ибо участвует в синтезе коферментов, участвующих в метаболических цепочках, по общему мнению являющимися одними из самых ранних.
). Последним недостающим ферментом оказался гомолог пептидогликан лигазы MurF из цепочки сборки клеточной стенки бактерий (как он попал к археям, отдельный интересный вопрос!). Но вернёмся к "нашим баранам". Вторая ветка, начинающаяся от уропорфириногена III ведёт к альтернативному пути синтеза гема b, и его производных (гемы c, d, о и a), хлорофиллов и бактериохлорофиллов, а так же фоторецепторов и вспомогательных пигментов антенн хлорофилльного фотосинтеза цианобактерий и растений (фикоцианобилин и другие билины). Начнём наш анализ с первой ветки (они изображена в правой части Рис. 1), так как она, предположительно, более древняя, ибо участвует в синтезе коферментов, участвующих в метаболических цепочках, по общему мнению являющимися одними из самых ранних.
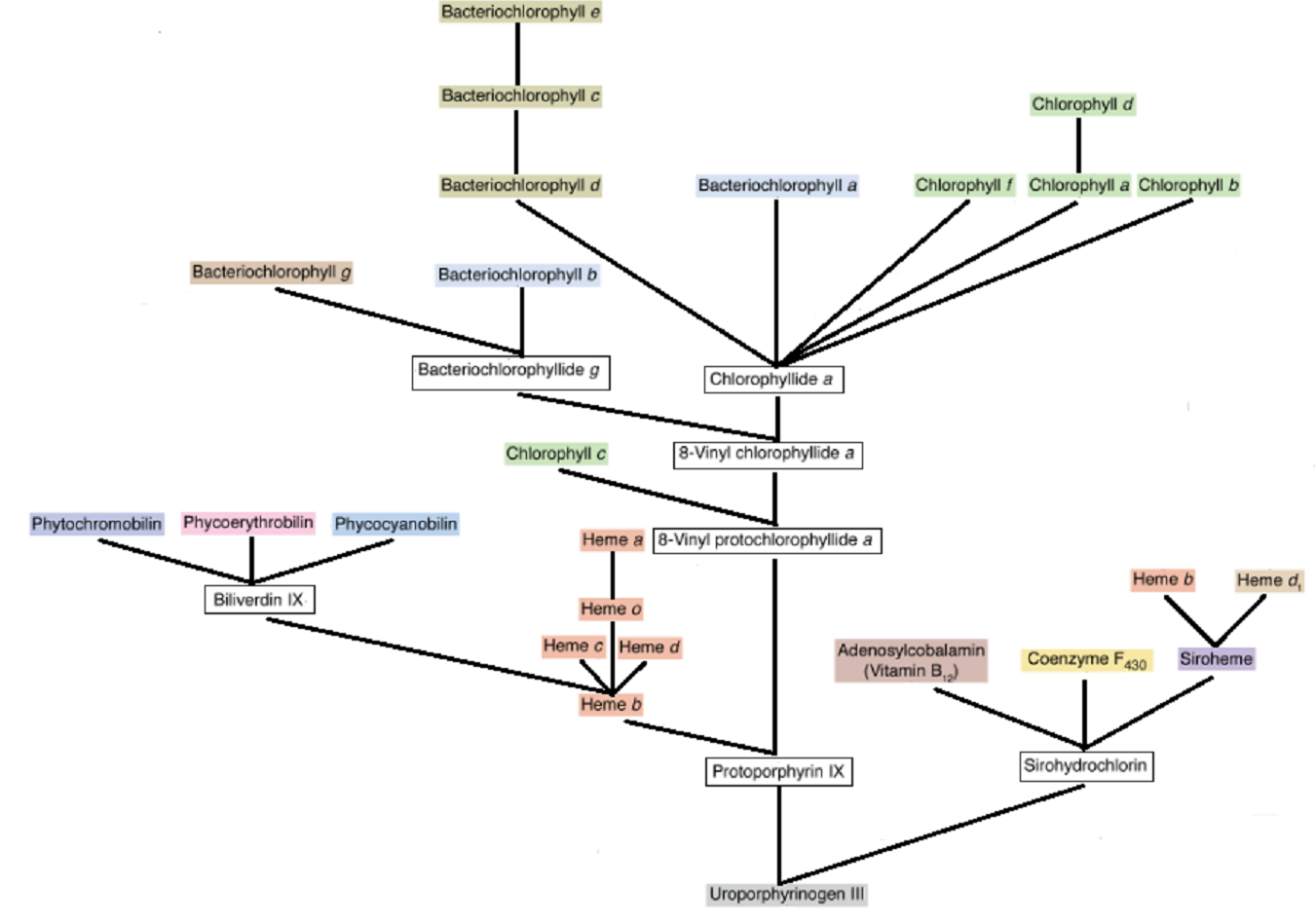
Рис. 1. Упрощённая схема синтеза тетрапирролов, участвующих в качестве коферментов в различных метаболических циклах бактерий, архей и эукариот. Адаптировано из Рис. 14 обсуждаемой .
В контексте данной публикации нам особенно интересна подветка первой ветки, ведущая к сирогему. В ней из сирогема впоследствии синтезируется либо, по-видимому, самый распространённый в живых системах, гем b, либо достаточно экзотический гем d1. Последний пока обнаружен лишь в составе восстанавливающего кислород и нитрит комплекса cd1, а про многочисленные намёки на связь цепочек работы с оксидами азота с возможным происхождением хлорофилльного фотосинтеза автор уже писал в предыдущей статье. Процесс восстановления нитрита на геме d1 можно схематически увидеть на Рис. 2, взятом из работы. Как видно из рисунка, атом азота нитрита фиксируется на находящемся в центре гема d1 ионе железа, после чего окружающие его два остатка гистидина взаимодействую с одним из атомов кислорода нитрита, отщепляя его. Экстрактированный анион кислорода, получая ещё один дополнительный электрон от железа, которое окисляется от Fe2+ до Fe3+, извлекает из цитоплазмы два недостающих протона, превращаясь, тем самым, в молекулу воды.
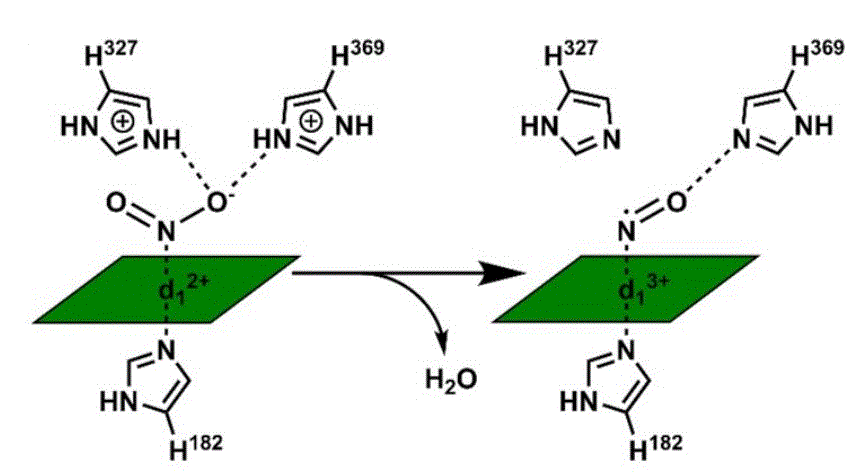
Рис. 2. Схема восстановления нитрита до оксида азота на геме d1, взято из статьи.
Теперь давайте вернёмся к главному предмету нашего интереса - основной ветке, которая идёт от уропорфириногена III вверх. Она, в свою очередь, раздваивается от молекулы протопорфирин IX. В зависимости от того, что вставляется в центр протопорфирина, мы далее вступаем либо на дорогу, ведущую к хлорофиллам и бактериохлорофиллам, либо на путь, ведущий к всевозможным вариантам гемов и пигментов антенн фотосинтеза и фоторецепторов цианобактерий и некоторых растений. В частности, простая вставка в протопорфирин IX иона железа сразу даёт нам классический гем b, пожалуй, наиболее широко распространённый из всех существующих гемов. Что касается пигментов антенн цианобактерий и фоторецепторов, то, они синтезируются, на первый взгляд, весьма странным образом. Из только что с таким трудом построенного гема b уже на следующем шаге опять вынимается ион железа, после чего он контролируемо деградирует до линейной цепочки, состоящей из четырёх пирролов (с боковыми звеньями), связанных между собой атомами углерода. Это соединение, которое называется биливердин IX, в зависимости от конечного пункта назначения, в свою очередь, подвергается дальнейшим небольшим модификациям. Такой окольный путь синтеза пигментов, необходимых для работы реакционных центров фотосинтеза, намекает, как минимум, на то, что в момент формирования соответствующей системы гем b уже активно участвовал в различных метаболических циклах. Если вместо железа в молекулу протопорфирина IX вставляется магний, дальнейший путь ведёт к синтезу всевозможных разновидностей хлорофиллов и бактериохлорофиллов. При этом, скорее всего, к моменту формирования аппарата хлорофилльного фотосинтеза гем b уже активно использовался в других метаболических цепочках (см. выше). Данное обстоятельство предоставляет возможность выдвинуть гипотезу о появлении хлорофилла в результате ошибочной вставки в протопорфирин IX иона магния вместо иона железа. Как это могло произойти? Известно, что сам протопорфирин IX синтезируется из своего предшественника - протопорфирогена IX путём изъятия у последнего сразу шести электронов. У части аэробных бактерий (включая большинство цианобактерий) эту работу выполняет содержащий в качестве кофактора гем b протеин, кодируемый геном HemJ, а у многих анаэробных и факультативно анаэробных бактерий аналогичная функция возложена на не родственный ему протеин, кодируемый геном HemG, и использующий в качестве кофактора флавин-мононуклеотид (сокращённо - FMN). Полученные от протопорфирогена IX электроны передаются затем на хиноны и вместе с ними направляются к встроенным в мембрану комплексам, передающим их, в свою очередь, конечным акцепторам (см. Рис. 3). Ими могут быть либо (в аэробных и микроаэробных условиях) восстанавливающие кислород до воды комплексы цитохром bo3 и/или цитохром bd, либо (в анаэробных условиях) восстанавливающая нитрат до нитрита мембранная нитрат редуктаза Nar или мембранный комплекс восстановления фумаратовой кислоты до янтарной Frd. Во всех вариантах, кроме использования в качестве окислителя фумаратовой кислоты, на этапе синтеза протопорфирина IX осуществляется запасание свободной энергии за счёт перекачки протонов из цитоплазмы в периплазму.
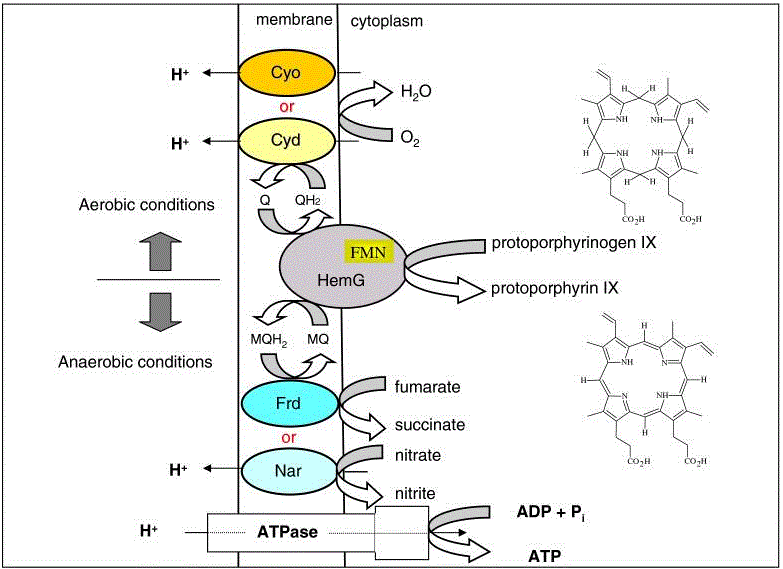
Рис. 3. Варианты окисления протопорфирогена IX до протопорфирина IX в общей цепочке синтеза синтеза гемов и (бактерио)хлорофиллов. Взято из статьи.
Так как хлорофилльный фотосинтез, очевидно, появился до оксигенизации атмосферы, далее мы будем рассматривать только анаэробную версию интересующей нас цепочки. Из двух возможных вариантов применяемых в ней окислительно-восстановительных комплексов более древним, по-видимому, является Frd, так как он, как правило, использует для передачи электронов только архаичное решение в виде железосерных "проводов", в отличии от более "продвинутой" схемы нитрат-редуктазы Nar, которая основана на паре гемов b. Кроме того, отсутствие механизма запасания энергии в виде протонного потенциала в случае использования комплекса Frd так же намекает на его появление на очень ранних этапах эволюции жизни. Для дальнейших рассуждений можно взять за отправную точку тот факт, что синтез протопорфирина IX является предпоследним шагом в цепочке синтеза гема b (последним шагом является собственно вставка атома железа). При этом, нитрат-редуктаза Nar сама использует два гема b. Если доступность нитрата является лимитирующим фактором в данной цепочке синтеза гемов, то на лицо положительная обратная связь - наличие в среде нитрата будет стимулировать синтез гемов b, что, в свою очередь, будет способствовать увеличению количества комплексов Nar, его восстанавливающих, что приведёт к ещё более активному синтезу гемов b и т.д. Таким образом, появившийся в бескислородной внешней среде мощный окислитель в виде NO3- благодаря положительной обратной связи может быть оперативно использован для запасания энергии в виде мембранного потенциала. Тот факт, что только-что синтезированные гемы b сразу же используются для синтеза новых нитрат-редуктаз подтверждается и авторами . Соответственно, в сухом остатке получается, что в процессе синтеза протопорфирина IX генерируются как свободные электроны, необходимые для работы нитрат-редуктазы Nar, так и гемы b, необходимые для окончательной сборки соответствующих комплексов.
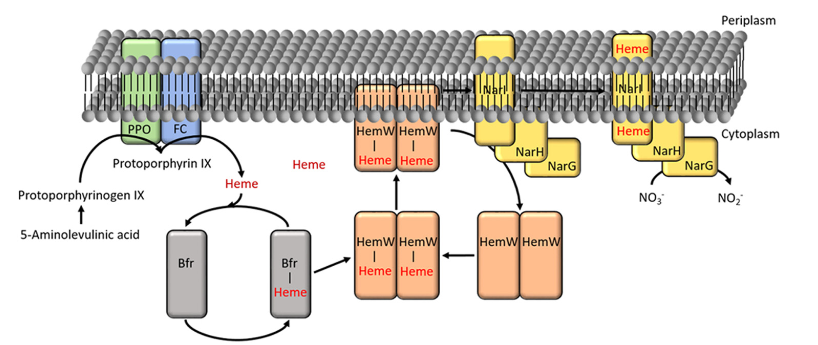
Рис. 4. Рисунок из вышеупомянутой , демонстрирующий, что вновь синтезируемые гемы b тут же связываются бактериоферритином и транспортируются для последующего использования на завершающем этапе синтеза субъединицы нитрат-редуктазы NarI, на структурном уровне являющейся почти полным аналогом классического цитохрома b(b6) в комплексах bc1 и b6f.
Примечательно, что нитрат-редуктаза Nar использует для проводки электронов через мембрану решение, практически идентичное тому, что используется в широко распространённых классических комплексах bc1 и b6f, при этом, роль цитохрома b (или b6) с двумя гемами b играет её гамма субъединица, кодируемая геном NarI. Не смотря на это, гомологии между соответствующими протеинами обоих комплексов не наблюдается. Это может быть следствием конвергентной эволюции либо быстрой дивергенции обоих белков от общего предка под воздействием мощных факторов отбора. Как было показано (см. ), современный вариант цитохрома b мог появиться в результате слияния "короткого" варианта протеина цитохром b, содержащего четыре трансмембранные спирали (его принято обозначать как b6 или PetC) и дополнительной субъединицы (обозначаемой как Subunit IV или PetD) имеющей три трансмембранные спирали и не содержащей гемов b, но связывающей одну молекулу хлорофилла a.
Итак, как уже говорилось выше, можно предположить, что (прото)хлорофилл мог получиться путём случайной вставки в протопорфирин IX магния вместо железа, так как известно, что соответствующая хелатаза не особенно разборчива относительно различения атомов вставляемых ею металлов, окисленных до второй степени. Кстати, хорошо бы задуматься, а почему в данном случае вообще используется такой странный способ взаимодействия окислителя и восстановителя - за небольшой период времени практически одновременно отдаются сразу шесть электронов при том, что на один цикл восстановления всех перечисленных выше молекул нужно ощутимо меньшее их число? В статье, на которую я уже неоднократно ссылался, я предположил, что, в одном из возможных вариантов, система хлорофилльного фотосинтеза могла постепенно развиться на основе цепочки восстановления нитрата до аммония. При этом, второй шаг данной реакции (восстановление нитрита) требует как раз ровно шесть свободных электронов, а комплекс, осуществляющий данную реакцию (цитохром с нитрит редуктаза) принимает электроны именно с хинонов. Наличие в анаэробном пути окисления протопорфирогена IX варианта с нитратом в качестве окислителя даёт дополнительные очки нашему предположению. Действительно, представим, что у нас уже есть цепочка восстановления нитрата до аммиака с помощью посредничества хинонов в два этапа (нитрат=>нитрит=>аммиак). Исходно удобным источником электронов для, как минимум, второй реакции мог быть протопорфироген IX, в который, после этого, "что бы добро не пропадало", вставлялся атом железа, превращая его, тем самым, в гем b. Но в результате достаточно низкой разборчивости хелетазы иногда вместо железа в протопорфироген IX вставлялся магний, что в итоге приводило к синтезу магний-протопорфирина, близкого родственника хлорофиллов а и с. Он мог застревать между трансмембранными спиралями другого небольшого протеина, ставшего в итоге предком субъединицы PetD но исходно, по-видимому, выполнявшего иные функции. Наличие в цитоплазматической мембране двух расположенных рядом друг с другом протеинов, возможно, являвшихся предками субъединиц PetC и PetD, стимулировало появление ранее отсутствующего сайта связывания хинонов вблизи её внутренней границы, так как при наличии такого сильного окислителя, как хлорофилл, это давало возможность в условиях хорошей освещённости осуществлять с помощью хинонов прокачку протонов из цитозоля в люмен вне зависимости от наличия во внешней среде в ощутимых количествах нитратов, и по этой причине могло было закреплено отбором. Впоследствии локализованные в цитозоле субъединицы, отвечающие за восстановление нитрата (обозначены на Рис. 4 как NarH и NarG), были утрачены за ненадобностью, а выступающая в периплазму часть комплекса наоборот приобрела белок Риске и цитохромы f и c1, что, в конечном итоге, и привело к появлению функциональной системы, явившейся, как минимум, общим предком современных комплексов b6f и bc1, а, возможно, что и всех современных реакционных центров фотосинтеза.
Оценить статью можно после того, как в обсуждении будет хотя бы одно сообщение.
Тест: А не зомбируют ли меня? Тест: Определение веса ненаучности
| Обнаружен организм с крупнейшим геномом Новокаледонский вид вилочного папоротника Tmesipteris oblanceolata, произрастающий в Новой Каледонии, имеет геном размером 160,45 гигапары, что более чем в 50 раз превышает размер генома человека. | Тематическая статья: О вере в полеты американцев на Луну |
Рецензия: Комментарии к статье Теория функциональных систем П.Анохина | Топик ТК: Метод Павлова |