Влияние модулированного биоструктурами электромагнитного излучения на течение аллоксанового сахарного диабета у крыс
ВЛИЯНИЕ МОДУЛИРОВАННОГО БИОСТРУКТУРАМИ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ НА ТЕЧЕНИЕ АЛЛОКСАНОВОГО САХАРНОГО ДИАБЕТА У КРЫС
П.П.Гаряев, А.А.Кокая*, И.В.Мухина*, Е.А.Леонова-Гаряева, Н.Г.Кокая*
Комментарии – в конце статьи.
Для возможности популяризации некоторое пояснение текста статьи.
Коротко говоря, автор давал крысам яд, вызывающий смерть (аллоксан, в использованных дозах приводящий к летальной недостаточности инсулина). В контрольной группе крыс просто облучали светом лазера, и они дохли как положено. В другой группе крыс облучали сквозь препарат, и в результате этого свет оказывал целебное действие – крыс не дохли. Т.е. получался лечебный свет, по теории автора несущий в себе некую "информацию", оказывающую восстановительное воздействие.
Как, в виде чего может свет нести подобную информацию, а ткани воспринимать ее – сакраментальная основа теории автора.
* Инкомнаука, Москва.
** Центральная научно-исследовательская лаборатория Нижегородской государственной медицинской академии, Нижний Новгород.
Ключевые слова: аллоксановый диабет, лазерное излучение, широкополосное электромагнитное излучение.
____________________________________________________________________________
Целью настоящего исследования явилось изучение влияния модулированного поджелудочной железой и селезенкой широкополосного электромагнитного излучения, генерированного гелий-неоновым лазером, на течение экспериментального сахарного диабета у крыс, вызванного внутрибрюшинным введением аллоксана. Продемонстрировано, что воздействие данного излучения на животных является информационным, феноменологическим, приводит к увеличению продолжительности жизни животных, нормализации уровня глюкозы в крови, регенерации поджелудочной железы.
Объектом нашего исследования явилось изучение влияния модулированного биоструктурами широкополостного электромагнитного излучения (ШЭИ) на течение экспериментального сахарного диабета у крыс линии Wistar. Диабет моделировали внутрибрюшинным введением аллоксана в дозе 200-300 мг/кг массы тела животного.
Для получения модулированного биоструктурами широкополосного электромагнитного излучения (ШЭИ) применяли ранее разработанную нами биотехнологию работы с использованием гелий-неонового лазера . Гелий-неоновый лазер мощностью 2 мВт и длиной волны 632.8 нм, имеет две совмещенные, ортогонально линейно поляризованные моды излучения, одночастотные в каждой из них. Лазерный луч проходит через биоструктуры, то есть через свежевыделенные препараты поджелудочной железы или селезенки новорожденной крысы той же линии Wistar. Препарат наносили на предметное стекло и помещали на оптической оси лазерный луч-препарат. Юстировку предметного стекла с препаратом производили таким образом, чтобы обеспечить частичное обратное отражение луча в резонатор лазера. Такой многопроходный режим позволяет препарату выступать в роли оптического коррелятора [1] и влиять на распределение вторичных мод излучения лазера. Для регистрации сигнала корреляции использовали две пространственно разнесенные моды с перпендикулярной поляризацией. Оптические сигналы регистрируются и поступают на электронную схему, которая управляет режимом генерации лазера, при котором интенсивности мод наиболее скомпенсированы. В этом режиме работы лазер генерирует ШЭИ, зависящее от зондируемого биопрепарата. Расстояние от препарата до активного элемента лазера 11см. Фотоны луча лазера на встречных пучках модулируются препаратом, в том числе по двум связанным ортогонально поляризованным компонентам излучения.
МЕТОДИКА ИССЛЕДОВАНИЯ
В экспериментах использовали половозрелых самцов крыс линии Wistar в возрасте 5-6 месяцев, средней массой 180-220 грамм. Экспериментальный сахарный диабет вызывали путем внутрибрюшинного введения 1,0±0,2 мл раствора аллоксана (от 200 до 300 мг/кг веса животных) после 24 часового голодания на фоне нормальных показателей уровня глюкозы в крови животных. Животные были разделены на 3 группы по 10 животных в каждой: 1-я группа – контроль без воздействия ШЭИ, 2-я и 3-я группы – опыт, подвергаются воздействию ШЭИ. В 1-ой и 2-ой группах аллоксан вводили в дозе 200 мг/кг, в 3-й группе - 300 мг/кг. 2-ю группу животных располагали на расстоянии 70 см от лазера как источника ШЭИ, 3-ю - на расстоянии 20 м от источника ШЭИ в частично экранированном (подвальном) помещении лаборатории.
Контроль (10 крыс) на немодулированное ШЭИ. Использовали чистое предметное стекло без препарата поджелудочной железы, т.е. лазерный луч зондировал стекло без препарата.
Облучение 2-ой группы крыс начинали на 3-е сутки с момента введения аллоксана. 3-ю группу начинали облучать в день инъекции аллоксана. Воздействие излучением проводили по 30 минут ежедневно, в течение 4-х дней по схеме: 10 минут воздействие ШЭИ, полученным в результате прохождения лазерного луча через препарат с тканью поджелудочной железы; 10 минут воздействие ШЭИ, полученным в результате прохождения лазерного луча через препарат с тканью селезёнки; 10 минут воздействие ШЭИ, полученным в результате прохождения лазерного луча через препарат с тканью поджелудочной железы.
Во время эксперимента оценивали общее состояние животных, фиксировали день гибели животных с момента введения аллоксана во всех наблюдаемых группах. Животных в опытных группах наблюдали в течение 1,5 месяцев c момента введения аллоксана. У 5 крыс с максимальный подъем уровня глюкозы в крови после введения аллоксана оценивали репродуктивную функцию (3 крысы из 2-ой группы и 2 крысы из 3-й группы).
Регистрацию уровня глюкозы в крови осуществляли глюкометром Ascensia Entrust фирмы Bayer. Диапазон измеряемого уровня глюкозы от 2,0 ммоль/л до 30,6 ммоль/л. Значения уровня глюкозы в крови выше 30,6 ммоль/л обозначались как >30,6 ммоль/л (HI).
Изъятие тканей сердца, легких, печени, почек, селезенки и поджелудочной железы для макроскопического описания и гистологического исследования проводили: в контрольной группе на 3-ие сутки с момента введения аллоксана, что соответствовало дню максимальной гибели животных; во 2-й и 3-й группах через сутки после последнего дня воздействия ШЭИ, что соответствовало 7-м суткам с момента введения аллоксана во 2-й группе и 4-м суткам в 3-й группе, а также на 42-е сутки эксперимента у выживших животных. Для гистологических исследований ткани фиксировали в 10% нейтральном формалине, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Парафиновые срезы толщиной 5-7 мкм получали на микротоме Leica SM 2000R, окрашивали гематоксилином и эозином и анализировали с помощью микроскопа Leica DMLS. Видеоизображения получали на видеосистеме с помощью CCD-камеры.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Применение субтоксических доз аллоксана в контрольной группе способствует развитию сахарного диабета, осложненного токсическим повреждением ряда жизненно важных органов и систем, что приводит к высокой летальности (70%) уже на 3 сутки (Рис.2). Гибнущих животных в терминальном состоянии подвергали эвтаназии, органы изымали для патоморфологического исследования. В контрольной серии отсутствовало самопроизвольное снижение уровня глюкозы в крови за период наблюдения. В контроле на действие немодулированного ШЭИ все крысы погибли на 4-й день.
Применение ШЭИ отчетливо влияет на течение экспериментального аллоксанового диабета во 2-й группе (Рис. 1). Отмечено, что у 80% животных после воздействия ШЭИ происходит достоверное снижение показателей уровня глюкозы в крови (Рис. 1, табл. 1). 20% животных умерли на фоне выраженной гипергликемии на 6-7-е сутки после введения аллоксана, что отличается от контрольной группы (Рис. 2). Через сутки после последнего воздействия ШЭИ, т.е. на 7-е сутки эксперимента, провели эвтаназию 3-х животных, у которых изъяли ткани для патоморфологического исследования. Уровень глюкозы в крови у крыс перед эвтаназией был в пределах физиологической нормы ( 5,56±0,12 ммоль/л ).
Пять выживших крыс наблюдали в течение 1,5 месяцев. У 3-х из них оценили репродуктивную функцию. Одна крыса не дала потомства и умерла на 40-е сутки после введения аллоксана, что весьма существенно отличается от контрольной группы (Рис.2). Две другие крысы дали полноценное потомство 14 и 11 крысят. Через 1,5 месяца после введения аллоксана у оставшихся в живых 4-х крыс были изъяты ткани для патоморфологического исследования. Уровень глюкозы в крови у этих животных составил менее 10 ммоль/л.
Воздействие ШЭИ повлияло на течение экспериментального аллоксанового диабета в 3-й группе, где вводили аллоксан в дозе 300 мг/кг. В этой группе отмечен высокий уровень летальности, однако её показатели отличны от 2-ой и контрольной групп. (Рис.2). Несмотря на большую дозу введённого аллоксана для этой группы животных характерно увеличение продолжительности жизни по сравнению с контролем. Смертность в этой группе на 4-е сутки с момента введения аллоксана составляла 50% по сравнению с контролем 100%. У двух крыс 3-ей группы в течение длительного периода наблюдения (1,5 месяца) было отмечено колебание уровня глюкозы в крови от нормальных до максимальных значений (>30,6 ммоль/л). Аналогичную картину наблюдали у одной крысы во 2-й группе. Несмотря на явную гипергликемию в течение всего периода наблюдения, общее состояние этих животных расценивали как удовлетворительное, они были активны и прожили 40 суток с момента введения аллоксана. Через сутки после последнего воздействия ШЭИ, т.е. на 4-е сутки, провели эвтаназию 2-х животных и изъяли ткани для патоморфологического исследования. За оставшимися животными (3 крысы) наблюдали 1,5 месяца. У 2-х из них оценивали репродуктивную функцию, которая была снижена.
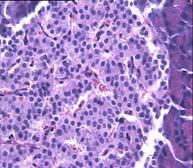
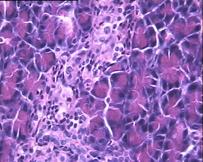
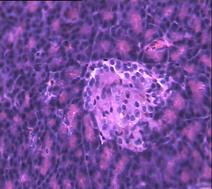
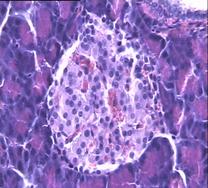
При гистологическом исследовании препаратов поджелудочной железы в указанных группах выявлен ряд особенностей (Рис.3). В отличие от интактных крыс (Рис.6 (а)) при гистологическом исследовании поджелудочной железы животных с аллоксановым диабетом (контрольная группа) выявлены выраженные дегенеративные изменения островков Лангерганса (Рис. 3(b)). Число и размер островков уменьшены, форма их неправильная. Количество β-клеток в островках резко снижено, в большинстве из них отмечалась вакуолизация цитоплазмы, уменьшение размеров ядер, конденсация хроматина, в некоторых клетках - кариопикноз. Выявлено наличие лимфоцитарного инфильтрата вокруг и внутри части островков. Гистологическая картина препаратов поджелудочной железы 2-ой группы на 7-е сутки с момента введения аллоксана отличалась признаками функционального напряжения работы островка в отличие от препаратов контрольной группы. Существенным отличием являлось то, что ядра в основном были не повреждены (Рис. 3(с)). Наличие большого количества мелких островков правильной формы, нормальной гистологической структуры вблизи кровеносных синусов и протоков, спустя 1,5 месяца с момента введения аллоксана, возможно говорит об активации регенерационных процессов в поджелудочной железе (Рис. 3(d)).
Обсуждение результатов
Полученные результаты затрагивают фундаментальную проблему хранения и передачи управляющей генетической информации в ходе эмбрионального и постэмбрионального развития. В рамках данных экспериментов мы должны были убедиться в принципиальной возможности стимулировать регенерацию поджелудочной железы у крыс in situ с помощью ШЭИ, модулированного (через фотоны) препаратом поджелудочной железы крыс той же линии. Результаты подтвердили наши ожидания. Встает вопрос, является ли такая регенерация следствием управления с помощью ШЭИ, содержащего искусственно привнесенную в него генетическую информацию? Допустим, следствием воздействия на стволовые клетки крови или стволовые клетки остаточных структур разрушенной аллоксаном поджелудочной железы? Или: является ли регенерация результатом пускового (триггерного) воздействия ШЭИ такого рода? Пока мы не можем дать однозначные ответы. Есть некоторые предположения, основанные на более ранних наших работах преимущественно теоретического характера. Вероятно, в данном акте регенерации работают принципы квантовой нелокальности (спутанности (entanglement)) морфогенетической информации, связанной с поляризационной (спиновой) модуляцией фотонов лазерного луча и с последующим преобразованием фотонов в ШЭИ [2-4]. В определенной мере это подтверждается недавними результатами по успешному «введению информации» (свойств) различных веществ непосредственно в головной мозг испытуемых людей с помощью спутанных спиновых состояний [5]. Для этого авторы использовали импульсное магнитное поле, фотовспышку, СВЧ-излучение и красный лазерный свет для того, чтобы создать «спутанные состояния» между спинами ядер атомов действующих веществ (морфий, хлороформ, дейтерохлороформ, диэтиловый эфир, никотин, кофеин и др.) и спинами ядер вещества головного мозга.
Литература
1. А.И. Мазур, В.Н. Грачев Электрохимические индикаторы. – М.: Радио и связь, 1985.
2. Gariaev P.P., Birshtein B.I., Iarochenko A.M., Marcer P.J., Tertishny G.G., Leonova K.A., Kaempf U., The DNA-wave biocomputer. “CASYS” – International Journal of Computing Anticipatory Systems (ed. D.M.Dubois), Liege, Belgium, v.10, pp.290-310 (2001);
3. Gariaev P., Tertishniy G. The quantum nonlocality of genomes as a main factor of the morphogenesis of biosystems. // 3th Scientific and medical network continental members meeting. Potsdam, Germany, may 6-9, 1999. p.37-39.
4. И.В.Прангишвили, П.П.Гаряев, Г.Г.Тертышный, В.В.Максименко, А.В.Мологин, Е.А.Леонова, Э.Р.Мулдашев, 2000, Спектроскопия радиоволновых излучений локализованных фотонов: выход на квантово-нелокальные биоинформационные процессы. Датчики и Системы, №9 (18), с.2-13.
5. Huping Hu and Maoxin Wu. Nonlocal Effects of Chemical Substances on the Brain Produced through Quantum Entanglement. PROGRESS IN PHYSICS, V.3, pp. 20-26, July 2006.
Рис. 1. Динамика изменения уровня глюкозы в крови и течение аллоксанового диабета у крыс 2-й группы. Животным введен аллоксан в дозе 200 мг/кг и произведено воздействие ШЭИ от ткани поджелудочной железы и селезёнки новорожденного крысенка. Воздействие осуществлялось в течение 4-х дней с экспозицией 30 минут. Расстояние от источника излучения 70 см. Режим воздействия ШЭИ: 10 минут с использованием ткани поджелудочной железы, 10 минут с использованием ткани селезёнки и 10 минут с использованием ткани поджелудочной железы. Исходный день соответствует дню введения аллоксана. Дни воздействия ШЭИ - 3, 4, 5 и 6 сутки с момента введения аллоксана.
Рис. 2. Влияние ШЭИ на летальность животных (%) при моделировании аллоксанового диабета
Рис. 3. Структура ткани поджелудочной железы, островки Лангерганса: a - интактные крысы,; b - контроль, после введения аллоксана в дозе 200 мг/кг; c – крысы 2-й группы на 7-е сутки с момента введения аллоксана в дозе 200 мг/кг и через сутки после воздействия ШЭИ; d – во 2-й группе через 1,5 месяца после введения аллоксана и воздействия ШЭИ.
Ув 1х400, окраска гематоксилином и эозином.
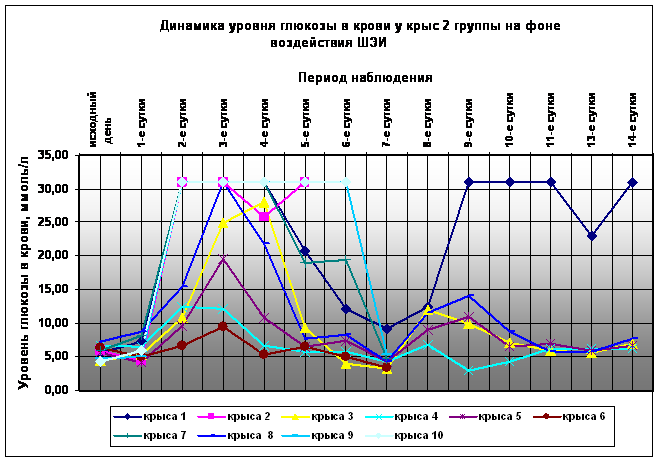
Рис. 1.
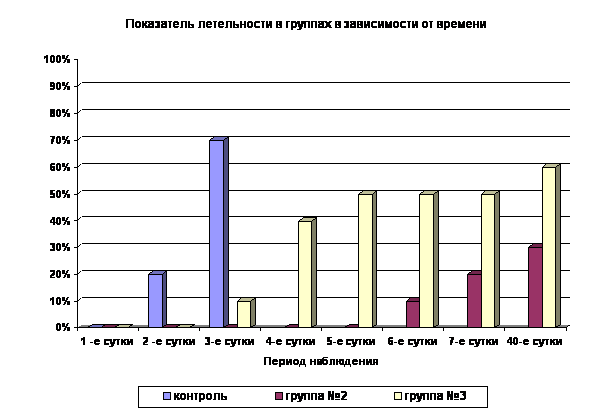
Рис. 2.
|
|
|
|
|
|
Рис. 3.
Таблица 1.
Средние показатели уровня глюкозы в крови у крыс 2-ой группы до и после воздействия ШЭИ, находившейся на расстоянии 70 см от источника излучения
|
Среднее значение n=10 |
Уровень глюкозы в крови, моль/л |
||
|
1-й день, исходный |
3-е сутки, начало воздействия ШЭИ |
7-е сутки, после воздействия ШЭИ |
|
|
M ± m |
5,70±0,30 |
* 25,21±1,03 |
**6,75±0,6 |
*- р < 0.05 по сравнению с исходным уровнем глюкозы в крови
**- р < 0.05 при сравнении показателей уровня глюкозы в крови до воздействия и после него.
Гаряев П. П.
Кокая А.А.
Мухина И.В.
Леонова-Гаряева Е.А.
Кокая Н.Г.
Гаряев Петр Петрович. 123056, Москва, р.т. 363 10 10 , доб 2400; д.т. 253 21 70;
сот. 8 916 231 29 60
Текст статьи настолько запутан (трудно представить, что не намерено), что пришлось самому сделать некую выборку, распутывая все так, чтобы была ясная картина. Вот наглядно сгруппированные данные:
1-я группа (контроль)
аллоксан вводили в дозе 200 мг/кг
Использовали чистое предметное стекло без препарата поджелудочной железы, т.е. лазерный луч зондировал стекло без препарата. С какого расстояния?? ведь у него тоже возможно влияние.
Изъятие тканей - на 3-ие сутки с момента введения аллоксана
2-я группа
аллоксан вводили в дозе 200 мг/кг
расстояние от лазера 70 см
Облучение начинали на 3-е сутки с момента введения аллоксана
Изъятие тканей - 7-м сутки с момента введения аллоксана
3-я группа
аллоксан вводили в дозе 300 мг/кг
расстояние от лазера 20 м в частично экранированном (подвальном) помещении
Облучение начинали в день инъекции аллоксана
Изъятие тканей - 7-м сутки с момента введения аллоксана
Данные по резистентности к летальным дозам аллоксана, представленные в виде графика (Рис.2), достаточно наглядные.
Другие результаты не стал распутывать-расшифровывать (я не мазохист). Выводы.
Если первая группа облучалась с 70 см, то только ее можно действительно считать контрольной (3-я строго не контролируется из-за различия в дозировке аллоксана), изъятие же тканей в разное время вообще не сопоставимыми результаты на картинках со структурой тканей (здесь вообще не понятно: изъятие у только что умерших в данный срок или у любых).
Из всего запутаного (с намеренной небрежностью?) текста
зависимость смертности от облучения – единственно впечатляющая. Хотя не
понятно, третья группа дохнет быстрее из большей удаленности или большей
дозировки аллоксана?? Поэтому просто не обращаем внимание на эту явно не
вписывающуюся никуда 3-ю группу.
Самая впечатляющая нестыковка сейчас будет описана.
Облучение крыс 2-й группы начинали на 3-и сутки с момента введения аллоксана, крыс 3-й группы - в день инъекции аллоксана.
20% животных (2-ой группы) умерли на фоне выраженной гипергликемии на 6-7-е сутки после введения аллоксана, что отличается от контрольной группы.
20% животных (контрольной группы) умерли на фоне выраженной гипергликемии на 2-е сутки после введения аллоксана, что отличается от контрольной группы.
Результат проиллюстрирован диаграммой:
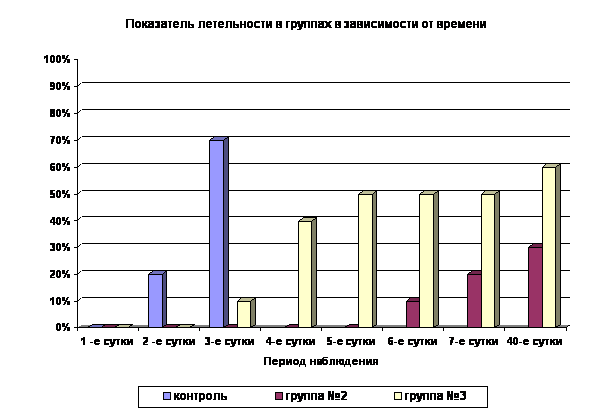
видно, что 70%умерли на 3-и сутки т.е. тогда, когда вторую группу только начали облучать.
Но ведь до 3-го дня контрольная группа НИЧЕМ не отличалась от 2-ой группы потому, что " Обучение крыс 2-й группы начинали на 3-и сутки с момента введения аллоксана ". И на диаграмме вплоть до 3-х суток смертность 2-1 группы должна была быть такой же как контрольной. Но ее нет. Вот и все.
Можно было вообще не путаться во всем этом, а просто утверждать, что при получении летальных доз облученные через препараты крысы фактически перестают умирать (только почему-то сдыхают на 10-40-е сутки). И это настолько чудесный результат, что все биологи просто обязаны бы кинуться проверять и изучать это явление.
Но никто не может повторить исследование просто потому, что в методике отсутствует самое главное: не описано как именно реализуется "Оптические сигналы регистрируются и поступают на электронную схему, которая управляет режимом генерации лазера, при котором интенсивности мод наиболее скомпенсированы.". Т.е. не ясно что конкретно нужно проделывать с излучением для получения заявленного эффекта. Не говоря уже о таинственно-недоговоренном: " Юстировку предметного стекла с препаратом производили таким образом, чтобы обеспечить частичное обратное отражение луча в резонатор лазера." Насколько "частично обратное"? Ну и т.п.
Мое личное впечатление: статья на редкость небрежна как в плане методологии, так и вообще в плане представления информации. 99% интуитивно ощущаемой вероятности некорректности проведения опытов и проведения статистики (возможно, отбраковывались "нехорошие" данные и т.п.). Коробит неграмотное представление о возможности модуляции самих фотонов. Они могут переизлучаться, уже другими, но никогда никакой фотон не может никак измениться, оставаясь в своей фотонной стезе (на само поле ничто не воздействует, только оно может воздействовать на вещество или образовывать вещество). Это более дико звучит, чем если сказать о том, что в транзисторе модулируются отдельные электроны, а не их поток.
Больше всего текст статьи напоминает описание волшебной палочки Г. Грабового, которую он запатентовал в РОСПАТЕНТ: http://www.scorcher.ru/art/mist/grabovoy/grabovoy8.php а стиль описания - Грабового же теорию: http://www.scorcher.ru/art/mist/grabovoy/grabovoy9.php написанной в той же запутанной форме, вовсе не рассчитанной на то, что это будет возможно распутать и постичь.
Предположим, что П.П.Гаряев просто не научился ясно выражать мысли и ненамеренно все запутывает по каким-то причинам (плохому танцору все мешает, как известно).
Но он – гений, которого все еще не могут понять неблагодарные коллеги и открыл Явление, и даже привел Опыт, его наглядно доказывающий. (не буду спрашивать, а почему такой какой-то неказистый и не эффектный, ведь уже давно он на расстоянии воздействует на организмы, суля недругам порчу, а себе омоложение). Но, учитывая столь революционно ниспровергающий нафиг результат, просто необходимо, в соответствии с научной методологией, отнестись к нему с максимальным недоверием и с максимальной тщательностью. А это предполагает воспроизведение результатов другими заинтересованными исследователя не связанных друг с другом групп. Вот после всестороннего подтверждения и можно бить в фанфары и свысока посмотреть на всяких жалких мосек, смеющих гавкать на великого.
Кроме этого, было прислано следующее замечание по поводу фразы: "В экспериментах использовали половозрелых самцов крыс линии Wistar в возрасте 5-6 месяцев, средней массой 180-220 грамм."
Что это за дистрофики в возрасте 6 месяцев вес такой? а авторы вообще-то крыс взвешивали и знают какой нормальный вес соответствует возрасту?
В самом деле да, этому возрасту обычно соответствует вес порядка 250-300г, а верхняя граница у Гаряева - куда ниже нижней в норме. Что-то тут очень не правильно.