Депрессия и деперсонализация, Нуллер Ю.Л.
|
Введение |
|
|
В психиатрии депрессией обозначают широкий и нечетко очерченный круг психических расстройств. Как указывают многие исследователи, дополнительные трудности возникают из-за нечеткости и многозначности самого термина «депрессия»: им определяют симптом сниженного настроения, синдромы, в которых сниженное настроение рассматривается как ведущий компонент и заболевание («эндогенная депрессия»), симптоматика которого исчерпывается чисто аффективными синдромами — депрессивными или депрессивными и маниакальными. Диагностика депрессии как синдрома или заболевания осуществляется на основании ряда психопатологических критериев, главным из которых является депрессивное настроение. При этом предполагают, что в основе каждой из выделенных синдромологических или нозологических единиц лежат однородные патогенетические механизмы. Если бы это предположение удалось подтвердить, то клиническая группировка депрессивных состояний, основанная на анализе психопатологических проявлений, лишилась бы элемента произвольности, поскольку стало бы возможным установить, какие именно симптомы или констелляции симптомов в наибольшей степени коррелируют с определенными патологическими процессами, обусловливающими заболевание. Кроме того, отдельные симптомы или группы симптомов приобрели бы большую прогностическую ценность в отношении выбора и исхода терапии, так как современные методы лечения в психиатрии являются патогенетическими. Однако на настоящем уровне знаний патогенетические механизмы депрессии остаются еще во многом неясными, и клинические критерии пока являются единственным инструментом диагностики. Учитывая это, в настоящей работе делается попытка связать особенности клиники депрессивных состояний с результатами экспериментальных исследований и терапии, причем различные психотропные препараты рассматриваются и используются не только как лечебные средства, но одновременно и как инструмент исследования, как «фармакологический скальпель». Поэтому клинические особенности действия различных лекарств сопоставляются с их фармакологическими свойствами, и на основании такого сопоставления делаются попытки исследования структуры депрессивных состояний и их группировки. Так как при таком подходе возникают методические трудности, обусловленные множеством разнообразных параметров и сложностью их взаимоотношений, в работе использовались методы многомерной статистики (факторный анализ). Значительные трудности и разногласия имеются в отношении деперсонализации. Сам термин крайне неудачен («обезличивание»), хотя введший его Дега подчеркивал, что деперсонализация это не потеря чувства «Я» (иногда встречающаяся у больных шизофренией), а ощущение потери своего «Я». Это ощущение потери «Я» является одним из многих и не самым частым проявлением деперсонализации. Сам термин употребляется для обозначения симптома, синдрома, а некоторые авторы предлагают ввести понятно «деперсонализационная болезнь». Чаще врачи относятся к деперсонализации как к второстепенному симптому, не учитывая его сильного влияния на течение психозов и их курабельность. Поэтому в работе применялись те же методы для исследования деперсонализации, которые использовались для изучения депрессии. |
||
|
ГЛАВА 1 ЭТИОЛОГИЯ МАНИАКАЛЬНО-ДЕПРЕССИВНОГО ПСИХОЗА |
|
|
|
В конце прошлого столетия мышление врачей находилось под сильным влиянием успехов, достигнутых Пастером и его последователями. Расчленение аморфной группы «лихорадок» на ряд самостоятельных заболеваний, каждое из которых было обусловлено определенным возбудителем, укрепило представление о том, что в основе каждой нозологической единицы должен лежать один и тот же этиологический фактор. Поэтому, хотя нозологическая группировка психозов осуществлялась Крепелином только на основании клинических критериев, предполагалось, что каждое заболевание имеет определенную этиологию. Однако отсутствие данных об этиологии и патогенезе психозов заставляло Крепелина постоянно подчеркивать предварительный характер предложенной им классификации. За последние десятилетия делались многочисленные попытки связать причину маниакально-депрессивного психоза с тем или иным экзогенным или эндогенным фактором, но почти все они в настоящее время представляют лишь исторический интерес. Многочисленные исследования, проведенные в 60-70-х годах, обнаружили некоторые звенья патогенеза МДП, но его этиология до сих пор остается невыясненной. В отношении этиологии МДП возможны 3 предположения:
Единственным фактором, большое значение которого в возникновении МДП не вызывает сомнении, является наследственная предрасположенность. Уже Э. Крепелин (1904) обнаружил наследственную отягощенность почти у 80% больных МДП. В большом количестве последующих исследований наследственная отягощенность при МДП оценивалась от 50 до 80%. Эти различия обусловливались диагностическими критериями, учитываемой степенью родства и некоторыми другими обстоятельствами. Наиболее убедительным фактом, свидетельствующим о большой роли наследственности при МДП, является повышение вероятности заболевания им родственников больного по мере увеличения близости родства. На это указывают сводные данные нескольких исследований (Kraines S., 19571: если болен один из родителей, то заболевают от 24 до 33,3% детей, а если оба родителя — то 66,7%. Среди родственников больного аффективные психозы встречаются: у родителей — в 24%, у братьев и сестер — в 23-24%, у разнояйцевых близнецов — в 26,3%, у однояйцевых — в 95,7% случаев. Однако у значительной части больных МДП (от 20 до 50% по данным разных авторов) генетическую отягощенность выявить не удается, что препятствует безоговорочному признанию патологической наследственности в качестве единственного этиологического фактора. Правда, можно предположить, что наследственная предрасположенность к МДП имеется у всех заболевших, но по различным причинам ее просто не удалось выявить. Эти причины включают в себя малочисленность семьи больного, раннюю смерть ближайших родственников, неправильно установленное отцовство, потерю информации о заболеваниях родных из-за большой миграции населения (например, во время войны, блокады Ленинграда), стремление больных и их родственников скрыть наличие наследственных заболеваний и т. п. Кроме того, нельзя исключить возможность спонтанных мутаций, которые обусловили психоз у больного, но еще не успели проявиться у его потомков. Большое число больных МДП без выявленной наследственной отягощенности делает подобное предположение малоубедительным, но чтобы с уверенностью отрицать генетическую обусловленность психоза у этой части больных, необходимо специальное исследование. При проведении такого исследования мы исходили из следующего предположения: если во всех случаях МДП имеется наследственная предрасположенность, но у части больных она была установлена, а у другой части ее не удалось выявить, то по существу различий между этими двумя группами больных нет. Если же действительно имеются две группы больных МДП — с наследственной предрасположенностью и без нее, то можно ожидать, что между ними обнаружатся определенные различия, так как если в первом случае возникновение МДП связано с генетической неполноценностью, то во втором, очевидно, должны иметься какие-то другие причины, обусловившие заболевание. Поэтому при сравнении частоты различных вредностей в анамнезе больных с наследственной отягощенностью и без нее можно ожидать, что во второй группе обнаружится преобладание каких-то ненаследственных патогенных факторов, приведших к возникновению психоза. Если же верно первое предположение, т.е. что обе группы не отличаются друг от друга по наличию наследственной предрасположенности, то при сравнении их по частоте потенциальных вредностей различие выявлено не будет. С целью проверки этих альтернативных гипотез мы сравнивали частоты ряда факторов, возможно, связанных с возникновением МДП у двух групп больных: 1) с выявленной и 2) не выявленной наследственной отягощенностью. В работе были использованы анамнестические данные 340 больных «типичным» МДП. Все эти больные длительное время (от 3 до 15 лет) находились под постоянным наблюдением. Подавляющее большинство больных перенесли более 3 фаз, психопатологическая картина которых не включала гетерогенной для МДП симптоматики. В межприступных промежутках не отмечалось изменений личности, характерных для шизофрении или органических психозов. Среди больных были 173 женщин и 167 мужчин в возрасте от 20 до 85 лет (соотношение по полу и возрасту в группе частично определялось профилем отделения, в котором лечилась значительная часть этих больных). ТАБЛИЦА № 1
Примечание. Здесь и далее в таблицах и тексте вероятность обычно указывается только для статистически достоверных различий. Достоверность различий определяется по критерию X2. В табл. 1 представлены сравнительные данные о частоте некоторых экзогенных вредностей в преморбиде у 340 больных МДП и отдельно для двух групп больных — с выявленной наследственной отягощенностью психическими заболеваниями и без установленной патологической наследственности. Выли учтены следующие показатели: тяжелые инфекции в детстве с гипертермической реакцией или бредом, судорогами, потерей сознания, малярия, туберкулез, ревматизм, травмы головы и контузии с потерей сознания; длительная и тяжелая психотравмирующая ситуация (психогенный эмоциональный стресс): например, уродства и физические недостатки, болезненно переживаемые больными, тяжелое, инвалидизирующее заболевание у ребенка больной, длительное заключение и т. п. Помимо экзогений, были учтены некоторые преморбидные особенности больных: выраженные черты тревожно-мнительного и гипертимного характера, поскольку в литературе отмечена их связь с аффективной патологией (Суханов С. А., 1910; Каннабих Ю. В., 1914; Kretschmer E., 1926). В подгруппу с выявленной наследственной отягощенностью были включены больные, у которых среди кровных родственников (до 2-й степени родства) были установлены психические заболевания: МДП, шизофрения, инволюционные, старческие, органические и экзогенные психозы, олигофрения и эпилепсия. Как видно в табл. 1, среди больных МДП без наследственной отягощенности статистически достоверно преобладали следующие показатели: малярия, длительный и тяжелый психогенный стресс в анамнезе и тревожно-мнительный характер в преморбиде. Эти показатели, очевидно, должны рассматриваться как «факторы, повышающие вероятность возникновения МДП». Действительно, все обследованные страдают МДП, но у части из них патологическая наследственность обусловила относительно высокую вероятность возникновения психоза и, по-видимому, являлась его причиной или одной из причин, в то время как у другой части больных психоз возник, но без этой причины. Следовательно, заболеванию способствовали какие-то другие факторы, которые как бы восполнили отсутствие наследственной неполноценности, а поэтому должны значительно чаще встречаться среди больных МДП без наследственной отягощенности. Перечисленные выше факторы удовлетворяют этим требованиям. Другое предположение, что наследственная отягощенность психозами понижает вероятность заболевания малярией или тяжелых стрессорных ситуаций, представляется маловероятным. Возможное значение каждого из этих факторов будет рассмотрено ниже. Следует особо оговорить противопоставление характерологических особенностей больных наследственной предрасположенности к МДП. Как известно, черты характера в значительной степени генетически обусловлены. Поэтому если и предрасположенность к заболеванию, и черты характера обусловлены одними и теми же или связанными между собой генетическими факторами, то можно ожидать, что между ними обнаружится положительная корреляция. Однако черты тревожной мнительности отрицательно коррелируют с психотической наследственностью (см. табл. 1). Это указывает на независимость этих факторов и на то, что тревожные черты личности способствуют возникновению депрессии вне зависимости от специфической генетической предрасположенности к МДП. Таким образом, полученные результаты подтверждают вторую из альтернативных гипотез, а именно: что больные маниакально-депрессивным психозом не; представляют гомогенную группу в отношении наличия патологической наследственности. Однако эти данные недостаточны для того, чтобы полностью отрицать роль наследственности в происхождении заболевания даже у определенной части больных МДП. Можно предположить, что наследственная предрасположенность к МДП имелась у всех больных, но лишь в разной степени. Ясно, что в семьях с большей степенью наследственной предрасположенности выше вероятность возникновения этого психоза у нескольких родственников, а другие предрасполагающие к МДП факторы будут реже встречаться у заболевших членов семьи. Наоборот, у больных с меньшей степенью предрасположенности для возникновения МДП в большей мере необходимо наличие других способствующих заболеванию факторов, а вероятность появления МДП среди родственников ниже. Таким образом, приведенное предположение также может объяснить неравномерное распределение некоторых факторов между группами больных с установленной и не установленной наследственной отягощенностью. Если это предположение является верным, т.е. если у всех заболевших МДП имеется выраженная в разной степени специфическая генетическая предрасположенность именно к этому психозу, то следует ожидать, что у больных с гомогенной наследственной отягощенностью (аффективными психозами) будет обнаружено минимальное количество дополнительных факторов, способствующих этому заболеванию. Наоборот, у больных МДП с гетерогенной наследственной отягощенностью (шизофренией, олигофренией, эпилепсией и т. п.) предрасположенность к МДП должна оказаться почти такой же, как у больных без выявленной патологической наследственности, и намного ниже, чем у больных с гомогенной наследственностью, а количество дополнительных предрасполагающих факторов соответственно будет выше. Для проверни правильности этого предположения было проведено сравнение 3 подгрупп больных: с гомогенной наследственной отягощенностью (100 человек), гетерогенной наследственностью (74) и без выявленной наследственной отягощенности психозами (146). Если у больного имелась и гомогенная, и гетерогенная наследственная отягощенность, его относили к группе с гомогенной наследственностью. Больные с четко не установленным характером психотической наследственности не были включены в исследование. Поэтому в табл. 2 входят лишь 320 из 340 первоначально отобранных больных. В этой таблице приведены лишь факторы, между которыми выявлены различия (см. табл. 1). ТАБЛИЦА №2
Полученные данные противоречат высказанному предположению: подгруппы с гомогенной и гетерогенной наследственностью практически не различались между собой по частоте негенетических факторов, повышающих вероятность возникновения психоза, по существенно отличались от группы больных без наследственной отягощенности. Таким образом, помимо гомогенной наследственной отягощенности, заболеванию маниакально-депрессивным психозом способствуют наследственная отягощенность другими психическими болезнями и некоторые негенетические факторы. Эти данные позволяют ответить на первый на поставленных вопросов: МДП не является заболеванием с единой этиологией. Если верно второе предположение, а именно: что понятие МДП объединяет несколько самостоятельных заболеваний, каждое из которых имеет собственную этиологию, то попытка расчленить МДП на отдельные формы должна была бы привести к уменьшению «этиологической гетерогенности» последних (разумеется, если критерии для подобного дробления будут обоснованными). В настоящее время весьма распространенным является представление, что выделенный Крепелином маниакально-депрессивный психоз включает два независимых заболевания: собственно МДП, характеризующийся биполярным течением, и монополярную эндогенную депрессию (Perris С, 1966; Angst I., 1966). В пользу этой точки зрения свидетельствуют существенные различия л характере и частоте наследственной отягощенности, возрасте, в котором дебютирует заболевание, реакции на лекарственные средства, а также некоторые биохимические показатели (подробнее см. табл. 15 в гл. 10). Для проверки этого предположения было проведено сравнение 2 групп больных МДП — с монополярным и биполярным течением — в отношении частоты и возможной роли некоторых факторов, повышающих вероятность возникновения заболевания и перечисленных в табл. 1. Для исследования были отобраны больные, перенесшие не менее 3 развернутых фаз. У большинства из них было более 5 аффективных приступов. Критерием мопополярного течения депрессии являлось полное отсутствие маниакальных эпизодов. В группу с биполярным течением относили те случаи, где до появления первой отчетливой мании было не более 4 депрессивных фаз. Если же развернутая мания появлялась лишь по прошествии 5 и более депрессий, то такие случаи не вводились в исследование. Делалось это с тем, чтобы, исключив переходные формы, получить более четкое разграничение двух групп. Из первоначально исследованных 340 больных МДП 215 отвечали предъявленным требованиям: 95 — с монополярным и 120 — с биполярным течением.
В табл. 3 приведены только показатели, по которым между группами больных с монополярным и биполярным течением обнаружены отчетливые различия, которые, наряду с приведенными выше литературными данными, подтверждают правильность разделения МДП по характеру течения на две формы. В табл. 4 и 5 приведено сопоставление частоты ряда факторов у больных с выявленной и не установленной наследственной отягощенностью отдельно для мононолярного и биполярного типов течения психоза. ТАБЛИЦА 3
ТАБЛИЦА 4
* Применен односторонний критерий значимости для x2 так как нет оснований полагать, что факторы (малярия и тяжелые инфекции в детстве) уменьшают вероятность возникновения МДП. Как видно на табл. 4, среди больных 2-й подгруппы намного чаще отмечалась малярия в анамнезе и преобладали лица с тревожно-мнительным характером. Эти различия не достигали статистически значимого уровня, что, вероятно, обусловлено малочисленностью группы. Обращает на себя внимание значительное преобладание ревматизма в анамнезе больных с наследственной отягощенностью психозами. При биполярном течении МДП различия между подгруппами больных с наследственной отягощенностью психозами и без нее оказались более выраженными (см. табл. 5): у больных без наследственной отягощенности статистически достоверно преобладали тяжелые инфекции в детстве, малярия, а также длительный психогенный стресс. Таким образом, приведенные данные в большей степени соответствуют третьему предположению, т.е. тому, что маниакально-депрессивный психоз является полиэтиологическим заболеванием. Вместе с тем, выявились достаточно четкие различия между монополярной и биполярной формами МДП. Табл. 3-5 показывают, что среди больных с монополярным течением обнаруживается большая частота различных стрессорных, истощающих факторов: намного чаще встречаются тяжелые и длительные психотравмирующие ситуации, больше лиц с тревожно-мнительным характером в преморбиде, т.е. людей, для которых даже обыденная жизнь является источником постоянной тревоги и напряжения. Преобладание позднего начала заболевания у больных без патологической наследственности также указывает на возможную роль истощающих факторов. У больных с биполярным течением МДП значительно выше степень наследственной отягощенности, причем в тех случаях, где психоз дебютировал манией (у 21 больного), патологическая наследственность была обнаружена в 76,2%. Кроме того, при биполярном МДП, очевидно, большую роль играют органические поражения ЦНС, так как в этой подгруппе они статистически достоверно преобладают у больных без наследственной отягощенности (см. 1-ю графу табл. 5). Таким образом, по крайней мере один из механизмов, приводящих к возникновению приступов монополярной депрессии, обусловлен истощением компенсаторных возможностей систем регуляции, которое вызвано чрезмерно длительным и интенсивным эмоциональным стрессом. Очевидно, в тех случаях, где имеется наследственная предрасположенность к депрессии (т. е. эндогенная слабость каких-то звеньев регуляторной системы), для возникновения заболевания требуется менее значительное воздействие стресса на эти звенья. Наоборот, там, где наследственная отягощенность отсутствует, для возникновения депрессии необходимо более длительное и интенсивное давление стресса на системы регуляции, а дебют заболевания представляется более вероятным в пожилом возрасте. Это хорошо согласуется с приведенными выше собственными и литературными данными. Как видно из табл. 3, 5, у больных с биполярным МДП отмечается более массивная наследственная отягощенность; большую роль играют экзогенные вредности, которые могут обусловить органические поражения ЦНС, что подтверждается данными P. Dalen (1965); заболевание начинается в более молодом возрасте. Таким образом, если у больных с монополярным течением можно предположить, что возникновение депрессии частично обусловлено перенапряжением, истощением регуляторных систем мозга, то у больных с биполярным МДП имеется более грубая, наследственная или приобретенная неполноценность механизмов, обусловливающих регуляцию уровня активности организма. Это подтверждается не только большей частотой наследственной отягощенности психическими заболеваниями при биполярном МДП, но и тем, что у больных без патологической наследственности экзогенные факторы, повышающие вероятность возникновения психоза, обычно сочетались, причем весьма частой была комбинация органической неполноценности с интенсивным и продолжительным психогенным стрессом. Вероятно, стресс в этих случаях являлся как бы «разрешающим фактором», и этим объясняется его резкое преобладание у наследственно не отягощенных больных с биполярным МДП (см. табл. 5). Роль ревматизма в анамнезе больных МДП остается неясной. Он встречается чаще у больных с биполярным МДП, а при монополярной эндогенной депрессии коррелирует с наследственной отягощенностью. Кроме того, наличие ревматизма в прошлом не всегда можно было подтвердить, и, возможно, в ряде случаев больные переносили полиартриты другой этиологии. Приведенные данные показывают, что возникновению МДП способствуют различные факторы, причем даже самый значимый из них — наследственная предрасположенность — не является достаточно специфическим, поскольку вероятность заболевания повышается и при наследственной отягощенности другими (не аффективными) психическими заболеваниями. Этот вывод подтверждается данными о психических заболеваниях у потомков родителей, страдавших маниакально-депрессивным психозом. Так, из 250 находящихся под нашим наблюдением детей больных «типичным» МДП, заболели аффективным психозом 25 человек, у 10 была диагностирована шизофрения, у 2 — органическое заболевание головного мозга с эпилептическими припадками, у 8 — олигофрения, у 11 — грубая психопатия (истерическая или шизоидная) и у 2 — невроз навязчивых состояний. Эти цифры меньше данных, приведенных L. Crammer (1970), что, вероятно, обусловлено тем, что большинство детей наших больных — лица молодого или детского возраста. Обследуя 553 человека, родители которых страдали МДП, L. Crammer (1970) обнаружил шизофрению у 2,6% (148 человек), а «обсессивно-компульсивную» симптоматику — у 5,5%.
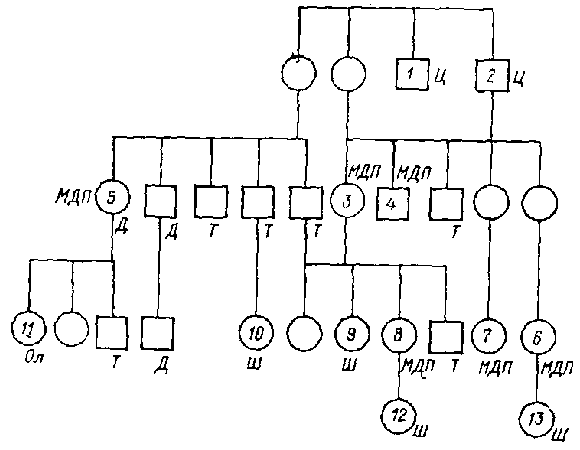
Рис. 1. Генеалогическое древо семьи X.: Ц-циклотимия; МДП- маниакально-депрессивный психоз; Ш-шизофрения; Ол-олигофрения; Т -туберкулез; Д-диабет Таким образом, значительная часть психически заболевших детей унаследовала от родителей, страдавших МДП, предрасположенность к психическим заболеваниям вообще, а по избирательно к МДП. Это особенно отчетливо видно на примере так называемых «дегенеративных» семей. На рис. 1 представлено генеалогическое древо такой семьи. Два брата в первом поколении отличались странностями в поведении, которые, судя по описанию, определялись гипоманиакальными и субдепрессивными состояниями. Второе поколение включало 9 человек, причем из 4 женщин 3 страдали типичным МДП с биполярным течением. Интересно, что у одной из 2 сестер (3) заболевание дебютировало депрессией в 30 лет, а гипоманиакальное состояние наступило непосредственно после 4-й депрессивной фазы в 60-летнем возрасте, в то время как у другой сестры (4), перенесшей в детстве полиомиелит, первая фаза возникла в 16 лет и характеризовалась крайне тяжелой манией, а в дальнейшем быстро установился непрерывно циркулярный тип течения. Из 9 обследованных членов семьи 3-го поколения — 6 женщин, причем у 3 (6, 7, 8) из них возник биполярный МДП в относительно позднем возрасте, у 2 (9 и 10) заболевание диагностировалось в различных клиниках как «периодический психоз», «приступообразная шизофрения» или «атипичный МДП» и характеризовалось частыми тяжелыми онейроидно-кататоническими приступами с отчетливой аффективной симптоматикой (депрессия, страх, мания), и у одной больной была олигофрения. В 4-м поколении отмечалась шубообразная шизофрения с галюцинаторно-параноидной симптоматикой (13) и ранняя (дебют в 4 года) шизофрения с непрерывным течением и появлением эпилептиформных припадков в 17 лет (12). Кроме того, у 3 членов семьи был диабет, а у 7 — туберкулез. Интересно, что начиная со 2-го поколения все психические заболевания возникали только у женщин. Таким образом, если в первых двух поколениях заболевание проявлялось циклотимией и МДП, то в последующих поколениях та же наследственная неполноценность обусловила возникновение шизофрении и олигофрении. Следует также отметить, что среди родственников больных МДП, особенно в так называемых «дегенеративных семьях», встречаются не только больные другими эндогенными психозами, но и случаи олигофрении, эпилепсии, глухонемоты и т. д. Это указывает на то, что в ряде случаев по наследству передается не только предрасположенность к МДП или эндогенным психозам вообще, но и какая-то неполноценность нервной системы, которая может проявиться более грубой, органической симптоматикой. О генетической гетерогенности МДП (биполярного и монополярного) также свидетельствует неоднородность способов наследственной передачи заболевания. В ряде работ было показано, что ген МДП локализован в Х-хромосоме, однако дальнейшие исследования не смогли подтвердить эти наблюдения, хотя в отдельных семьях подобный тип передачи, вероятно, существует. Характер наследственной передачи монополярной и биполярной форм МДП не укладывается ни в моногенную, ни в полигенную модели (Kidd К., Weissman М., 1978), что также указывает на генетическую неоднородность этого заболевания. Все приведенные выше данные свидетельствуют о том, что МДП (эндогенная депрессия) может возникнуть как результат разнообразных наследственно обусловленных и, реже, приобретенных дефектов. Общность клинических проявлений эндогенной депрессии при ее полиэтиологичности указывает на единый патогенез этого заболевания. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 2 ПАТОГЕНЕЗ ЭНДОГЕННОЙ ДЕПРЕССИИ |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
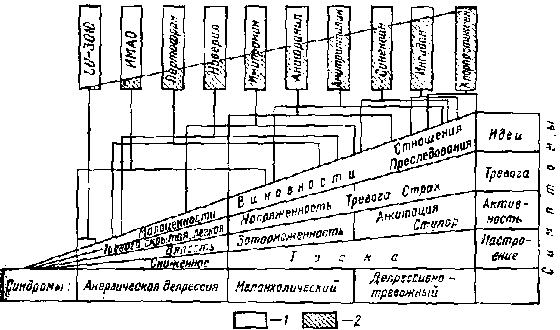
НАРУШЕНИЕ ОБМЕНА МОНОАМИНОВ Как было отмечено в предыдущей главе, полиэтиологичность эндогенной депрессии указывает на наличие каких-то общих звеньев в патогенезе этого заболевания. В настоящее время наибольшее признание имеет так называемая моноаминная гипотеза патогенеза депрессии. Она сводится к тому, что при эндогенной депрессии имеется дефицит в мозге норадреналина и (или) серотонина (Schiedkraut J., 1965; Coppen A 1967; Лапин И. П., Оксенкруг Г. Ф., 19G9). Как известно, норадреналин и серотонин выполняют роль медиаторов в центральной нервной системе и, что особенно важно, в тех отделах мозга, которые участвуют в формировании эмоций, инстинктивного поведения, побуждений, а также вегетативной и нейроэндокринной регуляции. Тела моноаминергических нейронов расположены в верхних отделах ствола мозга и в среднем мозге, а их аксоны достигают ядер лимбической системы, гипоталамуса, нижних отделов ствола мозга, коры мозжечка и неокортекса. Таким образом, синаптические окончания отростков этих нейронов взаимодействуют с основными функциональными областями мозга. Учитывая, что каждый нейрон имеет многие тысячи синаптических окончаний, комплекс моноаминергических нейронов может осуществлять наиболее сложные интегративные процессы. Синтез норадреналина осуществляется в нейронах из тирозина, предшественником которого является фенилаланин. Тирозин под влиянием тирозингидроксилазы превращается в диоксифенилаланин (ДОФА). Путем декарбоксилирования ДОФА превращается в дофамин, который, в свою очередь, под действием дофамин-бета-гидроксилазы превращается в норадреналин. Норадреналин накапливается в пресинаптическом окончании в гранулах, из которых под влиянием нервного импульса он выбрасывается в синаптическую щель и, взаимодействуя с рецепторами постсенаптического окончания, осуществляет передачу нервного импульса на следующий нейрон. В синаптической щели разрушение норадреналина осуществляется катехолометилтрансферазой. Значительная часть неразрушенного медиатора проникает через пресинаптическую мембрану в пресинаптическое окончание («обратный захват» — reuptake), где либо разрушается моноаминоксидазой (МАО), либо вновь поступает в гранулы. Серотонин образуется из незаменимой аминокислоты триптофана, превращающегося под влиянием триптофангидроксилазы в 5-окситриптофан, который, в свою очередь, путем декарбоксилирования превращается в серотонин. Медиаторная функция серотонина осуществляется так же, как и норадреналина, а в инактивации серотонина в пресинаптическом окончании участвует МАО. В пользу моноаминергической теории патогенеза депрессии говорят три группы фактов. Первая группа — фармакологические данные. Две главные группы антидепрессантов — ингибиторы МАО и трициклические препараты — обладают серотонино и адренопозитивным эффектом. Первые необратимо тормозят МАО, препятствуя тем самым разрушению медиаторов в пресинаптических окончаниях, вторые затрудняют обратный захват, за счет чего увеличивается время пребывания медиаторов в синаптической щели и таким образом, удлиняется период взаимодействия моноаминов с рецепторами. Против этого доказательства часто выдвигают следующие возражения: а) антидепрессанты помогают не во всех случаях депрессии; б) несмотря на то, что они действуют на одни и те же медиаторные системы, спектры их терапевтического эффекта весьма отличаются; в) появляются антидепрессанты, непосредственно не воздействующие на моноаминергические структуры, например иприндол; г) препараты типа амфетаминов обладают выраженным центральным адренопозитивным эффектом, но не являются антидепрессантами. Первое из возражений представляется малоубедительным, поскольку средние показатели эффективности антидепрессантов (50-75%) достаточны для подтверждения присущего им антидепрессивного действия, а оставшиеся случаи безуспешной терапии удовлетворительно объясняются различными обстоятельствами, не имеющими прямого отношения к механизму действия этих препаратов: слишком быстрым их разрушением в организме, недостаточной силой терапевтического действия для данного больного, клиническими особенностями депрессии, в частности присоединением деперсонализации, которая обусловливает резистентность к антидепрессивной терапии, и т. д. Различия в особенностях терапевтического действия отдельных антидепрессантов частично объясняются тем, что препараты в разной степени воздействуют на серотонин- и адренергические процессы. Кроме того, они обладают и другими свойствами: трициклические антидепрессанты — холинолитическим эффектом, ИМАО влияют также и на ГАМК-эргические структуры и т. н. Антидепрессивные свойства препаратов, непосредственно не влияющих на моноаминергические процессы, могут быть объяснены двумя причинами: во-первых, дефицит моноаминов, вероятно, является важным, но не единственным звоном патогенеза депрессии; во-вторых, как видно на примере бензодназепинов, некоторое влияние на активность оборота норадреналина и серотонина при стрессе может осуществляться ими опосредованно, путем активации ГАМК-эргичоских процессов. Наконец, отсутствие антиденрессивного эффекта у амфетамина (фенамина), очевидно, обусловлено изолированным воздействием на адренергические, но не серотонинергические процессы. Другим подтверждением моноаминовой гипотезы является депрессогенный аффект резерпина, фармакологическое действие которого основано на истощении содержания норадреналина, серотонина и дофамина в нервных окончаниях. То, что «резерпиновая депрессия» возникает у предрасположенных людей (приблизительно в 6% по данным F. К. Goodwin, W. Е. Bunney, 1971), по противоречит гипотезе, а лишь подтверждает, что дефицит моноаминов является важным, но не единственным звеном в патогенезе эндогенной депрессии. Вторая группа доказательств основана на определении уровня биогенных аминов и продуктов их метаболизма у больных депрессией. Поскольку их непосредственное прижизненное определение в мозге больного человека невозможно, о концентрации и интенсивности обмена серотонина и норадреналина судят по содержанию этих моноаминов и продуктов их метаболизма в моче, крови ч спинномозговой жидкости. Как известно, главным продуктом обмена серотонина в ЦНС к на периферии является 5-оксипидол-уксусная кислота (5-ОИУК), а норадреналина — вапилилминдальная кислота (ВМК) и З-мотокси-4-окси-фепилэтил-гликол (МОФГ). Первые исследования моноаминов и их метаболитов у больных депрессией казались весьма противоречивыми, поскольку больная часть этих веществ, обнаруженных в биологических жидкостях организма, имеет периферическое происхождение. Однако в дальнейшем было показано, что ВМК целиком является продуктом превращения периферического норадреналина, в то время как значительная часть МОФГ образуется из норадреналина в тканях мозга (Ebert M., Kopin I., 1975). В ряде исследований было показано, что содержание МОФГ и моче больных депрессией понижено, однако в дальнейшем у части больных эндогенной депрессией подобного снижения обнаружить не удалось. На основании этого были сделаны попытки выделить отдельные типы депрессии по величине экскреции МОФГ (Luchins D., 1970). Однако следует учесть, что, во-первых, не весь МОФГ в моче центрального происхождения и у части больных его содержание может повыситься при стрессе или из-за повышенной моторной активности за счет усиления норадренергических процессов на периферии. Во-вторых, в подобных исследованиях обычно не учитывают этан и синдром депрессивной фазы, которые, как будет показано ниже, очевидно, могут существенно влиять на обмен катехоламинов. Кроме того, учитывая большие индивидуальные различия между отдельными людьми и малочисленность групп, надежные данные в исследованиях такого рода могут быть получены лишь тогда, когда сам больной служит себе контролем, т.е. когда обрабатывают разность показателей, полученных у одного и того же больного в период депрессии и в интермиссии. Таким образом, данные о снижении уровня норадреналина в мозге при депрессии, полученные на основании определения МОФГ в моче, недостаточно убедительны, хотя у значительной части больных подобные изменения найдены. Как указывалось выше, неизмененные биогенные амины, ВМК и большая часть 5-ОИУК, определяемые в моде и кропи, периферического происхождения и но позволяют судить о метаболизме норадреналина и серотонина в ЦНС. Поэтому особенный интерес представляют их исследовании к спинномозговой жидкости. В статье F. Goodwin, W. Potter (1978) приводятся сводные данные четырех работ о содержании МОФГ в СМЖ у больных депрессией: в двух на них было отмечено снижение МОФГ по сравнению с контролем, в двух других разницы не обнаружили. Из 6 работ разных авторов лишь в 3 было отмечено уменьшение содержании ВМК в ликворе у депрессивных больных, Столь, же неоднородны данные в отношении 5-ОИУК: из 10 исследований только в 5 было отмечено сниженное по сравнению с контролем содержание в ликворе этого продукта обмена серотонина. Поскольку продукты метаболизма моноаминов весьма быстро выводятся из ликвора в кровь, можно предположить, что их концентрация определяется не только скоростью поступления из тканей мозга, но и скоростью удаления из спинномозговой жидкости. Учитывая это, в последнее время для подобных исследований применяют пробенесид, который тормозит транспортную систему, выводящую ВМК и 5-ОИУК (но не МОФГ) в кровь, и приводит к их накоплению в ликворе. В этой же статье приводятся данные 5 исследований, выполненных с пробенесидом: в 4 из них накопление ВМК и 5-ОИУК было значительно ниже, чем в контроле, и лишь в одном — таким же (но эта последняя работа включала всего 11 наблюдений). Таким образом, более чем в половине работ были приведены данные, позволяющие предполагать, что у больных депрессией имеется снижение уровня норадреналина и серотонина в мозге. Были сделаны также попытки прямого определения уровня биогенных аминов в мозге внезапно погибших больных депрессией. Эти исследования включают лишь единичные наблюдения и малоубедительны. Тем не менее в них было показано снижение содержания серотонина в отдельных участках мозга (Luchins D., 1976). Третья группа фактов. Если дефицит норадреналина и серотонина в мозге действительно является существенным звеном патогенеза депрессии, то эти вещества должны были бы обладать антидепрессивным действием. Однако биогенные амины не проникают через гематоэнцефалический барьер, поэтому для терапии больных депрессией были применены их предшественники — L-ДОФА и L-триптофан, проникающие в мозг и там превращающиеся в катехоламины и серотонин. Данные об антидепрессивном эффекте ДОФА в подавляющем большинстве отрицательны, хотя в отдельных случаях отмечали уменьшение психомоторной заторможенности или переход в манию (Bunney W., 1970). Антидепрессивный эффект триптофана был отмечен не но всех работах (Carrol В., 1971), но значительной части исследователей удалось его установить, особенно в тех случаях, где триптофан применялся в сочетании с ИМАО (Михаленко И. Н., 1973). Наши наблюдения соответствуют этим литературным данным: терапевтический эффект триптофана, применяемого в чистом виде, обнаруживался при неглубоких депрессиях. Даже небольшой процент бесспорно установленных случаев положительного терапевтического эффекта (т. е. при достоверном отсутствии вероятности спонтанной ремиссии или какого-либо другого терапевтического воздействия) указывает на то, что препарат, в данном случае триптофан, в определенной мере обладает специфическим антидепресснвным действием, а именно это и является принципиальным вопросом. Триптофан помогает не во всех случаях депрессии, но практически ни один метод лечения, включая и ЭСТ, не дает 100% положительных результатов, а ряд факторов может препятствовать реализации эффекта триптофана: не весь триптофан поступает в ЦНС для синтеза серотонина: часть превращается в серотонин на периферии, часть идет на кинурениновый путь метаболизма, причем не исключено, что некоторые продукты обмена, образовавшиеся на этом пути, могут препятствовать антидепрессивному действию (Лапин И. П., Гура С, 1973). Следует также учесть, что повышению дозы триптофана препятствуют побочные явления, а кроме того, ее увеличение активирует фермент триптофанпирролазу, направляющий триптофан на кинурениновый путь (Curzon G., 1969). Замедление инактивации триптофана и продуктов его превращения вплоть до серотонина, осуществляемое ингибиторами МАО, резко усиливает терапевтический эффект триптофана и самого антидепрессанта. Отсутствие антидепрессивного эффекта у L-ДОФА представляется более очевидным, однако это еще не позволяет отрицать роль дефицита НА в патогенезе депрессии. Во-первых, побочные эффекты ДОФА значительно тяжелее, чем у триптофана, и в большей степени препятствуют наращивания доз, так что отсутствие антидепрессивного действии может быть связало с недостаточностью дозы. Во-вторых, усилить аффект ДОФА ингибиторами МАО рискованно из-за реакции. Несовместимости между этими препаратами. В-третьих, основная масса введенного ДОФА превращается в дофамин, затем норадреналин и далее в адреналин на периферии, а между адреналином на периферии и норадреналином в мозге существуют реципрокные отношения (Бару А. Ы., 1970), так что увеличение уровня адреналина при введении ДОФА противодействует увеличению уровня норадреналина в тканях мозга. Таким образом, ни одна из трех приведенных групп факторов не противоречит, а в большинстве соответствует гипотезе, согласно которой дефицит норадреналина и серотонина играет роль в патогенезе депрессии. Неоднозначность экспериментальных, главным образом косвенных, данных привела к значительному расхождению в их трактовке. В первое время был поставлен вопрос о том, какой же из медиаторов — норадреналин или серотонин — играет ведущую роль в патогенезе депрессии. Так были созданы «катехоламиновая» и «серотониновая» гипотезы патогенеза депрессии. Однако дальнейшее накопление фактов заставило отказаться от столь прямолинейного подхода, и большинство исследователей придерживаются унитарной гипотезы, согласно которой при депрессии имеется дефицит и НА, и серотонина, причем каждый из этих моноаминов «ответствен» за определенный комплекс психопатологической симптоматики: серотонин — за настроение, а НА — за двигательную активность (Лапин И. П., Оксенкруг Г. Ф.,1969). Сопоставление терапевтического действия трициклических антидепрессантов (амитриптилина и имипрамина) и их деметилированных производных (нортриптилина и дезипрамина) показало, что первые в большей степени обладают противотревожным компонентом действия и в то же время препятствуют обратному захвату серотонина, в то время как деметилириванные производные влияют преимущественно на обратный захват норадреналина, т.е. обладают более чистым норадреналинопозитивным эффектом. На основании этого можно сделать вывод, что дефицит серотонина связан с тревогой. Из этих же клинико-фармакологпчееких и биохимических данных конструируются гипотезы, согласно которым существуют клинически сходные, но биохимически различные формы депрессии — серотониндефицитарные и норадреналиндефицитарные. Первые соответственно лучше лечатся препаратами типа амитриптилина, вторые — дезипрамином пли нортриптилином (Goodwin F., Potter W., 1978). Очевидно, подобный подход еще слабо аргументирован, и хотя ряд авторов исследует возможность «биохимической группировки» депрессии, для этого необходимы дальнейшие фактические данные. НАРУШЕНИЕ СЕКРЕЦИИ ГЛЮКОКОРТИКОИДОВ В ряде исследований было отмечено повышение уровня глюкокортикоидов у больных эндогенной депрессией (Gibbons J., Mc Hugh, 1962 и др.). Как известно, секреция глюкокортикоидов осуществляется под влиянием АКТГ, выделяемого задней долей гипофиза; в свою очередь, секреция АКТГ стимулируется образуемым в гипоталамусе кортикотропина-рилизинг-фактором (КРФ). Регуляция секреции глюкокортикоидов осуществляется по принципу отрицательной обратной связи: избыток гормона в крови приводит к угнетению секреции КРФ, что влечет за собой снижение уровня АКТГ и соответственно уменьшение секреции глюкокортикоидов. Чрезмерное снижение уровня глюкокортикоидов в крови активирует выделение КРФ. Таким образом, в нормальных условиях содержание кортикостероидов автоматически поддерживается на стабильном уровне. Стресс стимулирует выброс кортикостероидов. В норме имеются отчетливые циркадные колебания секреции глюкокортикоидов: у человека и дневных млекопитающих их максимальный уровень отмечается во второй половине ночи и первые утренние часы, минимальный — поздно вечером и в начале ночи. Для выявления нарушений регуляции функции коры надпочечников используется дексаметазоновый тест (ДТ). В норме введение синтетического глюкокортикоида дексаметазона по механизму отрицательной обратной связи приводит к уменьшению секреции глюкокортикоидов надпочечниками. В тех случаях, где регуляция нарушена (например, при болезни Иценко-Кушинга), нагрузка дексаметазоном не вызывает снижения секреции АКГТ и гормонов коры надпочечников. Подобное уменьшение чувствительности организма к тормозящему действию дексаметазона было отмечено и у больных эндогенной депрессией (Carrol В., Curtis G., Mendels J., 1976, и др.), хотя не во всех исследованиях удалось подтвердить этот факт. Одной из возможных причин этих расхождений является доза дексаметазона (2 мг), рассчитанная на выявление таких грубых нарушений, как болезнь Иценко-Кушинга, при которой секреция глюкокортикоидов нарушена в несравненно большей степени, чем при депрессии. Увеличение чувствительности дексаметазонового теста было достигнуто за счет удлинения интервала между дачей дексаметазона и определением уровня глюкокортикоидов, причем нарушения ДТ были обнаружены у значительной части больных эндогенной депрессией (Carrol В., Curtis, G., Mendels J., 1976). Учитывая эти данные, а также связь секреции рилизинг-факторов с содержанием биогенных аминов в гипоталамусе (Frohman L., Stachura M., 1975), нами совместно с М. Н. Остроумовой была исследована реакция на дексаметазон у больных с различными формами депрессии. Для увеличения чувствительности ДТ была использована его модификация, предложенная М. Н. Остроумовой (Остроумова М. П., Цыркина Е. В., 1978), при которой доза дексаметазона составляла 0,5 мг. Исследование ставило целью:
Для этого изучали влияние предшественников норадреналина и серотонина — ДОФА и триптофана, а также некоторых психотропных препаратов на показатели ДТ. Дексаметазоновый тест проводили в первые дни после поступления в больницу (обычно на 2-4-й день) до начала терапии. Если же больной до госпитализации получал психотропные лекарства, то перерыв перед исследованием составлял не менее 7-10 дней. В 9 ч первого дня исследования у больного натощак брали кровь из вены. В 23.00 того же дня давали 0,5 мг дексаметазона, а в 9.00 следующего дня брали повторную пробу крови. 11-Оксикортикостероиды (11-ОКС) определяли в сыворотке крови флюрометрическим методом. Высчитывали процент подавления секреции 11-ОКС после нагрузки дексаметазоном, и если он был меньше 30%, то тест считали патологическим. ДТ был проведен у 52 больных эндогенной депрессией — 15 мужчин и 37 женщин в возрасте от 18 до 65 лет. У 29 из этих больных ДТ проводился в динамике в период депрессии и в ремиссии. Кроме того, исследовали 8 больных реактивной депрессией, госпитализированных по поводу суицидных попыток, 9 больных с депрессивно-параноидным синдромом в рамках шизофрении и инволюционного психоза, причем у этих больных бред, галлюцинации и синдром Кандинского-Клерамбо сочетались с отчетливой депрессией, характеризовавшейся суточными колебаниями настроения и витальной тоской. Контрольная группа включала 85 здоровых людей — 22- мужчины и 63 женщины в возрасте от 20 до 65 лет и 11 психотических больных, главным образом шизофренией, без депрессии. Результаты ДТ представлены в табл. 6. Как видно из таблицы, средние показателя у больных эндогенной депрессией статистически достоверно отличались от контроля, причем резистентность к дексаметазону (патологический ДТ — подавление меньше 30%) была обнаружена у 36 больных из 52, т.е. у 69%, в то время как в контрольной группе патологический ДТ обнаружился у 8 из 85 человек, т.е. у 9%. Эти различия также являются статистически значимыми. При исследовании ДТ в динамике было обнаружено, что у всех больных в период ремиссии произошла нормализация показателен, что видно из табл. 7. ТАБЛИЦА № 6 <
ТАБЛИЦА № 7
Таким образом, приведенные данные отчетливо показывают, что нарушение регуляции секреции кортикостероидов (патологический ДТ) связано с приступом эндогенной депрессии: показатели теста в период депрессии достоверно отличались от контроля, а после прекращения фазы полностью нормализовались. Во время депрессии была не только снижена чувствительность к тормозящему действию дексаметазона, но и исходный уровень 11-ОКС был повышенным. Тот факт, что показатели, полученные у больных МДП в ремиссии, полностью идентичны показателям здорового контроля, указывает на то, что обнаруженные в депрессии нарушения присущи именно состоянию депрессии, а не самому МДП на разных этапах этого заболевания (т. е. не только в депрессии, но и в мании и интермиссии). Учитывая это, ДТ, очевидно, может быть использован как вспомогательный метод для распознавания депрессии. То, что ДТ оказался патологическим лишь у 2/3 больных эндогенной депрессией, вероятно, зависит от ряда факторов: во-первых, сама методика оценки эффекта дексаметазона по показателям 11-ОКС в крови несет в себе определенную вероятность ошибки: секреция кортикостероидов надпочечниками осуществляется не равномерно, а короткими пиками продолжительностью по несколько минут, с последующими интервалами. Поэтому, хотя взятие крови производится 2 дня подряд в одно в то же время, не исключена возможность, что в один из дней забор крови будет осуществлен на высоте пика, а в другой день — на спаде. Это обстоятельство создает вероятность искажения данных теста в каждом отдельном случае, хотя при оценке средних результатов группы эти колебания, направленность которых случайна, должны нивелироваться. Вторая причина может заключаться в недостаточно четкой группировке больных. Результаты применения дибензодиазепинов (см. гл. 4 и 6) показали, что у части больных с отчетливо выраженной депрессивной симптоматикой в рамках тревожно-депрессивного состояния ведущим компонентом синдрома была тревога, а собственно депрессивная симптоматика могла рассматриваться как-вторичная. И хотя у этих больных диагностировалась эндогенная (чаще инволюционная) депрессия, показатели ДТ могли оказаться ненарушенными. В-третьих, хотя у части больных подавление 11-ОКС расценивалось как нормальное (30-40%), в период ремиссии они увеличивалось до 60-80%. Это указывает на то, что 30%-ный критерий как показатель патологического ДТ является условным. Учитывая эти замечания, можно утверждать, что изменения чувствительности систем, регулирующих секрецию кортикостероидов, являются достаточно надежным признаком эндогенной депрессии. Больные с депрессивно-параноидным синдромом в рамках других нозологических форм реагировали на нагрузку дексаметазоном точно так же, как и больные эндогенной депрессией (см. табл. 6). Как указывалось выше, хотя симптоматика этих больных включала такие гетерогенные для МДП проявления, как брод преследования и отношения, галлюцинации, псевдогаллюцинации, явления психического автоматизма и др., собственно депрессивная симптоматика была выражена у них достаточно сильно и достигала уровня витальной тоски. Таким образом, патологический ДТ указывает на наличие депрессии психотического уровня, возникшей в рамках как чисто аффективного психоза, так и других психозов в сочетании с присущей этим психозам симптоматикой. Иначе говоря, в этих случаях биохимические механизмы депрессивных состояний идентичны. Это предположение подтверждается том, что показатели ДТ у больных шизофренией без выраженной депрессии были нормальными. Нормальные показатели ДТ были обнаружены у 7 из 8 больных реактивной депрессией. Все эти больные были госпитализированы после суицидных попыток, обусловленных достаточно тяжелой психотравмирующей ситуацией. Их симптоматика включала тревогу, сниженное настроение. Основным содержанием их переживаний являлись события, связанные с психотравмой. В результате лечения транквилизаторами их психическое состояние обычно нормализовалось в течение нескольких дней, реже 1-2 нед. Эти наблюдения интересно сопоставить с тремя случаями реактивно спровоцированной эндогенной депрессии. Вначале они существенно не отличались от больных реактивной депрессией: их также госпитализировали после суицидных попыток, обусловленных психотравмой, однако результаты ДТ у них были патологическими, а в дальнейшем в течении 1,5 лет наблюдения у этих больных возникали повторные депрессии, а у 1 — и маниакальная фаза. Таким образом, все приведенные данные свидетельствуют о том, что при депрессии (эндогенной и психотической) имеет место снижение чувствительности к тормозящему действию дексаметазона. Отсутствие или слабое подавление уровня 11-ОКС дексаметазоном указывает на нарушение механизма обратной связи в регуляции секреции глюкокортикоидов. Можно предположить, что причиной этого нарушения, по крайней мере при депрессии, является дефицит биогенных аминов в мозге, контролирующих секрецию рилизинг-факторов в гипоталамусе, в том числе и кортикотропин-рилизинг-фактора. С целью установления роли серотонина и норадреналина в регуляции секреции глюкокортикоидов у группы больных ДТ проводился на фоне терапии триптофаном и ДОФА. L-триптофан получили 20 человек: 8 больных эндогенной депрессией, 3 психически больных без депрессии и 5 испытуемых без психоза, в том числе 4 пожилых — старше 65 лет. L-ДОФА принимали И человек — 1 эндогенной депрессией, 2 больных психопатией, 6- с болезнью Паркинсона и 2 здоровых испытуемых. ДТ проводили до начала терапии, а затем в ее процессе на максимальных дозах препарата. L-триптофан назначали в дозах от 3,5 до 7 г. в день, причем дозы приходилось на вторую половину суток для того, чтобы основная масса препарата поступала в организм в период меньшей активности триптофанпирролазы. Длительность курса составляла от 7 до 14 дней. Второе определение ДТ обычно приходилось на предпоследний и последний дни лечения. Результаты представлены в табл. 8. В экспериментах на животных было показано, что повышение содержания НА в мозге уменьшает секреции кортизола, а его дефицит соответственно усиливает секрецию глюкокортикоидов (Scapagnini U. и Preziosi P., 1973). Это подтверждается опытами с непосредственным нанесением норадреналина на гипоталамус: норадреналин тормозил продукцию КРФ (Buckingham J., Hodges J, 1977). Как видно на табл. 8, предшественник норадреналина ДОФА вызывал незначительное снижение исходного уровня 11-ОКС и одновременно несколько повышал чувствительность механизмов обратной связи к тормозящему действию дексаметазона. Данные о действии серотонина на регуляцию функции надпочечников крайне противоречивы: с одной стороны, имеются наблюдения о том, что его предшественник — триптофан — увеличивает секрецию глюкокортикоидов (Vernicos-Danellis I., Berger P., Barchas J., 1973); с другой стороны, было показано, что под влиянием серотонина секреция АКГТ и кортизола снижается, а при его дефиците — увеличивается (Vermes I., Molnar D., Telegdy C, 1972). В исследованиях J. Buckingham, J. Hodges (1977) было четко показано, что нанесение серотонина на гипоталамус приводит к повышению продукции КРФ. ТАБЛИЦА №8
ПРИЛОЖЕНИЕ
* Различия статистически достоверны. Данные, приведенные в табл. 8, позволяют объяснить это противоречие: под влиянием триптофана статистически достоверно усилилось подавление секреции 11-ОКС дексаметазоном, что указывает на повышение чувствительности механизмов отрицательной обратной связи. При повышении чувствительности тормозящих механизмов можно было бы ожидать некоторого снижения исходного уровня 11-ОКС, однако лечение триптофаном не привело к его изменениям. С другой стороны, не наблюдалось и повышения уровня 11-ОКС, хотя, исходя из данных J. Buckingham и J. Hodges (1977), этого следовало ожидать. Полученные нами данные становятся понятными, если предположить, что серотонин обладает двояким действием на секрецию глюкокортикоидов: с одной стороны, он стимулирует секрецию КРФ, непосредственно воздействуя на гипоталамус, с другой — он повышает чувствительность к тормозящему действию кортикостероидов, вероятно, за счет воздействия на экстрагипоталамические структуры. Если это предположение верно, то при высоком уровне серотонина в мозге повышение уровня кортизола (при циркадных подъемах или при стрессе) будет большим, но быстро затухающим. Наоборот, при недостатке серотонина величина подъемов будет меньше, но нормализация уровня, обеспечиваемая отрицательной обратной связью, окажется замедленной либо полностью нарушенной, в результате чего должны сгладиться суточные колебания уровня кортизола, главным образом за счет вечерних часов, когда в норме он должен быть низким. Имеющиеся экспериментальные данные подтверждают это: препарат парахлорфенилаланин, обладающий антисеротониновым действием, сглаживает реакцию на стресс и циркадные колебания за счет повышения базального уровня кортикостероидов При эндогенной депрессии, которой свойствен дефицит серотонина, также были обнаружены резкие нарушения циркадного ритма секреции кортизола (Disrupted 24-hour Patterns..., 1973). Косвенным подтверждением того, что нарушенная регуляция секреции глюкокортикоидов при депрессии связана с моноаминергическими процессами, являются результаты применения у больных с тревожно-депрессивным синдромом транквилизаторов — производных бензодиазепинов: седуксена (диазепам) и феназепама. Седуксеном в дозах 30 мг в день лечили 6, а феназепамом (2-6 мг в день) — 27 больных женщин МДП (монополярное течение с поздним началом) и инволюционным психозом. ДТ проводили до начала и на 7-10-й день терапии. Как известно, транквилизаторы этой группы уменьшают оборот норадреналина и серотонина в мозге, т.е. снижают скорость их разрушения и синтеза (Dominic J., Sinha A., Barchas S., 1975). За счет этого эффекта, вероятно, предотвращается истощение этих моноаминов в мозге и уменьшается их дефицит. Из табл. 8 видно, что действие транквилизаторов приводит не только к снижению исходного уровня 11-ОКС, что можно было бы ожидать, учитывая антитревожное (антистрессорное) действие этих препаратов (Вальдман А. В., Козловская М. М., Медведев О. С, 1979), но одновременно достоверно увеличивается подавляющее действие дексаметазона. Поскольку при тревога (стрессе) быстрее происходит истощение норадреналина, так как его ресинтез идет медленнее, чем серотонина, то снижение исходного уровня 11-ОКС под действием транквилизаторов может быть объяснено накоплением норадреналина, в то время как накопление серотонина, очевидно, приводит к повышению чувствительности регуляторных механизмов обратной связи, т.е. к увеличению процента подавления 11-ОКС дексаметазоном. На основании приведенных литературных и собственных данных можно сформулировать некоторые предположения о роли нарушений гипоталамической регуляции секреции кортикостероидов и дефицита биогенных аминов в патогенезе депрессии. Как упоминалось выше, имеющиеся данные указывают на то, что при эндогенной депрессии имеется дефицит норадреналина и серотонина в головном мозге, причем недостаток каждого из этих медиаторов связывается с определенными проявлениями эндогенной депрессии. Кроме того, норадреналин и серотонин участвуют в регуляции секреции кортикостероидов: дефицит норадреналина приводит к повышению уровня кортикостероидов, а дефицит серотонина — к его снижению, по одновременно и к нарушению регуляции по механизму отрицательной обратной связи. Дефицит обоих моноаминов должен привести к такому нарушению секреции глюкокортикоидов, когда при относительно высоком уровне в утренние часы отсутствует нормальное снижение их концентрации в вечерние и ночные часы. Таким образом, создаются условия, при которых имеет место повышенная секреция кортикостероидов, причем это повышение распространяется на весь суточный период, в результате чего различные ферментные системы находятся под непрерывным воздействием глюкокортикоидов. Другими словами, этот хронический гиперкортицизм, свойственный депрессии, можно представить как модель хронического стресса. Известно, что стресс и гиперкортицизм приводят к обеднению мозга биогенными аминами (Bliss E., Zwanziger J., 1966). Конкретные механизмы, посредством которых гиперкортицизм приводит к снижению содержания норадреналина и серотонина, выявлены лишь частично. Так, имеются данные об активации кортикостероидами содержащегося в печени фермента триптофанпирролазы, который обеспечивает перевод триптофана на непуриновый путь обмена, уменьшая количество триптофана, поступающего в мозг и идущего на синтез серотонина (Curzon G., 1969). Кортикостероиды (следовательно, стресс) увеличивают активность и тирозинтрансаминазы печени, что приводит к снижению содержания тирозина в крови (Nemeth S., 1978). Это, в свою очередь, способствует уменьшению синтеза катехоламинов в мозге. Таким образом, при депрессии создается своеобразный порочный круг: дефицит норадреналина и серотонина в мозге обусловливает повышенную секрецию шококортикоидов, а гиперкортицизм, в свою очередь, приводит к дефициту этих моноаминов. Эта гипотеза связывает между собой многочисленные данные о дефиците моноаминов, с одной стороны, и о повышении уровня глюкокортикоидов, а также нарушении циркадного ритма их секреции при эндогенной депрессии — с другой. Очевидно, возникновение подобного порочного круга может быть вызвано дефектами и нарушениями в различных звеньях патогенетической цепи, чем и объясняется полиэтиологичность МДП. Так, генетически обусловленная неполноценность отдельных ферментов, участвующих в синтезе и разрушении серотонина и норадреналина, может привести, особенно при наличии дополнительной нагрузки, к дефициту этих моноаминов. Такой дополнительной нагрузкой могут быть стресс, приводящий к усилению распада и синтеза моноаминов в мозге, и действие препаратов типа резерпина, которые также вызывают ускоренный распад серотонина и норадреналина. Действительно, хорошо известно, что острые стрессорные ситуации провоцируют («преципитируют») приступы депрессии, а резерпин вызывает депрессии у значительной части предрасположенных больных. В этих случаях патологический процесс «запускается» в «моноаминном звене» патогенеза. В других случаях первичным звоном являются «стрессорно-кортикостероидное» звено. Так, известно, что лица с. синдромом Кушинга различного происхождении часто страдают депрессивными состояниями. Весьма часто появление депрессий связанно с, лечением кортикостероидными препаратами в течение длительного времени. Как было показано в гл. I, хронический стресс достоверно повышает вероятность возникновения эндогенной депрессии. Все эти данные хорошо укладываются в предлагаемую гипотезу патогенеза депрессии. Но и каком бы звене ни произошли первоначальная по ломка, или «срыва», в основе патогенеза депрессии не жит нарушение взаимоотношении между этими звеньями, и болезненный процесс развертывается только тогда, когда оба звена — «дефицит моноаминов» и «нарушение секреции кортикостероидов» — образуют систему порочного круга (положительной обратной связи). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 3 ПРЕМОРБИДНЫЕ ОСОБЕННОСТИ БОЛЬНЫХ С ЭНДОГЕННОЙ ДЕПРЕССИЕЙ |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
За последние годы возрос интерес к изучению преморбидных особенностей характера и личности больных МДП. Однако эти исследования встречают большие методический и методологические трудности. Прежде всего это почти неограниченное разнообразие классификаций и описаний личности, обусловленное принципиальными различиями в подходе и в используемых критериях. Это обстоятельство крайне затрудняет сопоставление данных разных исследователей. Другая трудность — отсутствие четкой, достаточно обоснованной и общепринятой классификации аффективных психозов. Не меньшие сложности возникают при интерпретации полученных данных, поскольку выявленные преморбидные особенности больных МДП могут: 1) способствовать или быть причиной возникновения депрессии;
4) не играть никакой роли в происхождении и клинической картине заболевания. До недавнего времени многие психиатры находились под сильным влиянием взглядов Кречмера, согласно которым МДП, как правило, заболевают лица с циклотимным темпераментом и циклической конституцией. Психоз представляет по существу лишь количественное нарастание свойственных данному индивиду врожденных черт: нет граней между циклоидным складом характера — циклотимией и МДП или шизотимной — шизоидной психопатией и шизофренией — различия между ними лишь количественные. Действительно, еще Э. Крепелин (1910) отмечал, что у больных МДП «первый приступ болезни нередко носит характер простого усиления особенностей, обнаружившихся гораздо раньше и в более слабой степени существовавших ВСЮ жизнь, довольно легкое возбуждение или подавленность». Однако такой вариант развитии заболевания не является единственным. Ряд авторов обнаружил среди больных МДП большую частоту (до 90%) лиц пикнического телосложения, но в этом отношении существуют большие различия (от 40 до 90%), что, вероятно, обусловлено критериями, которыми руководствовались при отборе больных. На эти показатели может оказать влияние и местность, в которой проводилось исследование, так как в отдельных областях часто преобладает тот или иной тип физической конституции. Следует учесть, что более значительная корреляция между МДП и циклоидной конституцией была обнаружена старыми авторами. Это, вероятно, частично обусловлено тем, что в начале столетия в больницы попадали более тяжелые и «типичные» больные МДП, а именно на контингенте госпитализированных больных обычно проводились исследования. Наоборот, за последние годы благодаря развитой сети внебольничной психиатрии в поле зрения психиатров стали попадать больные с легкими формами заболевания. Однако некоторыми исследователями, в первую очередь С. А. Сухановым (1910) и Ю. В. Каннабихом (1914), уже давно было показано, что среди больных маниакально-депрессивным психозом весьма часто встречаются лица с психастеническими и тревожными чертами характера. При предварительном исследовании преморбидных черт характера 340 больных мы условно и достаточно грубо выделяли 3 группы: с гипертимным, тревожно-мнительным и «нормотимным» характером. Две первые группы являлись полярными, 3-я — промежуточной. К гипертимным относили людей энергичных, общи тельных, активных, как правило веселых, жизнелюбивых; к тревожно-мнительным — тревожных, нерешительных, не уверенных в себе, подверженных сомнениям, мнительных, нередко ипохондричных, склонных к образованию навязчивостей. Третья группа являлась сборной: в нее вошли лица без резко выраженных черт тревожной мнительности или гипертимности, т.е. с «нормальным» характером, а также истерики, эпилептоиды и т. д. Как видно из табл. 1, 3, 5, среди 340 больных МДП люди с гипертимным характером в преморбиде встречались в 16,8%, с тревожно-мнительным — в 18,5%, т.е. в сумме они составляли несколько больше 1/3 всех больных. Отчетливые различия выявились при сопоставлении монополярного и биполярного МДП (см. табл. 3): в группе больных с монополярным точением психоза отчетливо преобладали лица с тревожно-мнительным характером (27,4%), в то время как при биполярном МДП они составляли только 8,3%. Наоборот, при биполярном течении, по сравнению с монополярным, было больше больных с гипертимным характером (соответственно 20,8 и 12,6%). В группе с биполярным МДП не было корреляции между на следственной отягощенностью и типом характера (см, табл. 5), в то время как при монополярной депрессии тревожно-мнительный и гипертимный характеры чаще встречались у наследственно не отягощенных больных (см. табл. 4). Более тщательное изучение преморбидных личностных особенностей больных МДП обнаруживает у них ряд общих черт, присущих большинству страдающих монополярной депрессией и значительной части лиц с биполярным течением психоза. Для них характерны добросовестность, высокое чувство долга, ответственность. На службе их знают как людей, на которых можнo положиться, которые не уйдут домой, не выполнив порученной им работы. Поэтому начальство охотно поручает им дополнительные задания, особенно если их нужно срочно и хорошо выполнить. В годы учебы они учатся систематически, на экзамены обычно приходят хорошо подготовленными, но экзамены даются им значительно труднее, чем сам процесс |учебы. Они, как правило, мягки, совестливы, удобны в общежитии, стремятся никого не обидеть, не задеть. У них отмечается тенденция к повышению своего социального и образовательного уровня: многие из них посещают различные курсы, кружки, вечерние школы, техникумы, институты или учатся заочно. Вообще этим людям присуще чувство некоторой неудовлетворенности собой и своим положением. Подобные черты в последнее время стали рассматриваться как типичные для преморбида больных эндогенной депрессией (Schimoda M., 1961). Очевидно, в основе этих черт лежат повышенная тревожность, неуверенность, склонность к сомнениям, трудность принятия решения, сенситивность. Эти особенности выражены в разной степени и в некоторых случаях достигают уровня, позволяющего квалифицировать этих людей как тревожно-мнительных личностей. В других случаях они выражены слабо, особенно в юности, и проявляются лишь в определенных ситуациях (болезнь близких, экзамены, резкая перемена ситуации, необходимость принятия ответственного решения, особенно когда имеются альтернативные варианты). Часто тревожность и неуверенность не замечаются ни окружающими, ни ими самими, пока не возникает такая ситуация. Они, так же как их близкие, характеризуют себя в прошлом как веселых, энергичных, достаточно решительных, но несколько впечатлительных и излишне переживающих неприятности. С возрастом черты тревожности и неуверенности начинают постепенно усиливаться. У многих женщин они отчетливо проявляются после родов в виде чрезмерной боязни за ребенка, повышенной заботливости о его здоровье. Иногда они обнаруживаются в период астении после перенесенного тяжелого заболевания. В дальнейшем, в случае неудачно сложившейся жизни, неуверенность и тревожность проявляются все сильнее и могут значительно обостриться, особенно у женщин в период инволюции. В зависимости от степени выраженности, других характерологических особенностей и жизненной ситуации тревожность и неуверенность могут по-разному проявляться и развиваться. Так, отсутствие или ранняя смерть одного или обоих родителей, плохая семейная обстановка, «разбитая семья», ущемленность в микроколлективе, обусловленная различными факторами, например физическими дефектами — заиканием и т. п., могут обострить и ускорить развитие черт тревожности и неуверенности. В других случаях благоприятные условия жизни относительно долго не дают проявиться этим свойствам характера. Однако во всех случаях с возрастом отмечается постепенное нарастание тревожности. При определенной предрасположенности и достаточно высоком уровне тревоги возникают обсессии, причем при дальнейшем усилении тревоги они могут приобрести характер фобий. Наличие обсессии в преморбиде больных инволюционной депрессией или по другим критериям — поздней монополярной эндогенной депрессией — было отмечено многими исследователями (Becker J., 1974). У некоторых больных этой группы можно проследить определенные закономерности развития личности в додепрессивный период. Один из возможных путей идет по типу «гиперсоциализации»: круг возложенных на себя обязанностей и интересов постепенно продолжает увеличиваться, хотя больным все труднее справляться с ними, тем более, что их обычная установка: все делать полностью и доброкачественно — приводит к постоянным перегрузкам. Им все больше приходится выбирать между тем, что нужно делать и что можно отложить. Однако именно необходимость выбора создает для этих людей стрессорную ситуацию. Они начинают метаться между нерешенными проблемами и различными делами, мучаются угрызениями совести, волнуются и все больше запутываются в создаваемой ими же ситуации В этот период нередко появляются неврастенические жалобы, нарушения сна, вегетативные сдвиги, например транзиторная гипертензия. Случайный дополнительный психотравмирующий фактор может спровоцировать возникновение депрессии. Сходная картина нарастания тревоги наблюдается также у людей, которые в силу свойственной им неуверенности стремятся к постоянному самоутверждению: ставя перед собой все новые задачи, подстегивая себя, они создают ситуацию хронического стресса, которая в конечном итоге приводит к астенизации. Утомляемость, снижение работоспособности усиливают их неверие в свои силы и заставляют еще больше напрягаться в попытках добиться поставленных целей. Таким образом, создается своеобразный порочный круг, приводящий к постепенному развитию тревоги. Для другого, противоположного первому, варианта развития характерна тенденция к своеобразной «инкапсуляции». Часто она наблюдается у людей, жизнь которых до возникновения депрессии складывалась по внешним признакам вполне благополучно. Отличительной особенностью развития их личности являются постоянное сужение круга интересов, переключение на одну какую-либо задачу, которая делается главной целью и интересом их жизни. В этой узкой области черты свойственной им и нарастающей с возрастом тревожной мнительности почти не проявляются, в то время как в остальных сферах деятельности неуверенность и тревожность с возрастом заметно усиливаются. Создается впечатление, что в своей узкой, хорошо знакомой сфере интересов они чувствуют себя устойчиво, уверенно и как бы уходят в нее от стрессорных ситуаций окружающей жизни. Постепенно монотематичность интересов приобретает все более выраженный характер. Часто этим доминирующим интересом оказывается творческая работа, однако в достаточно узкой области. В других случаях — это служебная деятельность, для женщин — чаще всего семья, ребенок. В том случае, если неблагоприятно складывающаяся обстановка приводит к крушению этой главной цели, у больных не остается других интересов, контактов, привязанностей, которые помогли бы им перенести потерю. Таким образом, сужая сферу своих интересов с подсознательной цепью оградить себя от повседневных тревог и вызывающего напряжение принятия решений, эти люди как бы сами создают предпосылки для тяжелой декомпенсации при неблагоприятном повороте событий. Как указывают наши наблюдения, подобная декомпенсация может привести к возникновению депрессии (Васильев В. З., Нуллер Ю. Л., 1976). Этот вариант развития среди лиц, заболевших эндогенной депрессией, встречается относительно редко. Таким образом, значительной части больных маниакально-депрессивным психозом присущи определенные свойства характера, в основе которых лежат тревога, неуверенность и которые имеют тенденцию к постепенному нарастанию с возрастом. Эти черты чаше встречаются у больных монополярной депрессией, что хорошо согласуется с данными L. Murray, J. Blackburn (1974). Исследуя психологически 3 группы больных: с чистой тревогой, с биполярным МДП и монополярной эндогенной депрессией, они обнаружили, что в период депрессии во всех 3 группах показатели тревоги были весьма высокими, а в период ремиссии больные монополярной депрессией приближались по своим показателям к тревожной группе, в то время как больные с биполярным течением существенно отличались от них. При интерпретации этих наблюдений мы исходим из ранее представленных данных об этиологии и патогенезе депрессии. С одной стороны, было показано (см. табл. 1), что тревожно-мнительный характер может рассматриваться как фактор, повышающий вероятность возникновения МДП, причем в большей степени — монополярного. С другой стороны, роль постоянной тревоги (стресса) как фактора, способствующего возникновению депрессии, становится понятной, с учетом патогенетического механизма этого заболевания: хроническая тревога (стресс) создает условия для истощения моноаминов мозга и, в конечном итоге, может привести к их дефициту, особенно в том случае, если имеется генетически обусловленная слабость определенных звеньев их метаболизма. Все это позволяет предположить, что описанные выше преморбидные особенности личности больных МДП способны в той или иной степени повышать вероятность возникновения заболевания. Их роль в формировании симптоматики депрессии будет рассмотрена в гл. 4. Как указывалось выше, некоторые характерологические черты, свидетельствующие об элементах тревожности и неуверенности, могут присутствовать у лиц с различными особенностями характера, включая гипертимный. Примером этому может служить одна из наблюдавшихся нами больных с биполярным МДП. Наблюдение 1. В детстве и юности она отличалась веселым, энергичным, с точки зрения окружающих, «легким», решительным, но недобрым характером. Она всегда была в центре компании, была се душой, но в то же время любила подметить чужие недостатки, зло и обидно их высмеивать. Часто увлекалась мужчинами, как правило, старше себя, и в 16 лет впервые вступила и половую связь. Несмотря на то, что испытывала угрызения совести и боялась огласки, продолжала вести тот же образ жизни. Уже тогда заметила, что «подругам кажется, что мне все легко дается, а но-настоящему — тяжело, так как я за все расплачиваюсь переживаниями». В 18 лет был аборт, а затем тяжелое инфекционное заболевание, после которого был весьма длительный (несколько месяцев) период астении, неуверенности, сомнений, однако продолжала учиться в институте и, несмотря на трудности, занималась хорошо и добросовестно. В дальнейшем жизнь сложилась удачно, рано вышла замуж. Муж был старше, опекал ее, создал хорошие материальные условия. Больная продолжала вести несколько рассеянный образ жизни, имела много поклонников, но в то же время достаточно серьезно относилась к работе и была заботливой и тревожной матерью. Отмечала, что даже в периоды полного благополучия и удовлетворенности все время присутствовало чувство, что за это может наступить расплата — что-то может случиться с близкими. В дальнейшем эти черты нарастали. Больная стала испытывать нарастающие опасения за здоровье дочери. В 37 лет после небольшого сердечного приступа, стала фиксировать внимание на своем здоровье. В 40 лет возникла отчетливая депрессивная фаза, а в дальнейшем заболевание приобрело биполярное течение. Таким образом, у некоторой части больных, квалифицируемых как гипертимные, в преморбиде одновременно присутствуют элементы тревожной мнительности, имеющие тенденцию к развитию. Значительно реже среди больных МДП встречаются лица с истерическими чертами, а также эпилептоидного склада. Последние встречались среди больных с биполярным течением и составляли несколько менее 5%. Эти особенности личности привносили своеобразную окраску в депрессивную и в большей степени — в маниакальную симптоматику в период фаз. |
||
|
ГЛАВА 4 СИМПТОМАТИКА И СИНДРОМОЛОГИЯ ДЕПРЕССИВНЫХ СОСТОЯНИЙ |
|
|
|
Основным и, по существу, единственным критерием для диагностики депрессии до настоящего времени является психопатологическая симптоматика. Врач-психиатр практически лишен объективных методов диагностики и оперирует субъективными описаниями или оценками состояния, предъявляемыми самим больным. Поэтому методика опроса больных, умение найти с, ними контакт являются важной предпосылкой для правильной квалификации психических нарушений. Разумеется, нет каких-то одних схем для опроса депрессивного больного. Тактика врача прежде всего определяется особенностями психического состояния и личности больного, а также собственным профессиональным опытом. Тем не менее существуют некоторые общие принципы, которые облегчают контакт с больным и получение необходимой информации. Прежде всего пациент должен ощущать благожелательную заинтересованность врача, его стремление понять больного, разобраться и его переживаниях и принести облегчение. Как бы ни устал или не был занят врач, больной не должен уловить поверхностной торопливости или формального отношения. Врач не должен проявлять снисходительности или как-то показывать свое превосходство. Совершенно недопустим слегка иронический тон, который больные депрессией легко улавливают и болезненно воспринимают, хотя внешне на это не реагируют. Часто лишь, после выздоровления больной рассказывает, как сильно его задели тон или реплика врача. Больной должен чувствовать доверие к врачу как к личности. Иногда его можно завоевать сразу, иногда, особенно у тревожных больных, — лишь после длительного контакта. С другой стороны, между психиатром и больным всегда должна существовать определенная грань: больной должен сознавать, что перед ним не просто сочувствующий, благожелательный человек, но специалист, обладающий профессиональными знаниями, которые он использует на благо своего пациента и которых сам больной лишен. В этом и только в этом должно проявляться превосходство врача. Эта грань, создаваемая манерой беседы и всем обликом врача, должна больному помочь раскрыться: он должен чувствовать, что излагает свои интимные переживания не просто человеку, но профессионалу, который в силу своего положения беспристрастно отнесется к высказываниям больного, не будет осуждать и презирать его, чего часто ожидают страдающие депрессией, не разгласит и не использует во вред сказанное. Иногда только опыт, такт и терпение позволяют врачу преодолеть диссимуляцию депрессивного больного, за которой всегда можно ожидать готовящийся суицид. Мотивы диссимуляции могут быть разнообразными: стремление совершить суицид, боязнь госпитализации и лечения, страх и недоверие по отношению к психиатру, стыд за свои мнимые грехи, чувство вины, боязнь огорчить врача или близких «чрезмерными» жалобами, стремление приковать внимание врача к важным, с точки зрения больного, вопросам и увести его от менее значимых, по его мнению, «второстепенных» вопросов и т. д. В некоторых случаях, особенно среди людей точных, технических специальностей, недостаточное доверие к возможностям врача и, следовательно, к нему самому обусловлено самим характером психиатрического обследования. Больному кажется, что отсутствие объективных методов исследования и подмена их «пустыми разговорами» являются показателями беспомощности врача, «бессилия медицины». Иногда для преодоления негативизма такого больного приходится особо тщательно проводить физическое обследование или назначать дополнительные диагностические процедуры. В ряде случаев переживания и симптоматику больного трудно выявить из-за его большого опыта общения с психиатрами или знакомства со специальной и популярной медицинской литературой. Такой больной либо пытается навязать врачу свою точку зрения на свое заболевание, используя для этого случайные знания, либо, пытаясь «помочь» врачу, оперирует в беседе штампованными фразами и терминами. ТОСКА, ПСИХОМОТОРНАЯ ЗАТОРМОЖЕННОСТЬ Распознавание достаточно тяжелого «классического» меланхолического синдрома (некоторыми авторами обозначаемого как «простая депрессия») по представляет трудностей. Мимика у такого больного скорбная, застывшая, поза согбенная, движения замедленны, речь малословная, тихая, медленная, недостаточно модулированная, ответы на вопросы — с задержками. Больной испытывает тоску, обычно более интенсивную и утренние часы, теми мышления замедлен, резко снижены побуждения и интересы. Часто он переживает идеи виновности, возможны симптомы деперсонализации, суицидные мысли. Как правило, нарушен сон, резко снижен аппетит, вплоть до полного отказа от пищи, отмечаются значительное похудание, «голодный» запах изо рта, запоры и т. д. Однако столь ясная клиническая картина в настоящее время встречается все реже, что, вероятно, определяется, с одной стороны, широким и ранним применением психотропных средств, а с другой — трансформацией клинической картины депрессии и увеличением частоты легких, «стертых», «атипичных» форм. Обычно перечень симптомов, встречающихся при эндогенной депрессии, включает депрессивное (тоскливое) настроение, двигательную и психическую заторможенность, снижение интересов и уровня побуждений, идеи малоценности, суицидные тенденции, тревогу, ауто- и соматопсихическую деперсонализацию, нарушение сна, потерю аппетита и ряд других вегетосоматических проявлений. Одним из ведущих психопатологических признаков эндогенной депрессии является болезненно сниженное настроение, которое больные характеризуют как тоску, тяжесть на душе, подавленность, беспросветность и т. п. Как правило, при расспросе больные отмечают, что эта тоска отличается от обычного ситуационно обусловленного горя или печали, но чем именно — они не могут объяснить, и хотя многие пациенты пытаются связать свою подавленность с внешними факторами, тем не менее они сами отмечают, что приятные известия или события существенно не изменяют настроения. Именно этот компонент витальности отличает эндогенную депрессию от ситуационно обусловленной печали, хотя иногда его трудно или даже невозможно выявить с достаточной долей уверенности. В более тяжелых случаях больные локализуют тоску в области сердца (в то время как тревогу — за грудиной). Другой отличительной особенностью настроения при эндогенной депрессии являются суточные колебания: в первые утренние часы ощущается особенно интенсивная тоска, а поздно вечером она несколько смягчается. Иногда больные пытаются дать этому психологические объяснения: «К вечеру становится легче потому, что осознаешь, что кончился еще один мучительный день, можно хоть на время забыться сном». В некоторых случаях, обычно при неглубокой депрессии, настроение ухудшается и после дневного сна. Утреннее обострение тоски может проявляться двояко: чаще тоска возникает сразу же в момент пробуждения. В других случаях больной просыпается без ощущения тоски, которая появляется через несколько (реже через 30-40) минут после пробуждения. Сами больные связывают возникновение тоски с необходимостью вставать и что-то делать, с появлением какой-либо неприятной мысли или воспоминания, с незначительной физической нагрузкой. Создается впечатление, что такая картина наблюдается при относительно неглубокой депрессии, особенно в тех случаях, где состояние характеризуется тревожно-депрессивным синдромом, у больных с выраженными чертами тревожной мнительности в преморбиде. Отсутствие суточных колебаний, как правило, бывает при тяжелых состояниях. Иногда отмечается извращенный суточный ритм, однако если он встречается у больных эндогенной депрессией, то при внимательном расспросе оказывается, что ухудшение к вечеру обусловлено не углублением тоски, а усилением обсессий, тревожных переживаний и сомнений. Иногда извращенный суточный ритм отмечается у больных с депрессивно-деперсонализационным синдромом, о чем подробнее будет сказано ниже. Важным симптомом эндогенной депрессии, включенным Э. Крепелином в триаду ведущих признаков, является психическая заторможенность. При выраженной «заторможенной» депрессии она легко выявляется в виде резкого замедления темпа мышления и речи. Больные не сразу осмысливают вопросы, отвечают на них с большой задержкой, с трудом подбирают нужные слова и формулировки. Они отмечают, что мысли делаются медленными, неповоротливыми, «мысли трудно собрать, они как бы не зацепляются друг за друга». Особенно быстро замечают даже легкое замедление темпа мышления люди интеллектуального труда. Истинную депрессивную заторможенность мышления иногда трудно отличить от проявлений астении. В первом случае темп мышления одинаково замедлен и в начале, и в конце беседы, в то время как во втором — он снижается в процессе беседы по мере истощения больного. Очень важно для оценки состояния и выбора терапии дифференцировать замедление темпа мышления, обусловленное депрессией от торможения, часто возникающего при интенсивной тревоге и напряжении. Несмотря на то, что у таких тревожных больных замедление темпа речи может достичь степени мутизма, их можно отличить по ряду внешних признаков: по напряженному, блестящему взгляду, застывшей напряженной мимике, но без выраженной скорби и т. п. Если такой больной все же произносит несколько слов, они вырываются с усилием, как бы преодолевая препятствие, в то время как при депрессивной заторможенности каждое слово произносится медленно, монотонно. Если заторможенность, обусловленная скрытой внутренней тревогой, неправильно оценивается как депрессивное снижение активности, неизбежны ошибки в терапии. Назначение антидепрессантов, например мелипрамина, обычно приводит к резкому обострению тревоги, следствием которой может быть раптус, наплыв страха с нарушением сознания, соматическая катастрофа в виде приступа гипертензии, инфаркта и т. п. Иногда психическая заторможенность оказывается непропорционально сильно выражена по сравнению о другими компонентами депрессивного синдрома, в том числе и моторной заторможенностью. Распознавание депрессии у таких больных бывает затрудненным. Они производят впечатление растерянных, от них не удается получить описания их болезненных переживаний, в том числе и жалоб на сниженное настроение. В некоторых случаях они несколько напоминают псевдодементных больных. Лишь после окончания депрессивной фазы они рассказывают, что настроение у них было сниженным, но что они не могли ничего объяснить из-за почти полного отсутствия мыслей в голове. В некоторых случаях они амнезируют некоторые периоды депрессии. В отношении больных пожилого возраста с такой симптоматикой возникает предположение о наличии грубого органического (сосудистого) заболевания головного мозга, на фоне которого развилась депрессия. Однако у большинства таких больных органической симптоматики в период интермиссии не удается обнаружить. Двигательная заторможенность чаще всего коррелирует с психической. В редких случаях она может достигнуть степени полной обездвиженности. Обычно же она проявляется в той или иной степени замедления скорости движений, походки. Моторную заторможенность также необходимо отличать от вялости, свойственной анергическим и астеническим состояниям, и от «тревожного оцепенения», достигающего иногда степени ступора, о чем говорилось выше. Часто больные с психомоторной заторможенностью с трудом поднимаются с постели в первую половину дня. Для эндогенной депрессии характерно общее снижение психического тонуса. Резко падает уровень интересов; события, которые раньше занимали больного, представляются «пресными», пустыми, ненужными, больной старается избежать общения с окружающими. Стремление к уходу от всяческих контактов и деятельности обусловлено также тем, что повседневно возникающие обыденные задачи и вопросы, которые в здоровом состоянии решаются почти автоматически, в депрессии приобретают значение сложных, тягостных, неразрешимых проблем. По выражению одного больного, «каждая маленькая песчинка на пути становится важной. Поэтому, наряду с. общим снижением круга интересов, отдельные, часто незначительные, попроси и события полностью поглощают внимание и помыслы, делаясь объектом постоянных тягостных переживаний. Для больного депрессией но только крайне трудно принять решение, но еще тяжелее привести его в исполнение и вообще принудить себя к какой-либо деятельности. По словам того же больного, возникает ощущение «непреодолимой инерции». Несколько легче осуществляется деятельность в привычной, четко регламентированной колее. Так, люди, работа которых протекает в строго ограниченных, стереотипных рамках, продолжают относительно долго справляться с ней, несмотря на то, что а остальных сферах болезнь уже привела к декомпенсации. Ощущение своей беспомощности, бессилия, слабости становится почвой для возникновения идей малоценности, а иногда и суицидных намерений. Тягостность этих переживаний в еще большой степени усиливается благодаря присущим значительной части больных МДП личностным особенностям: повышенному чувству долга, добросовестности и т. д. Наблюдаемое при депрессии нарушение концентрации внимания, вероятно, зависит от ряда причин: снижения психического тонуса, идеаторной заторможенности, треноги, прикованности к эмоционально значимым депрессивным мыслям. Этими же причинами обусловлены жалобы больных на ухудшение памяти. ТРЕВОГА В СТРУКТУРЕ ДЕПРЕССИВНЫХ СОСТОЯНИЙ В последние годы все большее внимание уделяется роли тревоги при депрессивных состояниях. Ото в значительной степени обусловлено широким применением антидепрессантов, одним из критериев для выбора которых является выраженность тревоги в структуре депрессивного синдрома. В свое время Крепелин (1910) писал, что «всего чаще тревога встречается при депрессивных стадиях циркулярного психоза, но вместе с тем наблюдаются многочисленные случаи, когда она совершенно отсутствует». Однако И. Lelmuwin (1959) уже высказывают сомнение в том, может ли в действительности существовать депрессия без определенной степени тревоги. Частота, с которой выявляется тревога, в значительной мере зависит от взглядов различных исследователей и используемых ими критериев. Некоторые психиатры, особенно в прошлом, диагностировали тревогу лишь при наличии выраженной ажитации, жалоб на беспокойство, волнение, ощущения надвигающейся опасности. Для других ее признаком является также и чувство внутреннего напряжения, дискомфорта и т. д. Эти разногласии обусловлены нечеткой дефиницией самого понятия тревоги. Наиболее распространенное определение, применяемое а психиатрии и психологии, описывает треногу как отрицательную эмоцию, направленную в будущее и субъективно воспринимаемую как ощущение неопределенной угрозы. Однако существует и более широкое; (физиологическое) понимание итого термина как комплекса нервных (вегетативных), соматических и психических сдвигов, возникающих в ожидании возможной угрозы и имеющих целью подготовить организм к осуществлению реакции «борьбы-бегства» по Кеннону. Такое определение тревоги учитывает, что они всегда сопровождается нервно-соматическими проявлениями: учащением пульса, повышением артериального давления и другими признаками симпатикотонии; увеличением секреции адреналина и кортикостероидов и т. д. Подобные нейрогуморальные сдвиги укладываются а картину реакции стресса, и, соответственно тревога может рассматриваться как психическое проявление стресса. Как было показано в гл. 2, патогенетические механизмы депрессии могут быть представлены как модель хронического стресса, что объясняет присутствие элементов треноги в психопатологической структуре депрессии. В психопатологической картине эндогенной депрессии тревога может проявляться широким набором признаков: а тяжелых случаях — ажитацией или «тревожным оцепенением» вплоть до полного ступора, паническим ощущением надвигающейся катастрофы, смерти, мучительным сжатием а груди, ощущением удушья (характерно что больные с преобладанием тревоги жалуются на тяжесть, сдавление, боль за грудиной, а при преобладании тоски — в области сердца), в более легких — чувством внутреннего напряжения, ожиданием чего-то неприятного, волнением, усилением неуверенности, тревожными сомнениями и т. д. Разграничение тревоги и тоски зачастую представляет большие трудности не только для больного, но и для врача, тем более, что «чистая тревога», возникающая вне рамок аффективного психоза, всегда сопровождается сниженным настроением. Так J. Mendels, A. Weinstain, С. Cochrane (1972), используя методы многомерной статистики, пытались дифференцировать тревогу и депрессию, регистрируемые по 6 самооценочным шкалам у 100 больных депрессией. Они пришли к заключению, что отчетливое разграничение этих двух симптомов представляется невозможным. До недавнего времени эта проблема носила в большей степени теоретический характер. Однако появление большого количества антидепрессивных и противотревожных препаратов, различающихся по спектру психотропной активности, и соответственно необходимость выбора определенного препарата для данного больного придают этому вопросу вполне практическое значение. Кроме того, сами психотропные средства могут служить инструментом для более тонкого и точного исследования структуры психопатологических синдромов. В качестве такого метода исследования нами совместно с В. А. Точиловым было использовано разовое внутривенное введение 20-40 мг седуксена (диазепама), так называемый «диазепамовый тест». Тест проводился у 76 больных женщин с меланхолическим (28 чел.) и тревожно-депрессивным (48 чел.) синдромами в рамках МДП (40 больных), инволюционной меланхолии (16 чел.), а также шизофрении, органического, послеродового и реактивного психозов. Поскольку психотропный эффект диазепама в первую очередь определяется анксиолитическим действием, его влияние на психопатологическую симптоматику прежде всего обусловлено редукцией тревоги. Дважды — до и после введения седуксена — по специальной градуированной оценочной шкале регистрировались следующие симптомы: 1) настроение (тоска); 2) деперсопализация; 3) тревога; 4) депрессивные идеи (виновности, малоценности); 5) активность (спонтанностъ) высказывания этих идей; кроме того, фиксировался снотворный эффект седуксена: от глубокого сна до эйфорического возбуждения (6). По степени выраженности каждый признак подразделялся на 5 градаций. По общему влиянию седуксена на психопатологическую симптоматику было выделено три типа реакций: 1) полное исчезновение всей симптоматики, причем у некоторых больных сниженное настроение не только выравнивалось, но даже сменялось эйфорией, сонливости не было; 2) частичная редукция симптоматики, причем у больных отмечалась сонливость разной степени; 3) некоторое смягчение напряженности и тревоги, но собственно депрессивная симптоматика (тоска, снижение психической активности и т. д.) существенно не изменялась, а иногда выступала более отчетливо, не будучи замаскированной проявлениями тревоги. У этих больных сонливость была значительной, часто они засыпали во время инъекции. Первый тип реакции отмечался у 21, 2-й (промежуточный) — у 32 и 3-й — у 28 больных. Для выявления внутренней связи между отдельными симптомами данные оценочных шкал были обработаны методом факторного анализа. Как известно, факторный анализ является методом, исследующим внутреннюю структуру корреляционных и ковариационных матриц. Он был разработан Спирманом для решения ряда проблем, возникающих перед психологами при исследовании интеллекта. Однако трудоемкость вычислительных процедур существенно ограничивала его применение. Лишь после появления электронно-вычислительных машин факторный анализ стал широко использоваться во многих отраслях науки. В нашей работе была использована одна из главных разновидностей факторного анализа — метод главных компонентов, подробно описанный в монографии Д. Лоули и А. Максвелла (1967). Сущность этого метода сводится к следующему: если имеется и числовых признаков, то фактором (первым фактором) называется новый признак, представляющий собой линейную комбинацию из исходных признаков с соответствующими коэффициентами, причем сумма квадратов коэффициентов его корреляции с исходными признаками является максимальной. В этом смысле фактор вбирает в себя максимум информации из исходных признаков. Второй фактор вводится так же, как и первый, но с ограничением: его корреляция с первым фактором должна равняться пулю. Третий фактор не должен коррелировать с первым и вторым и т. д. Коэффициент корреляции каждого признака с фактором обозначается как факторная нагрузка признака и указывает на степень его участия в формировании фактора. Сумма квадратов всех факторных нагрузок определяет вес фактора, т.е. указывает на величину информации, которую он в себя вобрал. Внедрение в психиатрию математических методов исследования, в том числе многомерной статистики и, в частности, факторного анализа, в определенной степени связано с использованием оценочных градуированных шкал, применяемых для более объективной и ранжированной регистрации психопатологической симптоматики. Ценность факторного анализа заключается в том, что он позволяет выявить устойчивые констелляции среди массы признаков (симптомов), т.е. выделить в виде факторов группы связанных между собой признаков. Иначе говоря, фактор представляет структурные взаимосвязи признаков (симптомов). При этом предполагается, что эти признаки образовали «гроздь», потому что в основе их, как стержень, лежит какой-то не известный нам новый признак (фактор). Метод факторного анализа оказался полезным при изучении структуры психопатологических синдромов, в том числе депрессивных. Обработке методом факторного анализа, проведенной В. Д. Широковым, были подвергнуты следующие показатели: количественные данные шкалы, характеризовавшие состояние больных до введения седуксена, и показатели редукции психопатологической симптоматики, т.е. разность между показателями шкалы до и после введения седуксена. Результаты факторного анализа исходной симптоматики представлены в табл. 9. ТАБЛИЦА № 9
Фактор i вобрал в себя почти всю аффективную симптоматику с высокими факторными нагрузками: тоску, депрессивные идеи, интенсивность их высказывания, тревоги. Как видно, депрессивная симптоматика Это подтверждается тем, что снотворный эффект седуксена также вошел в этот фактор. Единственным симптомом, не коррелирующим с остальным комплексом аффективной симптоматики, являлась деперсонализация, что подчеркивает автономность этого симптома по отношению к депрессивному симптомокомплексу. Стержневым признаком 2-го и 3-го факторов является деперсонализация, которая вошла в них с максимальной факторной нагрузкой. Однако во 2-й фактор со значительными отрицательными факторными нагрузками были включены тревога и интенсивность высказывания депрессивных идей (5-й признак). Таким образом, деперсонализация в этом факторе отрицательно коррелирует с тревогой. Незначительная выраженность тревоги подтверждается наличием в этом факторе снотворного эффекта седуксена. В 3-м факторе, наоборот, деперсонализация, являясь также определяющим признаком, положительно коррелировала с тревогой, на что указывает и отсутствие снотворного эффекта седуксена. Этот признак вошел в фактор Я со значительной факторной нагрузкой и отрицательным знаком. Таким образом, при факторном анализе деперсонализация не была связана со псом комплексом депрессивной симптоматики и, кроме того, разделилась по наличию корреляции с треногой. Эти данные, касающиеся деперсонализации, будут подробно рассмотрены в гл. 8. Таким образом, при факторном анализе исходной симптоматики собственно депрессивная симптоматика и деперсонализация более или менее четко разошлись по разным факторам, в то время как тревога включалась со значительными факторными нагрузками в факторы 1 и Из табл. 9 также видно (фактор 2), что интенсивность высказывания депрессивных идей находится в зависимости от выраженности тревоги. Наибольший интерес представляет структурное исследование редукции психопатологической симптоматики, наступившей под влиянием седуксена. Как указывалось, ведущим психотропным эффектом седуксена является противотревожный. Поэтому следовало ожидать, что редукции подвергается психопатологическая симптоматика, обусловленная или связанная с тревогой. Результаты факторного анализа редукции психопатологической симптоматики, наступившей под влиянием седуксена, представлены в табл. 10. ТАБЛИЦА № 10
В результате обработки удалось выделить лишь один фактор, обладающий значительным весом. Остальные факторы имели крайне малые веса, поэтому в таблицу они не были включены и были малоинформативными. 1-й фактор вобрал в себя признаки, характеризующие редукцию психопатологической симптоматики, причем все они вошли с. очень высокими факторными нагрузками. Самые большие нагрузки были у двух признаков: редукция тревоги и редукция интенсивности высказывания депрессивных идей. Как следует из табл. 9, а также из клинического опыта, интенсивность жалоб больных депрессией в первую очередь определяется уровнем тревоги: при глубокой депрессии без выраженной тревоги депрессивные переживания могут быть крайне тяжелыми, но больные активно их не высказывают. Ведущая роль тревоги в редукции психопатологической симптоматики подтверждается не только известными фармакологическими свойствами седуксена, но и тем, что сама тревога при этом редуцировалась в наибольшей степени: при суммарной оценке показателей шкалы было установлено, что тревога уменьшилась в среднем на 1,5 балла (при среднем исходном балле 2,32), в то время как тоска уменьшилась лишь на 0,87 балла (при среднем балле 1,67), т.е. 64,5 и 54% соответственно. Таким образом, данные табл. 10 показывают, что при воздействии на патогенетические механизмы тревоги редуцируется не только сама тревога как психопатологический симптом, по и остальная аффективная симптоматика: тоска, депрессивные идеи, деперсонализация. Следовательно, эти признаки в значительной степени связаны с патогенетическими механизмами тревоги, во всяком случае у части больных. Как было указано раньше, у 21 больного с тревожно-депрессивным синдромом под влиянием седуксена полностью исчезла вся психопатологическая симптоматика, включая депрессивную, что указывает на ведущую роль тревоги в патогенезе их болезненного состояния. Редукцию симптоматики именно у этой части больных отражает главным образом фактор 1 в табл. 10. Эти данные находятся в соответствии с известным клиническим опытом в отношении трудности, а иногда невозможности разграничения на психопатологическом уровне «чистой тоски» от «чистой тревоги». В известной мере это обусловлено самими патогенетическими механизмами эндогенной депрессии, которые, как указывалось выше, обязательно включают в себя биохимические компоненты стресса. С другой стороны, это вызвано неизбежной почетностью определения психопатологических симптомов. Хорошо известно, что состоянию тревоги всегда присущи элементы сниженного настроения, а депрессии — элементы напряжения, тревоги. Это указывает на то, что выделенные симптомы не являются монолитными, простыми единицами, а сами представляют весьма сложное образование. Действительно, определяя депрессию как симптом, врач подразумевает сниженное (тоскливое, депрессивное) настроение, однако даже у здорового человека настроение является результирующей множества факторов: ощущение физического здоровья или нездоровья, усталости или бодрости, приятных или неприятных событий и реакций на них и т. д. Таким образом, настроение в норме складывается из различных, иногда разнонаправленных, эмоций, обусловленных всеми этими факторами. Например, в ожидании какого-либо приятного события человек может одновременно радоваться его приближению, тревожиться, что что-нибудь может ему помешать; он может подозревать кого-либо в желании воспрепятствовать этому событию, бояться оказаться не на высоте положения. Таким образом, настроение человека в этом случае будет включать и радость, и тревогу, и, возможно, элементы гнева. В целом же определять настроение будет наиболее сильная эмоция. Настроение сказывается также на оценке человеком поступающей в сознание информации, которая как бы проходит через фильтр эмоций: при хорошем настроении мелкие неприятности почти не замечаются, при плохом, наоборот, каждая мелочь может восприниматься как трагедия. Более сильные влияния меняют настроение. В отличие от нормального, болезненно измененное настроение, в частности депрессивное, определяется застойными патологическими аффектами. Поэтому внешние воздействия не могут изменить знак (характер) настроения, и лишь иногда они могут до некоторой степени усилить или ослабить его. И, так же как нормальное настроение может быть обусловлено комплексом нескольких эмоций, так и патологическое — несколькими сосуществующими аффектами. Доминирующий аффект определяет характер патологически измененного настроения, по по исключает одновременном наличии других аффектов. Именно но этому депрессивное настроение включает в себя, помимо аффекта тоски, и аффект тревоги. При значительном преобладании аффекта тоски настроение оценивается как чисто депрессивное, при подавляющем преобладании тревоги — как тревожное; при значительной выраженности обоих аффективных компонентов синдром расценивается как тревожно-депрессивный, а точная квалификация настроения как симптома становится затруднительной. В этих случаях его обычно определяют как депрессивное, а тревогу выделяют как самостоятельный симптом, хотя, как указывалось выше, такое расчленение является весьма неточным и условным. Кроме подавленности и тревоги, депрессивное настроение иногда включает аффект гневливости, раздражения. При его значительной выраженности настроение определяется как дистимическое. Таким образом, тоска и тревога определяют аффективную структуру депрессивного синдрома. Этот аффективный стержень синдрома, наряду с нарушениями психомоторной активности, составляет основное ядро психопатологической симптоматики депрессии. Помимо этого ядра, в симптоматику депрессии входит ряд других проявлений, связанных с патофизиологическими механизмами болезни. Это нередко встречающиеся деперсонализационные расстройства, которые при достаточно тяжелой депрессии могут проявляться в виде anaesthesia dolorosa и умеренно выраженных других проявлений аутопсихической деперсонализации, а также в виде соматопсихической деперсонализации (отсутствие чувства сна, голода, насыщения и др.). Более обширная деперсонализационная симптоматика имеет место при депрессивно-деперсонализационном синдроме, описание которого дано ниже. Для депрессии характерны нарушения сна, чаще всего в виде раннего пробуждения, которые мучительны для больного из-за того, что именно в это время тоскливое настроение и болезненные мысли и переживания особенно интенсивны. Описанные выше «ядерные» симптомы депрессии, непосредственно обусловленные нарушениями функционирования мозга, создают базу для «депрессивного мироощущения». Прежде всего это относится к тоске, окрашивающей все в мрачные топа. Утеря интересов и побуждений порождает ощущение бессмысленности существования, снижение энергии, затруднения в принятии решений и в самом процессе мышления, вызывает чувство бессилия, безнадежности; тревога привносит сознание непрочности существования, ожидание катастрофы, неуверенность. Очевидно, что «депрессивное мироощущение», преломляясь через призму личности, приводит к формированию некоторых симптомов, которые, таким образом, в значительной мере зависят от личностных, культуральных и социальных характеристик больного. К этим симптомам прежде всего относятся суицидные тенденции и идеи малоценности. СУИЦИДЫ Угроза суицида у больного депрессией постоянно довлеет над врачом и в значительной степени предопределяет тактику лечения. Проблема суицидов в настоящее время широко разрабатывается психологами и социологами, однако в данной книге она рассматривается только в клиническом аспекте и лишь в отношении больных эндогенной депрессией. Принято считать, и это, очевидно, соответствует действительности, что у всех больных депрессией в той или иной степени имеются суицидные тенденции или во всяком случае в разной мере выраженное нежелание жить. Такие больные заявляют, что жизнь их тяготит, что они не думают о возможности суицида, по если бы смерть наступила естественно, из-за несчастного случая или болезни, это было бы но так уж плохо. В других случаях больной говорит, что он мечтает о смерти, хотя ничего не предпримет для ее наступления. У части больных имеются спорадические или постоянные суицидные мысли, и некоторые из них реализуют эти идеи в более или менее серьезных суицидных по пытках. Поэтому важнейшая задача психиатра — правильно оцепить риск суицида у больного депрессией. Точка зрения, согласно которой врач всегда должен исходить из максимальной вероятности суицида и принять все крайние меры (госпитализация, строгий надзор и условиях больницы и т. д.), хотя, на первый взгляд, и уменьшает возможность самоубийства, но едва ли может быть приемлемой. Во-первых, даже практически невозможно всех больных депрессией, вне зависимости от тяжести их состояния, госпитализировать. Кроме того, что более существенно, госпитализация, предпринятая без достаточных оснований, часто наносит непоправимый ущерб больному, подрывая его социальный статус, служебное положение, веру в себя, и, что очень важно и на что обычно мало обращают внимания, подрывает вору больного во врача. Если больной и его родные могут действительно усмотреть в поведении врача прежде всего не заботу о больном, а стремление перестраховаться, то при следующем приступе заболевания, который может оказаться более тяжелым, они постараются утаить от психиатра проявление болезни или попросту вовремя не обратятся к нему. В этом случае риск суицида будет очень высоким. Поэтому, придя к решению госпитализировать больного, врач должен объяснить ему и его близким необходимость данного шага, хотя в этот момент объяснения могут и не встретить понимания. Однако в дальнейшем, когда депрессия окончится, больной сможет попять и правильно оценить мотивы врача. Тем более нельзя прибегать к обману больного, госпитализируя его под предлогом консультации в соматической больнице и т. п. Разумеется, в некоторых редких случаях необходимы крайние меры, чтобы удержать от неизбежного суицида и не упустить опасного в этом отношении больного. Но, как правило, руководствуясь и этическими соображениями, и вероятностью повторных депрессий у данного больного в будущем, психиатр должен делать все возможное, чтобы сохранить контакт с ним, его веру и уважение. При оценке риска суицидной попытки его можно представить как результирующую двух противоположно направленных факторов: интенсивности суицидных побуждений и психологического барьера, препятствующего их реализации. Интенсивность суицидных побуждений определяется тяжестью тоски, степенью тревоги и аффективного Напряжения, а также выраженностью других, перечисленных выше проявлений депрессии, формирующих «депрессивное мироощущение». Чувство собственного бессилия, беззащитности, беспомощности, страх перед жизнью и ее трудностями — все это порождает в больном стремление к самоубийству. Значительно повышается риск суицида при наличии деперсонализации: мучительно переживаемая утрата привязанностей, отчужденность от окружающих проявлений жизни, ангедония, снижение инстинкта жизни и другие проявления деперсонализации «логически» приводят больного к мысли о необходимости прекратить существование. Следует отметить что угасание инстинкта жизни, очевидно, характерно и для депрессии, и дли деперсолизации. Барьером, препятствующим реализации суицидных тенденций, прежде всего являются этические нормы и принципы больного, чувство долга перед родными и окружающими, взятые на себя обязательства, а также страх пород смертью и перед болью. Поэтому, оценивая вероятность суицидной попытки, врач должен исходить не только из анализа симптоматики, ее тяжести и структуры, но и из социальных, личностных и культуральных фактором. Роль этих факторов подтверждается транскультуральными исследованиями, которые показывают, что суицидные идеи и действия не свойственны некоторым цивилизациям, а частности африканским (Binilio A., 1975), а также многократно отмеченной старыми авторами зависимостью между религиозностью и риском суицида. Так, верующие христиане относительно более устойчивы в борьбе с суицидными тенденциями, причем в наибольшей степени это относится к католикам, для которых самоубийство является неискупаемым «смертным грехом». С другой стороны, в истории известны цивилизации или, точнее, периоды их развития, когда самоубийство являлось нередким и даже почетным способом решения жизненных проблем. Достаточно напомнить Римскую империю времен упадка и особенно обычай харакири у японских самураев. Как указывалось выше, оценка вероятности сама убийства является крайне ответственной задачей при лечении больного депрессией. Поэтому знание факто ров, снижающих психологический барьер и отношении суицида, представляется необходимым. Ведь даже больной с тяжелой депрессией выдерживает борьбу с самим собой перед тем, как решиться на суицид. Риск суицида повышается при наличии нескольких факторов: 1. Одиночество. В этом отношении особенно опасны больные, живущие в полной изоляции: у них нет привязанности и обязательств, заставляющих держаться за жизнь. Иногда и присутствие в доме собаки или кошки, о которых некому будет заботиться после гибели хозяина, удерживает его от самоубийства. Это прежде всего относится к пожилым больным. Чувство одиночества и собственной ненужности, обременительности может возникнуть при конфликтной семенной ситуации. 2. Нарушение жизненного стереотипа и лишение любимого или привычного вида деятельности. В этом случае опасность представляет депрессия, возникшая после выхода на пенсию и даже переезд на новое место жительства, в новое, незнакомое окружение. 3. Суицидная попытка в прошлом или завершенный суицид среди родственников, когда как бы снимается «запретность» самоубийства. Так, некоторые больные, у которых родственники покончили с собой, почти не пытаются бороться с суицидными тенденциями, убеждая себя, что такая смерть — «рок их семьи». К факторам, повышающим риск суицида, также относится ряд клинических особенностей заболевания и особенно деперсонализация. Помимо указанных выше причин, она облегчает совершение суицида из-за наличия анальгезии. К этим факторам также относятся длительная бессонница, мучительно переживаемая больными, резкая тревога, чаще наблюдаемая у женщин, особенно при послеродовых и инволюционных депрессиях. Наконец, следует учитывать роль ятрогении. Так, нами наблюдалось несколько случаев суицида, обусловленного неправильной тактикой врача после окончания первой фазы: из «психотерапевтических соображении» больному говорилось, что заболевание больше не повторится, что он может спокойно и уверенно жить так же, как до болезни, и что просто надо про явить волю, взять себя в руки. Повторный приступ убеждает больного, что врач ошибся в оценке его заболевания, что болезнь станет хронической, неизлечимой Эти мысли и существенной мере способствуют суициду. Относительно часты суициды у больных с нераспознанными затяжными депрессиями с выраженной соматической, ипохондрической и деперсонализационной симптоматикой. Отсутствие облегчения, «отфутболивание» от специалиста к специалисту приводят их к мысли о нераспознанной и неизлечимой болезни (часто «раке»), и, чтобы избавиться от мучений, такие больные пытаются покончить с собой. Для разных форм депрессивных состоянии характерны определенные различия в способах суицида. Так, при тяжелой меланхолической депрессии суицид обычно совершается в утренние часы, часто путем отравления или самоповешения. При тяжелых тревожных депрессиях время суицида менее определенное, хотя тоже нередки попытки в утренние часы. Такие больные пытаются выброситься из окна, бросаются под транспорт, наносят себе ножевые ранения. При тревожных депрессиях, протекающих с идеями самообвинения, обвинения и особого значения, возможны расширенные суициды, чаще у женщин. Опасны расширенные суициды при послеродовых депрессиях. Наиболее серьезными и чаще всего просматриваемыми являются суицидные попытки у больных с депрессивно-деперсонализационным синдромом. Суицидные попытки у этих больных хорошо продуманы. Они совершаются с «холодной головой», рассудочно, не под влиянием острого аффекта. Отсутствие существенной психомоторной заторможенности облегчает реализацию суицида. Кроме того, часто отмечаемая при тяжелой деперсонализации анальгезия позволяет больному производить крайне жестокие действия. Так, один больной с депрессивно-деперсонализационным синдромом обломком от карандаша под одеялом медленно проколол себе кожу, межреберные мышцы и дошел до перикарда. По выражению лица никто из окружающих не смог ничего заподозрить, и только когда из-за кровопотери больной побледнел, суицидная попытка была обнаружена. Опасность просмотра суицидных тенденций, а иногда и самой депрессии у таких больных также усугубляется тем, что выражение лица у них часто бывает не скорбным, а безразличным, нет выраженной заторможенности, а иногда они даже улыбаются невыразительной вежливой улыбкой, которая вводит врача в заблуждение. Именно такие «улыбающиеся» депрессии крайне опасны в отношении ошибочной диагностики. Вообще следует помнить, что нередко решившийся на суицид больной делается внешне спокойнее, чем даже может создать иллюзию наступающего улучшения и ввести врача в заблуждение. Не всегда легко квалифицировать как сознательный суицид некоторые случаи отравления снотворными и седативными средствами. Особенно часто бывают они у больных, страдающих мучительной бессонницей. Они принимают большую дозу снотворного не для того, чтобы умереть, а чтобы «забыться», затем в полузабытье, потеряв контроль, боясь, что они все-таки по заснут, они продолжают принимать все новые таблетки снотворного. В настоящее время благодаря хорошо налаженной реанимационной и токсикологической службе такие больные, как правило, не погибают. После реанимации иногда трудно установить, действительно ли они хотели покончить с собой или «только забыться». Чаще одновременно присутствуют оба мотива. Мы не останавливаемся на реактивно обусловленных суицидных попытках, предпринимаемых людьми, не страдающими эндогенной депрессией. Однако в ряде случаев на фоне неглубокой эндогенной депрессии возникают реактивные ситуации или эндогенная депрессия «маскируется» реактивной симптоматикой. Подробно такие формы депрессии описаны ниже. Психотерапия имеет большое значение в предотвращении суицидов. Ее эффективность, как это хорошо известно, прежде всего основана на доверии больного к врачу. Обычно больного следует но прямо и категорично спрашивать о суицидных мыслях, а в процессе беседы подвести к тому, чтобы он сам рассказал о них. Не следует при этом возмущаться, резко осуждать эти идеи. Наоборот, признание больного лучше принять как обычное, само собой разумеющееся, объяснить ему, что это не более как обычный симптом болезни, что у всех больных депрессией имеются такие мысли. Разубеждение больного следует также производить исподволь, приблизительно в такой форме: «Я понимаю, что сейчас Вас ни в чем разубедить невозможно, что Вы убеждены в правоте своих выводов; когда болезнь пройдет, Вы сами будете удивляться своим намерениям и вспомните мои слова, а сейчас я даже по хочу тратить время на уговоры. Вот когда Вы вылечитесь, тогда поговорим подробно» и т. д. Основная мысль, которая должна проводиться в беседе, — это прежде всего убедить больного в понятности его состояния для врача и в твердой уверенности врача и излечении заболевания. Как бы между прочим надо напомнить об обязательствах больного перед близкими: если есть дети, то рассказать о том, какое влияние на их дальнейшую жизнь может оказать такая смерть отца (или матери), что это может послужить им примером в трудную минуту. Однако не всегда стоит резко упрекать больного, иногда после этого усиливаются идеи виновности («я такой негодяй, что был готов оставить детей») и вследствие этого — усиление суицидных мыслей («...следовательно, я не достоин жить»). Не следует насильно вырывать у больного обещание не кончать с собой, но добровольно сделанные в процессе беседы признание и обещание не совершать суицид являются весьма желательными и в известной мере уменьшают вероятность попытки. Однако этим обещаниям нельзя доверять при выборе тактики, так как в любое время состояние больного может измениться в худшую сторону. Иногда у больных депрессией, обычно добросовестных по характеру, сдерживающим фактором может быть задание или поручение, данное врачом. Разумеется, и форма беседы, и тактика психотерапевтического воздействия прежде всего определяются индивидуальными особенностями психопатологической симптоматики и личности больного. Но во всех случаях не следует употреблять в качестве аргумента утверждение, что врач несет юридическую ответственность в случае самоубийства больного. Обычно это заявление приводит к потере доверия к врачу и но всем другим его доводам. При высоком риске суицида в условиях стационара и при известной опасности у амбулаторного больного, который по каким-то соображениям все же не госпитализируется, лечение необходимо начинать не с активных антидепрессантов, а с транквилизирующих средств или антидепрессантов с сильным транквилизирующим компонентом действия и лишь после смягчения аффективного напряжения приступать к лечению показанным по состоянию больного антидепрессантом. ИДЕИ МАЛОЦЕННОСТИ Депрессивные идеи в еще большей степени можно рассматривать как результат преломления депрессивного мироощущения через призму личностных, социальных и культурных особенностей больного. Во всех случаях в их основе лежит чувство малоценности. Зависимость тематики депрессивных переживаний от социальных и культуральных факторов хорошо известна. В прошлых столетиях в христианской Европе наиболее типичным и частым проявлением депрессии считались бредовые идеи греховности, тематика которых обычно была связана с религиозными представлениями. В середине века самообвинения в богохульстве, колдовстве, «нанесении порчи» нередко приводили больных депрессией на костры инквизиции. В XX столетии в промышленно развитых странах Европы религиозная фабула идей виновности стала встречаться намного реже, уменьшились их интенсивность и частота, однако до относительно недавнего времени многие психиатры рассматривали бред виновности как один из основных дифференциально-диагностических критериев эндогенной депрессии. За послевоенные десятилетия идеи малоценности при этих заболеваниях стали встречаться значительно реже. Их фабула, как правило, стала более обыденной, зато значительно участились ипохондрические идеи. В литературе приводится ряд объяснений этому факту: появление все большего числа легких, стертых депрессивных состояний, ранняя антидепрессивная терапия, которой охватываются практически все больные, «соматизация депрессий», уменьшение роли религии в жизни общества, изменение этических норм и т. д. Роль культуральных факторов подтверждается сравнением частоты и значением идеи виновности в разных культурах: например, среди жителей Англии идеи виновности встречаются значительно чаще, чем в некоторых областях Нигерии (Binitie A., 1975). В ряде исследований было показано, что различия определяются социокультуральными, а не национальными или расовыми особенностями. Определенное влияние на содержание идей малоценности оказывает и профессия. Так, например, у профессиональных спортсменов в период депрессии очень часто наблюдаются ипохондрические идеи и очень редко — идеи виновности (Pichot P., Hassan J., 1973). Это, очевидно, объясняется и кругом интересов этих людей, и большим вниманием, которое они должны уделять своему здоровью, и, основное, тем, что именно соматические нарушения и вытекающая отсюда физическая несостоятельность являются воплощением собственной малоценности в главной для них сфере деятельности и интересов. Как известно, депрессивные идеи относятся к группе аффективных (голотимных) и в значительной степени определяются интенсивностью аффекта: при меньшей аффективной напряженности они предъявляются как сверхценные идеи; по мере нарастания интенсивности аффекта исчезает способность к критике, и те же по фабуле идеи предъявляются больным в форме бреда, который по мере интенсификации все в большей степени определяет поведение больного. По мере уменьшения тяжести аффекта наблюдается обратная динамика, хорошо прослеживаемая в процессе фармакотерапии. Как указывалось выше, фабула депрессивных идей в значительной степени определяется личностными особенностями больного, его культурным уровнем, профессией и т. д. Для оценки клинического состояния больного, прогноза и выбора терапии эти различия, очевидно, имеют второстепенное значение. Намного важнее использовать депрессивные идеи как дополнительный критерий, «индикатор» для оценки аффективной структуры синдрома. Чем более выражен тревожный компонент в структуре синдрома, тем в большей степени в переживаниях больного присутствует подтекст внешней угрозы. Такое изменение бредовых идей по мере изменения аффективной структуры иногда прослеживается при неправильно выбранной терапии депрессии, а именно — когда больному назначается препарат с чрезмерным для его состояния стимулирующим компонентом действия, например ингибиторы МАО — больному с напряженным меланхолическим или тревожно-депрессивным синдромом. Если такой больной вначале утверждал, что он виновен в безволии, не может себя заставить справиться с работой, ленится, то по мере нарастания аффективного напряжения он начинает утверждать, что он преступник, что из-за пего срывается план предприятия, и т. п. Далее, по мере роста тревоги, этот же больной, признавая себя преступником, начинает бояться ареста; при еще большей степени тревоги основной темой переживаний является страх перед наказанием, пытками, расстрелом («Я, конечно, виновен, но не настолько же...») или появляется страх за семью («Я виновен, конечно, но за что арестуют детей?»). При еще большем нарастании тревоги элемент «я виновен» исчезает, и бредовые переживания больного приобретают характер идей преследования. Содержание бредовых высказываний достаточно точно отражает удельный вес тревоги в аффективной структуре синдрома и соответственно служит критерием для выбора того или иного антидепрессивного препарата в зависимости от величины его анксиолитического действия. Сама по себе формальная констатация фабулы бреда, без раскрытия его внутреннего подтекста, мало что дает в этом отношении. Например, заявление больпого, что он болен сифилисом, может звучать как идея виновности в структуре меланхолического синдрома («Я заболел постыдной болезнью, я совершил грех перед женой»), при тревожной депрессии нести в себе элемент опасения («Я заразил жену, детей, все узнают про это, опозорят»), а при значительном преобладании тревоги эта же идея заражения сифилисом приобретает уже иное значение («Я болен страшной, неизлечимой болезнью, она разъедает мой организм, меня ждет мучительная смерть»). Таким образом, при формально одной и той же фабуле бред отражает различную аффективную структуру. При анергической депрессии часто идеи малоценности проявляются в виде жалости к себе, сочетающейся со своеобразной завистью к окружающим: «Мне всегда в жизни не везет; даже калеки, хромые, горбатые, слепые счастливее меня; я завидую всем окружающим, я поменялся бы мостами с любым на них. Они хоть как-то могут радоваться жизни, а я лишен всего». Подобные жалобы встречаются и у больных с аутопсихической деперсонализацией. Таким образом, на основании анализа депрессивных идеи можно судить об интенсивности и структуре аффекта. НАВЯЗЧИВОСТИ Другим симптомом, также отражающим аффективную структуру депрессивного состояния, являются навязчивости. Как правило, они возникают в период депрессивной фазы у людей с обсессивной конституцией в преморбиде. Как указывалось выше, еще Пропели» (1904), С. А. Суханов (1910), Ю. В. Каннабих (1914) отмечали относительную частоту сочетания навязчивостей с депрессией и склонность лиц с психастеническим (обсессивным) складом личности к заболеванию маниакально-депрессивным психозом. Действительно, у значительной части больных с выраженным депрессивно-навязчивым синдромом об-сессии наблюдались до возникновении психоза. У других больных навязчивые переживании до болезни или интермиссии обычно не возникали, за исключением редких кратковременных периодов астении, наступившей в результате тяжелого соматического заболевания или других истощающих факторов. Создалось также впечатление, что навязчивости в период депрессии несколько чаще наблюдались у лиц, перенесших и детстве или в молодости легочный туберкулез. Однако эта корреляция но достигает статистически значимою уровня. И, наконец, приблизительно у 1/3 больных с депрессивно-обсессивным синдромом навязчивости и прошлом никогда не было. Фабула обсессий, так же как и депрессивных идей, в известной мере связана с «духом времени». Так, в прошлом, в период широкого распространения сифилиса и недостаточной эффективности методов его лечения, сифилофобия была одной из наиболее часто встречающихся фобии при тревожной депрессии. В последние годы она наблюдается реже, а одно из первых мест по частоте заняла канцерофобия. Намного реже стали возникать навязчивые страхи заражения проказой, чумой. Клаустрофобия стала проявляться в виде страха нахождения в метро; строительство новых высотных домов с балконами привело к увеличению больных с навязчивым желанием прыгнуть с балкона и т. п. Характер навязчивостей также в большой степени определяется аффективной структурой депрессивного состояния. Так, при анергической депрессии, протекающей без заметного напряжения и тревоги, чаще встречаются обсессий относительно индифферентного содержания: навязчивые сомнения, счет, «загадывания» и т. п. При выраженной тоске они могут носить характер хульных мыслей, навязчивых мыслей о самоубийстве (чаще о каком-то одном способе). Подтекст этих обсессивных переживаний — подумать пли сделать нечто грешное, недопустимое, противоречащее моральным нормам. При тревожной депрессии навязчивости проявляются в виде фобий: канцерофобии, сифилофобии, кардиофобии (которой иногда дебютирует депрессивная фаза), боязни толпы, страха острых предметов и т. д. Последний вид фобий иногда возникает у женщин с послеродовой или инволюционной депрессиями, в их генезе лежит страх нанести повреждения детям пли внукам, реже — самоповреждения. Закономерные изменения характера навязчивостей в зависимости от аффективной структуры депрессии можно наблюдать и при спонтанном течении фазы, но более отчетливо — в процессе фармакотерапии. Следует отметить, что у больных с постоянными навязчивостями в преморбиде (например, страх заражения) общая сюжетная канва в динамике депрессивной фазы может оставаться прежней, однако при этом изменяются интенсивность обсессий и некоторые нюансы, отражающие характер аффекта. При достаточно тяжелой депрессии навязчивости, обнаружившиеся у больных в преморбиде и в дебюте фазы, могут полностью исчезнуть и возобновиться лишь в период редукции депрессивной симптоматики. СОМАТИЧЕСКИЕ СИМПТОМЫ ДЕПРЕССИИ Для эндогенной депрессии характерен ряд соматических нарушений, которым придается большое значение при диагностике этого заболевания. Прежде всего обращает внимание сам внешний вид больного достаточно сильной депрессией: мимика не только скорбная, но и застывшая, выражение скорби усиливается складкой Верагутта; поза согбенная, при ходьбе ноги волочатся; голос тихий, глухой со слабыми модуляциями или вообще немодулированный. На людей, знавших больного до депрессии, он производит впечатление внезапно постаревшего, что обусловлено понижением тургора кожи, появлением или усилением морщин; взгляд больного становится тусклым, глаза западают, черты делаются как бы стертыми, иногда волосы утрачивают блеск, может усиливаться их выпадение. При быстрой редукции депрессии, иногда достигаемой быстродействующими препаратами, прежде всего бросаются в глаза просветление и омоложение лица и всего облика больных. Безусловно, одним из наиболее важных и постоянных соматических симптомов депрессии являются снижение аппетита и похудание. До применения современных методов терапии отказ от пищи и истощение, нередко достигающее степени кахексии, представляли, наряду с суицидами, основную угрозу жизни больных. В то время весьма широко применялось искусственное питание, однако даже с его помощью не всегда удавалось успешно бороться с истощением. Весьма проблематичны эффективность и целесообразность в этих случаях введения глюкозы и малых доз инсулина, так как количество сахара и количество и активность инсулина в крови таких больных не снижены, а даже повышены. Тяжелых депрессивных больных, помимо исхудания, отличают «голодный запах» изо рта, обложенный язык и зев. Однако и в более легких случаях почти всегда отмечается снижение аппетита, больше в первую половину дня. Поэтому таких больных легче накормить в ужин или обед, чем в завтрак. Постоянным и иногда очень неприятным и мучительным для больных соматическим проявлением депрессии являются запоры. В отдельных случаях стул отсутствует в течение педель, а обычные слабительные средства и простые клизмы оказываются неэффективными, так что приходится прибегать к сифонной клизме. У некоторых пожилых больных из-за тяжелых запоров во время депрессии происходит выпадение прямой кишки. Запоры отрицательно сказываются на общем соматическом состоянии, а иногда становятся объектом ипохондрических переживаний. Поэтому у всех больных депрессией необходимо тщательно следить за стулом, постоянно прибегая к различным слабительным и послабляющим средствам, а при сильных запорах — к комбинации более сильных слабительных или к клизме. Запоры при депрессии связаны с атонией толстой кишки, частично обусловленной повышенным тонусом симпатической нервной системы. Следствием периферической симпатотонии являются также тахикардия, мидриаз, сухость слизистых, особенно полости рта. Сочетание этих симптомов, особенно вместе с бессонницей и тревогой, нередко приводит к ошибочной диагностике тиреотоксикоза. Однако содержание гормона щитовидной железы в крови оказывается не повышенным. Обычными являются нарушения в сексуальной сфере: снижение либидо, у женщин временная фригидность и прекращение менструаций, у мужчин — снижение потенции. Менее постоянно наблюдаются при депрессии некоторые болевые, неврологические и мышечные нарушения, которым, однако, в последнее время стали уделять очень много внимания. Им посвящена большая литература, и с ними в значительной мере связана столь модная в последние годы проблема «скрытых», «маскированных» или «ларвированных» депрессий и «депрессивных эквивалентов». Кроме того (что практически крайне важно), эти симптомы нередко приводят к ошибочной диагностике различных соматических заболеваний и просмотру депрессии. Они, приковывая к себе внимание больного и врача, действительно могут «замаскировать» депрессивную симптоматику. Ряд неприятных и болевых ощущений, возникающих при депрессии, связан с нарушениями тонуса гладкой и скелетной мускулатуры. Возможно, что учащенно этих явлении обусловлено увеличением числа тревожно-депрессивных состояний, при которых они обычно наблюдаются. К этим нарушениям относятся: неприятные, тянущие болезненные ощущения в области шеи и затылка, иногда они напоминают шейный миозит. У некоторых больных шейный миозит возникает в дебюте депрессии. Сходные ощущения иногда возникают между лопатками, и плечевом поясом, в нижних конечностях, в области коленей, голеней. Нередки спастические явления: как судорогой сводит икроножные мышцы, чаще по ночам, причем до такой степени, что утром больные продолжают ощущать сильную боль, затвердение в икрах. Иногда сводит стопы, пальцы ног. Во сне часто затекают и немеют конечности. Вероятно, это также связано с повышенным тонусом скелетной мускулатуры и нарушением венозного оттока. Как показали электрофизиологические исследования P. Whybrow, J. Mendels (1969), при депрессии определяются изменения мышечного тонуса, имеющие центральное происхождение. Болевые ощущения при депрессии, очевидно, имеют разную природу. Иногда они обусловлены спазмами гладкой мускулатуры; такие боли часто имитируют картину «острого живота» — заворота кишок, приступа аппендицита, холецистита и т. п. Чаще возникают сжимающие, давящие болевые ощущения в области сердца, а также за грудиной, реже — в эпигастральной области, в подреберье. Эти ощущении обычно описываются как «витальный компонент» тоски (в прекардиальной зоне) или тревоги (за грудиной). В отдельных случаях яти боли приписывают приступу стенокардии, инфаркту миокарда или острому холециститу, в результате чего больные попадают в соматические больницы. Природа этих болей изучена недостаточно. Они, как правило, возникают в областях симпатических сплетений и иногда смягчаются или купируются (особенно загрудинные боли) введением транквилизаторов или альфа-адреноблокаторов (например, пирроксана или фентоламина). Капельное внутривенное введении адреналина здоровым испытуемым вызывает ощущения, аналогичные описываемым больными депрессией. Очевидно, жжение вдоль позвоночника относится к той же группе явлений. При депрессии нередко возникают приступы крестцово-поясничного радикулита. Природа этих болей была выяснена: при депрессии, так же как и при стрессе, нарушается минеральный обмен, происходит накопление внутриклеточного натрия, за счет чего происходят набухание межпозвонковых хрящей и сдавливание нервных корешков, особенно если для этого имеются предрасполагающие факторы, например явления остеохондроза (Levine M., 1971). Отмечаются головные боли, сдавливающие затылок, виски, лоб и отдающие в шею, боли, напоминающие мигрень, и боли, напоминающие невралгию лицевого нерва. Однако чаще больные жалуются на «свинцовую тяжесть» «отупляющее давление», «мутность» в голове. При депрессиях иногда описывают алгический синдром, очевидно, обусловленный снижением порога болевой чувствительности. Вероятно, таково, например, происхождение мучительной зубной боли, при которой больной требует и нередко добивается удаления нескольких или всех зубов, и других подобных болей. Следует отметить, что, хотя подобные случаи относительно часто описываются в литературе, среди массы больных депрессией они встречаются чрезвычайно редко и могут рассматриваться как казуистика. У больных эндогенной депрессией обнаруживаются ряд биохимических сдвигов: гипергликемия, которой, однако, но предварительным данным И. Г. Ковалевой, сопутствуют высокая инсулиновая активность, гиперадреналинемия, повышенная свертываемость крови, некоторые гормональные отклонения и др. Следует, однако, обратить внимание на то, что значительная часть соматических нарушений: мышечные боли, спастические явления, радикулит, острые головные боли и боли в животе, а также загрудинные боли и гипергликемия — чаще наблюдаются и начале приступа депрессии или предшествуют ему, а также наблюдаются при тревоге (особенно это относится к мышечным и болевым симптомам). Особого внимания заслуживают и этом отношении изменения артериального давления. Было принято считать, что для депрессии характерна гипертензия. Эта точка зрения нашла отражении во многих руководствах. С другой стороны, у части больных депрессией отмечается склонность к гипотензии. Наши совместные с Н. Г. Клементовой наблюдения показали, что у 17 из 19 больных (преимущественно женщин) с поздней монополярной депрессией, страдавших до этого гипертонической болезнью с высокими цифрами давлении и тенденциями и кризам, в период депрессий, но до начала лечения артериальное давление существенно снижалось, а кризы исчезали. Возможно, этот факт не обратил на себя внимания, поскольку в первые 1 — 2 дня после поступления в больницу давление может вновь повыситься как следствие эмоционального стресса, вызванного госпитализацией, а в дальнейшем снижение ого показателей приписывается действию психотропных средств. С другой стороны, у некоторых больных (чаще биполярным МДП) таких изменении давления не отмечалось. СТРУКТУРА ДЕПРЕССИВНЫХ СОСТОЯНИИ И ДЕПРЕССИВНЫЕ СИНДРОМЫ Синдром представляет устойчивую констелляцию симптомов, предположительно объединенных общностью обусловливающих их патофизиологических механизмов. Устойчивость и закономерность такой констелляции признаков указывают на то, что она имеет определенную структуру, которая, очевидно, определяется сочетанием каких-то глубинных патологических процессов. Однако до тех пор, пока не будет достаточно полно раскрыт патогенез депрессии и установлена связь между отдельными клиническими проявлениями заболевания и определенными патогенетическими звеньями, любая синдромальная группировка неизбежно будет содержать элемент произвольности. Именно поэтому до сих пор нет достаточно четкой и повсеместно признанной классификации депрессивных синдромов. В некоторых психиатрических школах выделяют большое количество детально расчлененных синдромов, так что синдромальная группировки приближается к симптоматической, в других, наоборот, расширенный синдром подменяет нозологическую единицу. Тем не менее синдромы, выделенные на основании длительного опыта клинической психиатрии, отражают клиническую реальность. Достаточно обоснованных принципов и критериев для выделения синдромов нет. Имеются две тенденции: 1) обозначать в качестве синдромов наиболее часто встречающиеся и устойчивые сочетании симптомов; 2) использовать наиболее важные с точки зрения автора симптомы в качестве основных критериев и вокруг них группировать остальную симптоматику. Обычно обе тенденции сосуществуют. Таким образом, выделение и классификация депрессивных синдромов в настоящее время являются эмпирическими. Одна из наиболее удобных и принятых классификаций приведена Е. С. Авербухом (1962). Она включает 6 синдромов: меланхолический, тревожно-депрессивный, депрессивно-ипохондрическии, астено-депрессивный, деперсонализационно-депрессивный и навязчиво-депрессивный. Принцип, на основании которого выделяются синдромы, основан на обязательном наличии депрессивного настроения и наличии или отсутствии 5 других симптомов: тревоги, ипохондрии, астении, деперсонализации, обсессий. Если один из них отчетливо выражен, он определяет синдром. Наличие выраженной тоски и психомоторной заторможенности, доминирующих над другими проявлениями депрессии, характеризуют меланхолический синдром. Опыт применения психотропных лекарственных средств дал важную информацию для определения значения некоторых симптомов депрессии. Так, оказалось, что выраженность и соотношение тоски и тревоги в структуре депрессивного синдрома определяют выбор и предсказывают эффективность антидепрессанта в зависимости от величины и соотношения стимулирующего и транквилизирующего компонентой в его действии. Как будет показано в гл. 6 (см. рис. 5), депрессивные синдромы можно расположить в закономерный ряд по мере увеличения удельного веса тревоги в их структуре, и соответственно антидепрессанты, показанные при лечении этих депрессивных состоянии, также расположатся во вполне закономерной последовательности: в начале ряда окажутся препараты с преобладанием стимулирующего компонента действии (ингибиторы МАО, дезипрамин), а в конце — антидепрессанты с подавляющим преобладанием транквилизирующего компонента (инсидон, тримипрамин). Этот параллелизм двух рядов указывает на то, чти в основе синдромологических различий действительно лежат особенности патогенеза этих состояний, так как-известно, что различия в спектре терапевтического действия отдельных антидепрессантов обусловлены их избирательным влиянием на определенные биохимические и функциональные структуры мозга. Поэтому первым критерием для синдромологической группировки депрессивных состояний является соотношение тоски и тревоги в их структуре. Иными словами, первый критерий основан на аффективной структуре синдрома. Согласно этому критерию, и рамках эндогенной депрессии можно выделить 3 основных синдрома. Анергическая депрессия. Характеризуется отсутствием напряженной тоски и тревоги, настроение нерезко снижено, нет выраженной психической и моторной заторможенности, но имеется вялость (в психической и двигательной сферах), снижен уровень побуждений и интересов, больные жалуются на отсутствие сил и энергии, усиливаются неуверенность, сомнения, все представляется сложным, трудным. Активных суицидных намерений нет, но больные часто говорят, чти все настолько тяжело, бесперспективно, безнадежно и безрадостно, что хорошо бы умереть. Идей виновности обычно нет. Больные жалеют себя, жалуются на судьбу, отмечают своеобразную зависть ко всем окружающим. Возможны обсессии, отдельные деперсонализационные явления (чаще аутопсихическая деперсонализация), бессонница проявляется и в ранних пробуждениях, и в трудности засыпания. Аппетит снижен, по больные заставляют себя есть, запоры обычно умеренные, артериальное давление невысокое. Это состояние, очевидно, лучше определить как синдром анергической депрессии, а но астено-депрессинный синдром, поскольку выраженной истощаемости, характерной для эстении, у таких больных нет, а отмечается постоянно сниженный фон активности, энергии, который держится на одном уровне в течение всей беседы. Меланхолический синдром (иногда обозначаемый как «простая» или «классическая» депрессия). Характеризуется отчетливой тоской с суточными колебаниями и витальным компонентом, напряжением, хотя внешние проявления тревоги могут быть незначительными или отсутствовать, психомоторной заторможенностью. Суицидные тенденции, кап правило, присутствуют, возможны идеи малоценности, виновности. Обсессии встречаются редко и носят характер хульных мыслей или навязчивых мыслей о самоубийстве. При тяжелом, напряженном меланхолическом синдроме, кап правило, имеются деперсонализационные проявлении: болезненное бесчувствие, сопровождаемое душевной болью, отсутствие чувства голода, насыщения, иногда сна. Сон тяжелый с ранними утренними пробуждениями, аппетит резко снижен, наблюдаются похудание, напоры, тахикардии. Тревожно-депрессивный синдром характеризуется значительным удельным весом тревоги, которая наряду с тоской составляет аффективный стержень синдрома. Настроение резко снижено, возможна тоска с витальным компонентом, суточные колебания настроения обычно выражены. В двигательной сфере — либо двигательное беспокойство в той или иной степени, вплоть до резкой ажитации, либо «тревожное оцепенение» вплоть до обездвиженности. Как правило, беспокойство отмечается значительно чаще. Депрессивные идеи носят двойственный характер («виновен, но страшусь наказания»), часты ипохондрические идеи. Если имеются навязчивости, то они носят характер фобий. Возможны явления ауто- и соматопсихической деперсонализации. Помимо снижения аппетита, похудания и запоров, отмечаются мышечные спазмы, болевые и неприятные ощущения, которые нередко служат базой для ипохондрических переживаний. Однако при одном и том же коэффициенте «тоска / тревога» интенсивность этих аффектов может быть разной. Поэтому вторым фактором, определяющим клиническое проявление депрессии, являются величина, интенсивность аффективного напряжения. При относительно слабом аффекте и, следовательно, более легкой депрессии нередко проявляются и заостряются личностные, характерологические черты, ситуационные моменты. Так, у человека с обсессивной конституцией в период неглубокой депрессии навязчивости могут обостриться, и нередко таких больных диагностируют как «декомпенсация психастении» или «невроз навязчивых состояний». У лиц с тревожно-мнительным характером неглубокая энергическая депрессия может привести к резкому обострению черт тревожной мнительности, такие больные производят впечатление ажитированных, они мечутся но отделению, дежурят у кабинета врача, непрерывно спрашивают, не случилось ли что-нибудь с их близкими, не переведут ли их в другую больницу и т. п. Однако то, что эти внешние проявления тревоги связаны больше с личностью, а не со структурой патогенетических нарушений, показывают результаты терапии: часто ингибиторы МАО (ниамид) или другие антидепрессанты с выраженным стимулирующим компонентом действия приводят к быстрому терапевтическому эффекту. Это указывает на то, что сама депрессия по своей структуре была не глубокой анергической, в противном случае подобные антидепрессанты привели бы к ее обострению. Отличительным признаком таких состояний является также измененный суточный ритм; создается впечатление, сто утром они чувствуют себя даже лучше, чем вечером. Это объясняется тем, что утром собственно депрессивная симптоматика выражена сильнее и подавляет личностные проявления, к вечеру, наоборот, она ослабевает, и свойственные больным тревожность, навязчивости выступают сильнее, создавая видимость общего утяжеления симптоматики к вечеру. Точно так же при неглубокой депрессии обостряются ситуативно обусловленные трудности, переживании. Поэтому часто таким больным ставят диагноз «реактивная депрессия». Лишь тщательный психопатологический анализ, сбор анамнестических сведений, иногда специальные обследования (например, дексаметазоновый тест) позволяют установить, что под «реактивной» симптоматикой скрывается неглубокая эндогенная депрессия. Все эти случаи подпадают под определение «замаскированная депрессия», поскольку психопатические черты, реактивно обусловленные переживания маскируют неглубокую депрессию. Иногда депрессия маскируется соматическими жалобами, но здесь надо учесть, что эти проявления характерны не столько для депрессии, сколько для тревоги. Поэтому депрессивные состояния, «замаскированные» соматическими жалобами, чаще по своей структуре являются тревожно-депрессивными, что подтверждается опытом их лечения. Правда, использование в качестве дифференциально-диагностического критерия результатов терапии антидепрессантами в этом случае имеет недостатки. Как известно, почти все современные антидепрессанты обладают анальгетическим эффектом, поэтому облегчение боли может быть обусловлено не антидепрессивным эффектом удачно подобранного препарата, а его анальгетическим действием, не имеющим никакого отношения к аффективным нарушениям. Более подробно понятие «замаскированная депрессия» будет рассмотрено в разделе, посвященном классификации и дифференциальной диагностике депрессивных состояний. Таким образом, при неглубоких депрессивных состояниях с разной аффективной структурой в психопатологическую картину могут включиться ситуационно обусловленные переживания, присущие больному психопатические черты (психастенические, тревожная мнительность, реже — истерические) и др. По мере нарастания тяжести депрессии эти присущие данному больному черты постепенно сглаживаются, и пациенты с тяжелой эндогенной депрессией как бы частично утрачивают присущие им индивидуальные черты и все в большей степени приобретают черты сходства. В руководствах по психиатрии начиная с изданий Э. Крепелина эти среднетяжелые и тяжелые депрессивные состояния служили эталоном «типичной» депрессивной фазы МДП — заторможенной или ажитированной. Нарастание тяжести меланхолического синдрома может дойти до степени депрессивного ступора с полным обездвиживанием, мутизмом, глубокой психической заторможенностью. По наблюдениям Lange, У таких больных отмечались кататонические явления. Крайне тяжелые случаи были описаны Крепелином под названием Melancholia gravis. У этих больных к нарастанию тревоги присоединяются бред преследования и галлюцинации. Дальнейшее утяжеление состояния может привести к появлению причудливых, спутанных бредовых представлений, обычно в форме нигилистического бреда и с «призрачным толкованием окружающей обстановки» (так называемая фантастическая форма). Другой вариант — делириозная форма — характеризуется периодами сноподобного помрачения сознания со спутанными фантастическими переживаниями, причем больные находятся в состоянии ступора. В дальнейшем некоторыми авторами подобные состояния стали описываться в рамках иных нозологических форм — приступообразной шизофрении, периодических органических психозов, инволюционных паранондов. Однако сам Крепелин, приводя соответствующие наблюдения, подчеркивал, что больные с подобными тяжелыми состояниями в прошлом переносили достаточно типичные депрессивные фазы. То, что резкое усиление треноги у больных МДП может привести к появлению бреда, галлюцинации, помрачения сознания, подтверждают отдельные случаи ошибочной терапии таких больных. Так, одна больная 50 лет, перенесшая до этого 2 депрессивные фазы (первая в 46 лет), поступила в больницу с тяжелим тревожно-депрессивным состоянием, интенсивными идеями виновности. Лечение лудиомилом привело к резкому нарастанию тревоги, больная испытывала сильнейший страх, окружающую обстановку воспринимала как бутафорию, инсценировку, чувствовала, что за ней следят, заметила вмонтированный в стенку фотоэлемент — «из соседнего здания действовали лучами», «проводили над ней какой-то эксперимент»; слышала звон ключей, подозрительную возню вокруг, ждала ареста, страшной кары, считала, что пострадают ее дети. Восприятие времени было изменено, видела несуществующий снег в окне. Отмена антидепрессантов и назначение хлорпротиксена привели к быстрому улучшению состояния, восстановилась картина ее предыдущей депрессивной фазы. Переживания, возникшие на высоте тревоги, воспринимала частично, «как страшный сон». Через некоторое время состояние полностью нормализовалось. В дальнейшем, после полно ценной ремиссии, перенесла еще одну депрессивную фазу с тревожно-депрессивной симптоматикой, но без атипичных включений. В данном случае лудиомил, применяемый без сочетания с седативными средствами, очевидно, не был показан для больной с достаточно тяжелым тревожно-депрессивным синдромом и привел к обострению тревоги, которая обусловила трансформацию симптоматики, аналогичную той, которую описал Крепелин как Melancholia gravis. To, что в данном случае больная страдала МДП (с монополярным течением и поздним началом), подтверждается и анамнезом (две достаточно типичные фазы с интермиссиями), и характером выхода из данного состоянии, и катамнезом. В другом случае лечение мелипрамином пожилого больного биполярным МДП с напряженным меланхолическим синдромом также привело к обострению тревоги, на высоте которой возник ступор с онейроидными переживаниями. У больных с тревожно-депрессивным синдромом не-обоснованное лечение ниамидом (нураделом) вызывало состояние тяжелой тревоги и возникновение бреда Котара. У всех этих больных при отмене неадекватной терапии и назначении противотревожных средств описанная выше симптоматика вновь сменялась характерной для них депрессией. То, что эти состояния потенциально присущи МДП, подтверждается сходством наблюдений Крепелина в отношении спонтанного течения психоза с приведенными выше описаниями обострении, вызванных неадекватной терапией, усиливающей тревогу, а также анамнезами и катамнезами этих больных (Ставя в данных случаях диагноз МДП, мы, разумеется осознаем относительность нозологических критериев). Таким образом, особенности депрессивной симптоматики и соответственно ее синдромальная характеристика определяются не только аффективной структурой состояния, но и его тяжестью, силой патологического аффекта. Клиническая картина средней тяжести обычно принимается за «типичную». При легких состояниях «атипичность» возникает за счет заострения и включения в клиническую картину психопатических черт, интенсивного звучания реактивных, ситуационных мотивов, иногда соматизации. Депрессивные состояния, намного превосходящие по тяжести средний диапазон, включают в себя такую, обусловленную интенсивной тревогой, симптоматику, как бредовые идеи и слуховые иллюзии, галлюцинации, нигилистический бред Котара, нарушения сознания. Таким образом, в рамках МДП депрессивно-параноидный синдром вполне возможен и отражает лишь тяжесть заболевания и силу тревожного компонента синдрома, а не его «атипичность». За последние годы благодаря применению психотропных средств подобные состояния редко возникают спонтанно, однако неадекватное применение антидепрессантов, обостряющее тревогу, может их вызвать Значительно отличается по структуре от других депрессивных синдромов депрессивно-деперсонализационный. Для него характерна массивная ауто- и соматопсихическая деперсонализация, которая как бы зашторивает тоску и тревогу. Часто на вопрос о настроении больные с депрессивно-депорсопализационным синдромом отвечают, что «настроения вообще нет никакого ни плохого, ни хорошего», хотя при этом их мимика выражает скорбь. Подробно это состояние описали в гл. 7. Таким образом, все многообразие депрессивных синдромов может быть представлено кап следствие взаимосочетания двух переменных факторов: 1) аффективной структуры синдрома, т.е. соотношение «тоска / тревога», и 2) силы, интенсивности аффективных нарушений. Такие синдромы, как «энергическая депрессия» меланхолический и тревожно-депрессивный, характеризуются уменьшением роли тоски, подавленности с нарастанием аффективного напряжения, тревоги, при чем обычно интенсивность аффектов достаточно выражена. Другие симптомы являются следствием заострении личностных и психопатических черт, обусловленного легкой депрессией, и, включаясь в психопатологическую картину, они часто оказываются на первом плане, оттесняя и маскируя собственно депрессивную симптоматику. К синдромам с такой симптоматикой от носится депрессивно-обсессивный, причем если в аффективной структуре синдрома относительно преобладает тревога, то синдром может быть определен как депрессивно-фобический. Обилие неврастенической симптоматики (и обычно умеренных ипохондрических жалоб) приводит к клинической картине, описываемой как «астено-депрессивный» синдром. В отдельных, весьма редких, случаях у больных обостряются или даже впервые появляются истерические черты («депрессивно-истерический» синдром). Очевидно, нарастание или появление истерической симптоматики в период депрессии может быть обусловлено разными причинами и иметь разное значение: иногда это проявление истерических черт на фоне неглубокой депрессии, иногда ото реакция на интенсивную тревогу и обусловленную ею растерянность. Наконец, иногда депрессивное состояние имеет типичные черты ажитированной депрессии, однако неожиданно поддается терапии стимулирующими антидепрессантам. Как указывалось выше, эти проявления поведенческой тревоги обусловлены не столько интенсивностью аффекта тревоги, сколько обострившимся чертами тревожной мнительности, присущими этим больным в преморбиде. Нередко отличительной чертой этих «маскирующихся под ажитированную депрессию» состояний является упомянутый выше «извращенный» суточный ритм: к вечеру, когда депрессия слабее, ярче проявляются навязчивости, тревожная мнительность, истерические черты. При крайне интенсивном аффекте депрессия может приобрести характер «депрессивно-параноидного» синдрома, синдрома Котара, депрессивно-онейроидного состояния. Депрессивпо-деперсонацизационный синдром занимает в этом ряду особое место, так как в его ядро, помимо тоски и тревоги, включена деперсонализация, которую следует рассматривать как самостоятельный психотический регистр. Весьма неоднороден и плохо очерчен так называемый депрессивно-ипохондрический синдром. «Депрессивно-ипохондрическая» картина может быть следствием столь многих причин и возникать при столь различных не аффективной структуре депрессивных состояниях, что его выделение теряет всякий смысл. Причиной появления ипохондрических идей могут быть личностные особенности больного (пример с профессиональными спортсменами), наличие массивных соматических и особенно алгических симптомов, затяжное течение депрессии и чаще всего — при депрессивно-деперсонализационном синдроме. В этом последнем случае ипохондрические жалобы иногда полностью оттесняют и проявления депрессии, и деперсонализацию. Ипохондрические жалобы имеют здесь интерпретативный характер: больной ищет соматическую причину, чтобы объяснить чувство собственной измененности (психической и физической), длительность заболевания, наличие сенестопатий. Поэтому выделение при эндогенной депрессии самостоятельного «депрессивно-ипохондрического» синдрома нам кажется нецелесообразным, потому что приклеивание такого ярлыка не-редко прекращает дальнейший анализ структуры состояния. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 5 ТЕЧЕНИЕ МАНИАКАЛЬНО ДЕПРЕССИВНОГО ПСИХОЗА |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Данные о течении МДП весьма немногочисленны. Еще Kraepelin (1904) указал, что оно является нерегулярным и непредсказуемым на современном уровне знаний. Он лишь отметил, что частота и длительность фаз нарастают во времени и что первая интермиссия, как правило, оказывается самой продолжительной. Позднее М. Kinkelin (1954) подтвердила эти наблюдения, показав, что средняя длительность депрессивных состояний нарастает с 1-й до 5-й фазы, причем эта тенденция связана с наследственной отягощенностью. В дальнейшем в ряде работ была подтверждена общая тенденция МДП к удлинению приступов и сокращению межприступных интервалов по мере течении заболевания. Ряд параметров в определенной мере характеризует течение в каждом конкретном случае, Это возраст, и котором дебютировал психоз (раннее — позднее начало), регулярность — нерегулярность приступов. Один аз вариантов регулярного течения — сезонность, так как депрессивные состояния, так же, как и маниакальные, чаще возникают весной, а затем осенью. В последнее время большое значение придают полярности психоза: при наличии только депрессивных фаз — монополярный, при депрессивных и маниакальных — биполярный. Очень редко встречается монополярная мания. Имеется несколько вариантов биполярного течения: иногда биполярный ритм устанавливается после первых же приступов психоза, и при таком течении фазы — маниакальные и депрессивные — обычно разделены интермиссиями. В других случаях, особенно при длительном и интенсивном применении антидепрессантов, монополярная депрессия переходит к биполярному течению постепенно: сначала после окончания очередной депрессии возникает короткий (иногда несколько часов) гипоманиакальный эпизод, после следующей депрессии он продолжается 12 ч или 1 сутки, затем — несколько дней, и постепенно формируются типичные сдвоенные фазы. При достаточно длительном течении сдвоенные фазы имеют тенденцию к переходу в непрерывно циркулярное течение без ремиссий. Течение МДП характеризуется также длительностью фаз, постепенным или острым дебютом и регрессом симптоматики, длительностью и чистотой интермиссий (иногда в период интермиссии возникают короткие субклинические депрессивные или депрессивные и маниакальные эпизоды), строением фазы: длительная депрессия может протекать монотонно или носить волнообразный характер, а иногда фаза состоит как бы из пачек коротких депрессий. Как указывалось, в каждом случае индивидуальное течение определяется сочетанием этих параметров. Для того, чтобы выявить взаимодействие этих тенденций и их возможную связь с определенными этиопатогенетическими факторами, нами было предпринято изучение течения МДП с помощью факторного анализа, возможности и преимущества которого были описаны ранее. Материалом исследования явились данные о течении психоза, наследственной отягощенности, экзогенных вредностях и особенностях характер» 75 больных маниакально-депрессивным психозом. Они были отобраны из числа Солее чем 300 больных «типичным» маниакально-депрессивным психозом, находившихся под нашим наблюдением 10 лет. Критерием для отбора этих 75 больных, помимо «типичности» психоза, служили длительность заболевания (не менее 10 лет) и число перенесенных приступов (не менее 4 фаз). Большинство из них наблюдались нами в течение нескольких приступов психоза и в светлых промежутках. Среди больных было 37 женщин и 38 мужчин. У 49 из них наблюдались и маниакальные, и депрессивные состояния, у 26 — только депрессивные. Возраст начала заболевания составлял от 9 до 55 лет (в среднем — 27,7 года), длительность заболевания — от 10 до 51 года (в среднем — 21,8 года). Наследственная отягощенность была выявлена у 62% больных. Ни в приступах, ни в светлых промежутках у больных не было обнаружено гетерогенной для МДП симптоматики. Для обработки методом факторного анализа (Программы факторного анализа составлены Т. П. Кистер Обработка производилась на ЭВМ «БЭСМ-4») был отобраны 28 признаков: первые 13 характеризовали наследственность и преморбид больного, остальные 15 — течение процесса. Ниже приводится список этих признаков: 1. Гомогенная наследственность 1. 2. Гетерогенная наследственность (шизофрения и другие бредовые психозы). 3. Гетерогенная «органическая» наследственности (эпилепсия, олигофрения, грубые органические психозы). 4. Наследственная отягощенность диабетом. 5. Малярия. 6. Тяжелые инфекции в детстве (с гиперпирексией, судорожными припадками, нарушениями сознания, инфекционным делирием и т. п.). 7. Ревматизм. 8. Туберкулез. 9. Травмы головы с потерей сознания. 10. Длительный психогенный стресс (учитывались только крайне тяжелые и длительные психотравмирующие ситуации). 11. Индекс суммы экзогенных вредностей (все перенесенные в преморбиде тяжелые заболевания, травмы, контузии, алиментарная дистрофия и т. д.), 12. Гипертимный характер. 13. Тревожно-мнительный характер. 14. Возраст начала болезни. 15. Длительность заболевания. 16. Возраст больного при последней регистрации его состояния. 17. Провокация первой фазы. 18. Длительность первой интермиссии. 19. Среднее количество месяцев болезненного состония (маниакального и депрессивного), приходящееся на 1 год заболевания. 20. Показатель нарастания суммарной длительности фаз (частное от деления суммарной длительности всех фаз 2-й половины заболевания на сумму длительности всех фаз 1-й половины). 21. Среднее количество фаз на 1 год заболевания. 22. Показатель нарастания частоты фаз (частное отделения числа фаз 2-й половины заболевания на число фаз 1-й половины, 1-я фаза не учитывалась, как и в признаке 20). 23. Средняя длительность депрессивных фаз, начиная с 3-й фазы. 24. Показатель удлинения депрессивных фаз (частное от деления суммарной длительности последних фаз на сумму длительности равного количества первых фаз, начиная с 3-й). Если число фаз было нечетным, средняя фаза не учитывалась. Так, если больной перенес 9 фаз, то суммарная длительность 3 последних фаз делилась на суммарную длительность 3-й, 4-й и 5-й фаз; 2 первые фазы и 6-я (средняя) фазы не учитывались. 25. Средняя длительность циклов — интервалов между началом последующих депрессивных фаз, считая с начала 3-й фазы. 26. Показатель укорочения циклов (определялся аналогично показателю 24 с начала 3-го цикла). 27. Наличие маниакальных эпизодов. 28. Отношение суммарной длительности маниакальных и депрессивных фаз. 1 Признаки 1-10, 12, 13, 17, 27 оценивались альтернативно («0» или «1»). По причинам, приведенным ниже, 1-я фаза не учитывалась; период болезни от начала 2-й фазы до конца делился пополам, и в каждой половине подсчитывалась сумма длительности фаз в месяцах). В признаках 20 и 22 учитывалась динамика приступов, начиная со 2-й фазы. Это было вызвано тем, что при предварительном анализе материала оказалось, что у части больных 1-я интермиссия оказалась непропорционально большой по сравнению с последующими светлыми промежутками (у некоторых больных до 20-30 лет). Такой продолжительный 1-й светлый промежуток обычно покрывал всю первую половину заболевания, в результате чего показатели утяжеления течения были очень большими вне зависимости от характера дальнейшей динамики заболевания. В признаках 23, 24, 25, 26 отсчеты начинались с 3-й фазы, так как первые 2 фазы и 2 интермиссии часто значительно отличались от последующих по длительности. Показатель 27 был введен из-за того, что у некоторых больных встречались очень короткие маниакальные эпизоды (иногда измеряемые часами), плохо поддающиеся количественному учету и выражению в признаке 28. Результаты факторного анализа этих признаков представлены в табл. 11. ТАБЛИЦА №11
ПРИЛОЖЕНИЕ
1-й фактор интерпретировался как биполярный фактор «насыщенности всего периода заболевания периодами аффективных нарушений»: с малым удельным весом периодов аффективных нарушений по сравнению со светлыми промежутками на одном полюсе и с большим удельным весом этих периодов (большой «насыщенностью» ими) — на другом полюсе фактора. Благоприятная тенденция характеризовалась редкими, по относительно длинными депрессивными фазами без маниакальных состояний, противоположная тенденция — частыми, относительно короткими депрессивными и маниакальными фазами с преобладанием депрессивных состояний. Эта тенденция коррелирует с ревматизмом в анамнезе. Вероятно, ее крайним выражением является непрерывный циркулярный тип течения. При просмотре корреляций между отдельными признаками, объединенными в 1-м факторе, оказалось, что ревматизм в относительно большей степени связан с наличием мании (+0,27) и ранним началом психоза (+0,26). 2-й фактор был опознан как «фактор нарастания тяжести за счет удлинения приступов». Эта тенденция была связана с гомогенной наследственной отягощенностью и отрицательно коррелировала с экзогениями. 3-й фактор интерпретировался как «фактор нарастания тяжести за счет учащения приступов». Тенденция к нарастанию частоты приступов была связана с тяжелыми инфекциями, перенесенными в детстве, и, очевидно, усиливалась в более позднем возрасте. 4-й фактор — «фактор позднего начала» — характеризует тенденцию к позднему началу психоза и монополярному течению (только депрессии). Эта тенденция отрицательно коррелировала с гомогенной наследственной отягощенностью. Хотя выделенные факторы могут быть легко идентифицированы (а это указывает на то, что они действительно отражают клиническую реальность), все же обращают на себя внимание их незначительные факторные веса. Возможные объяснения этого заключаются и том, что большинство из первых 13 признаков практически независимы друг от друга, что показало изучение их корреляций, и оценивались они лишь альтернативно («0» — «1»). Действительно, при отдельной обработке 15 последних признаков, описывающих течение психозов, выделялись сходные факторы, но с большими весами факторов: 1-й фактор («насыщенность») имел вес 21,7%. Совпадение факторов при обработке всех и только части признаков служит доказательством их устойчивости и воспроизводимости. Таким образом, полученные данные позволили выделить некоторые тенденции в течении МДП. Подтверждением- того, что речь идет действительно о тенденциях, а не о самостоятельных, изолированных вариантах течения, являются случаи, когда у одного и того же больного обнаруживаются большие значения нескольких факторов. Индивидуальное течение заболевают и является результирующей этих нескольких тенденций: 1. Тенденция к удлинению фаз, связанная с гомогенной наследственной отягощенностью. 2. Тенденция к учащению фаз, связанная о тяжелыми инфекциями, перенесенными и детстве. 3. Тенденция к тяжелому биполярному течению с большим количеством коротких фаз, слабо связанная с ревматизмом. Как указывалось выше, большая тенденция к удлинению фаз у наследственно отягощенных больных была описана ранее (Kinkelin M., 1954). Тенденция к учащению аффективных приступов, очевидно, является доминирующей в описанном Т. Я. Хвиливицким (1959) отставленном органическом аффективном психозе, связанном главным образом с органическими поражениями центральной нервной системы, приобретенными в раннем детстве. Однако у больных этой формой аффективного психоза первые приступы являются грубо атипичными, чем они отличаются от наших больных, не имевших в прошлом гетерогенной для МДП симптоматики. Нарастание частоты приступов и непропорционально большой (по сравнению с последующими) первый светлый промежуток являются показателями аритмичности течения заболевания. Во 2-м факторе большая продолжительность первой интермиссии отрицательно коррелировала с тенденцией к относительно равномерному (по частоте фаз) течению МДП, связанному с гомогенной наследственностью. Кроме того, большая первая интермиссия положительно коррелировала с экзогенными воздействиями. Для выяснения роли экзогенных вредностей в течении МДП мы провели дополнительное исследование 368 больных. У 47 больных длительность первой интермиссии превышала 10 лет, и у 21 из них (44,7%) отмечались тяжелые инфекции с церебральной сиптоматикой в детстве. У больных МДП с первой интермиссией короче 10 лет тяжелые инфекции были установлены лишь в 21,3% случаев (у 47 из 221 больных). Эти различия являлись статистически достоверными (р<0,05). Одно из возможных объяснений связи тяжелых инфекций, сопровождавшихся нарушениями со стороны центральной нервной системы с нерегулярностью течении МДП заключается в том, что вследствие этих заболеваний был снижен порог устойчивости к внешним вредностям. Поэтому у таких больных возникновение отдельных приступов в значительной степени зависит от случайных внешних (факторов, чем и обусловлена их нерегулярность, в то время как у некоторых больных с гомогенной наследственной отягощенностью течение заболевания в большей мере определяется присущими ему внутренними закономерностями, «эндогенным ритмом». Если это так, то у больных с нерегулярным течением МДП можно было бы ожидать большей чистоты провоцирующих факторов перед первой фазой. В той же группе из 268 больных МДП провоцирующие факторы (острые психотравмирующие ситуации, тяжелые роды и т. и.) встречались у 36,2% больных с большой первой интермиссией (свыше 10 лет) и у 23% больных с более короткими первыми светлыми промежутками. Поскольку эти различия не достигают значимого уровня (0,05 < р < 0,1), поставленные вопросы требуют дальнейшего исследования. Альтернативное объяснение может также заключаться в том, что тяжелые реакции, сопровождавшие инфекционные заболевания в детстве, и особенности течения МДП являются следствием присущей этим больным чрезмерной реактивности центральной нервной системы. Интересно, что профилактическое действие лития, как будет показано далее, сказывается раньше и в большей степени на длительности депрессивных фаз и меньше на их частоте. Это косвенно указывает на различные патогенетические механизмы, лежащие в основе двух тенденций течения, описываемых 2-м и 3-м факторами. Связь ревматизма с биполярным течением, характеризующимся частыми короткими фазами, представляется неясной. Интересно отметить, что при обработке факторным анализом только первых 12 признаков (11-й признак был также исключен) ревматизм обнаружил корреляцию с гетерогенной наследственностью (инволюционные, «соматогенные» и другие бредовые психозы). Возможно, что и ревматизм, и характер течения МДП обусловлены какой то генетической неполноценностью адаптационных механизмов. Во вся-ком случае этот вопрос требует специального изучения Как указывалось выше, выделенные факторы характеризуют не отдельные формы психоза, а лишь, тенденции в его течении. Однако факторный анализ может способствовать группировке больных и выявлению отдельных вариантов заболевания. Нами были отобраны по 5 больных с наибольшим значением каждого из факторов. Оказалось, что у трех из них одновременно были наибольшие значения 2 первых факторов. Сопоставление этих больных показало, что они были объединены наличием длительных депрессивных фаз (от 2,5 до 6 лет) и тенденцией и их удлинению в течение заболевания. Кроме того, эти больные имели и другие общие черты, не входившие в число исследовавшихся признаков. Это женщины со своеобразной нисходящей наследственностью: среди их дочерей встречались больные, которым в разных больницах ставился диагноз «атипичный МДП». В 3-м поколении были обнаружены случаи олигофрении и ранней шизофрении. Генетическое древо одной из этих больных приведено на рис. 1 в гл. 1. Все эти больные обладали сходными чертами характера — это были энергичные, стеничные, властные люди. Симптоматика отдельных фаз была типичной для МДП и не содержала гетерогенных включений. Интересно, что, несмотря на преклонный возраст (более 70 лет), ни у одной из больных не было обнаружено выраженных возрастных изменений психики. Как указывалось выше, почти во всех случаях МДП имеется тенденция к утяжелению течения заболевания со временем: учащение и удлинение фаз, присоединение маний к бывшему до этого монополярному течению, формирование сдвоенных фаз и т. д. Условно можно представить, что если бы длительность заболевания была неограниченной, то через тот или иной промежуток времени у всех больных сформировался бы непрерывный циркулярный тип течения, который, таким образом, как бы является логическим завершением процесса. Так же, как синдромы отражают наиболее часто встречающиеся и устойчивые сочетания симптомов, отдельные формы течения, очевидно, отражают наиболее частые и устойчивые сочетания ряда тенденций течения. Как указывалось, гомогенная наследственная отягощенность в большей степени связана с более пли менее упорядоченным течением, при котором происходят постепенное учащение и удлинение фаз. Наоборот, органические вредности, чаще перенесенные в раннем детстве тяжелые инфекции с гиперергическими реакциями, связаны с тенденцией к нерегулярному течению, с частыми и нередко короткими приступами. Характерно для таких больных наличие «сверхдлинной» первой интермиссии и относительно высокая частота преципитирующих (провоцирующих) фазу экзогенных воздействий. Значительно труднее оценить роль гетерогенной наследственной отягощенности: у части больных с наследственной отягощенностью эпилепсией отмечается биполярное течение с относительно длительными депрессивными и маниакальными фазами, причем мания обычно протекает в виде «гневливой». Создалось впечатление, что при наличии по восходящей линии органических психозов, алкогольного психоза и шизофрении, течение МДП также отличается нерегулярностью, частыми не длинными фазами, биполярностью. Однако эти наблюдения немногочисленны. При шизофрении или «шизоаффективных» психозах по нисходящей линии у больных относительно часто наблюдаются затяжные (1 год и более) фазы. Следует еще раз напомнить, что данные, полученные нами с помощью факторного анализа, как и нее результаты этого метода, носят скорее качественный, чем количественный характер. Они лишь выявляют взаимосвязи внутри изучаемого процесса. Приведенные результаты показывают, что практически пет жестко запрограммированных типов течения для определенных форм МДП: в каждом индивидуальном случае заболевания имеются несколько сосуществующих тенденций течения, каждая из которых, по-видимому, связана с определенными механизмами. Набор утих тенденции, их выраженность и взаимодействие определяют характер течения психоза у данного больного. Иначе говоря, происходит как бы наслаивание различных тенденций, результирующая которых и является кривой, отражающей течении заболевания. В настоящее время большое внимание уделяется полярности течения МДП, причем ряд авторов рассматривают биполярный МДП и монополярную рекуррентную депрессию как два самостоятельных заболевания. Против столь категорического деления имеется ряд возражений, и прежде всего то, что значительной части больных после большого количества депрессивных фаз начинают присоединяться маниакальные эпизоды, а затем формируются сдвоенные фазы. Лечение некоторыми антидепрессантами как будто бы усиливает эту тенденцию. Тем не менее различия между двумя типами течения весьма отчетливы (см. табл. 15). Весьма значительные различия обнаруживаются в дебюте заболевания: у больных биполярным МДП чаще всего фазы заболевания начинаются быстро, иногда внезапно, как будто «что-то включилось», иногда же им предшествует короткая продрома: бессонница, тяжелые пробуждения, иногда перед каждой фазой больной совершает какие-то определенные действия. Так, один из них всегда начинал перечитывать «Мартина Идена» и т. п. При монополярном течении, особенно с поздним на чалом, депрессия развертывается медленно; часто за недели или месяцы до ее начала у больных усиливаются тревожность, неуверенность, появляются неопределенные боли — головные, в теле, в суставах, конечностях, «тянет» в затылке и шее, легко возникают миозиты и радикулиты, повышается артериальное давление, больные жалуются на вялость, физическую разбитость, снижение работоспособности, концентрации внимания. Эти явления могут быть отчетливо выражены и продолжаться неделями и месяцами, иногда присутствуют только отдельные из приведенных жалоб. Депрессия начинается постепенно, характеризуясь в дебюте тревожно-депрессивным синдромом, нередко с деперсонализационными явлениями, либо что-нибудь ее провоцирует — неприятность, соматическое заболевание, месячные. У женщин подобное начало обычно бывает в период инволюции. Как будет показано далее, эти различия в дебюте требуют особого терапевтического подхода. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 6 ЛЕЧЕНИЕ ДЕПРЕССИИ |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Более или менее эффективные методы лечения депрессии появились в нынешнем столетии. Применявшиеся еще в античные времена психотерапия, музыкотерапия, лечение занятостью, различные гигиенические мероприятия и режимы, диета приносили лишь незначительное облегчение. Все эти способы, а также гидротерапии широко использовались вплоть до начала нашего века. В это время для лечения больных депресией стали также применять успокаивающие лекарственные средства: хлоралгидрат, амитал-натрий, морфий и опий. Возможно, антидепрессивное действие препаратов морфия вновь привлечет внимание исслевателей в свете недавнего открытия эндорфинов. Первый крупный успех в лечении депрессии был достигнут в 30-х годах, когда была введена судорожная терапия. В 1935 г. Медуна применил для лечения шизофрении судорожные припадки, вызываемые инъекцией камфоры. В дальнейшем с этой целью стали использовать коразол (метразол). Однако более широкое распространение получила предложенная Черлетти и Бини электросудорожная терапия. ЭСТ и по настоящее время все еще остается самым эффективным методом лечения эндогенной депрессии. Однако коренной перелом в этой области наступил в 50-х годах, когда почти одновременно (в 1956-1957 годах) появились сообщения об антидепрессивном действии ипрониазида и имипрамина — родоначальников двух основных групп современных антидепрессантов. Терапевтический психотропный эффект этих препаратов был обнаружен случайно. Ипрониазид и изониазид были синтезированы и применялись в клинике как противотуберкулезные средства. Было замечено, о в результате терапии у многих больных значительно повысилось настроение, хотя существенного улучшения их соматического состояния, за счет которого Можно было бы объяснить эйфорию, не отмечалось. Эти наблюдения привели к попытке применить ипрониазид для лечения депрессии у психически больных, и первые же результаты оказались достаточно обнадеживающими. Фармакологические исследования ипрониазида и других антидепрессантов — производных гидразина — показали, что механизм их терапевтического действия связан с торможением моноаминоксидазы (МАО) — фермента, разрушающего моноамины: адреналин, норадреналин, дофамин и серотонин. Родоначальник группы трициклических антидепрессантов имипрамин (тофранил, мелипрамин) был синтезирован в 1948 г. в лабораториях фирмы Geigy (Швейцария), а в 1950 г. — передан для клинического испытания. Однако до 1954 г. препарат лежал без движения, пока блестящие результаты, полученные при применении в психиатрической клинике близкого по химическому строению трициклического соединения — хлорпромазина (ларгактила, аминазина), не привлекли к нему внимания. С 1954 по 1957 г. имипрамином лечили более 500 больных в клинике Р. Куна в Швейцарии, и первые публикации (Kuhn R., 1958) содержали исключительно точную и исчерпывающую характеристику нового препарата. По его данным, имипрамин оказался особенно эффективным у больных типичной «простой» эндогенной депрессией с тоской, заторможенностью, суточными колебаниями настроения, причем даже в случаях крайне тяжелой меланхолии. Чем типичнее и «чище» была депрессивная симптоматика, чем меньше в ней было экзогенных проявлений, тем лучшими оказывались результаты лечения имипрамином. Наличие бреда, галлюцинаций резко ухудшало прогноз терапии. У больных шизофренией с депрессивной симптоматикой лечение, как правило, было малоэффективным. В тех же случаях, когда такие симптомы, как навязчивости, возникали у больных эндогенной депрессией и лишь маскировали ее основные проявления, имипрамин оказывал положительный терапевтический эффект. Сильная тревога и страх и структуре депрессивного синдрома были неблагоприятным признаком, однако при нерезкой тревоге имипрамин проявлял анксиолитическое действие. Обычно первые признаки улучшения наступали в период от 3-4 дней до 4 недель после начала терапии. Несвоевременное прекращение лечения приводило к возобновлению депрессивной симптоматики даже в тех случаях когда достигнутый до этого терапевтический эффект был значительным. Оптимальные суточные дозы имипрамина составляли 150 мг внутримышечно и до 300 мг внутрь. В отдельных случаях препарат вводили внутривенно. У имипрамина был также обнаружен анальгетический эффект, выявленный затем и у других антидепрессантов. Побочные эффекты в первую очередь заключались в сухости слизистой рта, тахикардии, потливости и т. п. Было отмечено, что при биполярном течении аффективного психоза имипрамин способен вызвать возникновение мании. Крайняя добросовестность наблюдений, тщательный клинический анализ, большое количество леченных имипрамином больных обусловили высокую достоверность полученных Куном данных, так что все последующие клинические исследования имипрамина лишь подтверждали его результаты пли вносили в них незначительные дополнения — уникальный случай в истории психофармакологии, если не считать столь же исчерпывающие работы P. Baastrup, M. Schou (1967) о профилактическом действии солей лития. Высокая эффективность имипрамина явилась побудительной причиной последующих изысканий, целью которых было создание новых антидепрессантов: 1) обладающих более широким спектром действия, особенно в отношении тех депрессивных синдромов, которые плохо поддаются лечению имипрамином; 2) имеющих более сильный антидепрессивный эффект, поскольку имипрамин оказывал положительное действие лишь в 60-80%; 3) превосходящих имипрамин по быстроте наступления терапевтического эффекта, так как именно в начале терапии, когда антидепрессивное действие лекарств еще не наступило или проявлялось в уменьшении двигательной заторможенности без существенного улучшения настроения, наиболее высок риск суицида. В результате интенсивных исследований был создан ряд сходных по строению с имипрамином препаратов — так называемых трициклических антидепрессантов или препаратов группы имипрамина: амитриптилин, дозметилимипрамин (пертофран), хлоромипрамин (анафранил), доксепин и др. Одновременно были синтезированы новые антидепрессанты — ингибиторы МАО: фенелзин, марилан, иналамид (инамид, нуредал), транилципромин (трансамин, парнат) и др. После того, как было установлено, что антидепрессивное действие имипрамина и других препаратов его группы связано с потенцированием центральных эффектов моноаминов: «норадреналина и серотонина, были сделаны попытки использовать для лечения депрессии предшественники биогенных аминов — триптофан и ДОФА. В отношении триптофана были получены положительные результаты, особенно в тех случаях, когда триптофан сочетался с ингибиторами МАО (Михаленко И. Н., 1973). Однако этот метод терапии до сих пор не внедрен в широкую практику по ряду при чин: по эффективности он далеко не всегда превосходит другие антидепрессанты, триптофан малодоступен и дорог. В дальнейшем для клинического испытания в качестве антидепрессантов был передан ряд препаратов, в том числе бициклических и тетрациклических, причем все они усиливали моноаминергические процессы в мозге. Так, в СССР был синтезирован и внедрен и практику антидепрессант пиразидол (Машковскнй М. Д. и Андреева Н. И., 1975). Нейролептики (меллерил, левомепромазин, тизерцин, хлорпротиксен и др.) и транквилизаторы обычно применяются при лечении депрессии как вспомогательные средства, и лишь недавно появились данные о том. что такой транквилизатор, как феназепам, оказался весьма эффективным при лечении некоторых психотических тревожно-депрессивных состояний. В 70-х годах в Германии для терапии депрессии была применена депривация сна (Pflug В., 1972). Этот метод был обнаружен эмпирически: некоторые больные эндогенной депрессией отмечали отчетливое смягчение депрессивной симптоматики после бессонной ночи. Так, проживающая в маленьком городке больная С. 36 лет, страдающая с 17 лет маниакально-депрессивным психозом с тяжелым биполярным течением, пишет: «Я сама нашла средство, как бороться с болезнью: если у меня появляется тоска и не проходит несколько дней, я не сплю и чтобы не заснуть — хожу по городу. После этого тоска проходит». При этом методе лечения больные полностью лишаются сна в точение 36 ч. Подобные периоды лишения сна обычно повторяются 2 раза в неделю. В том случае, если после первых сеансов наступает улучшение, их продолжают до 6-7. Депривация сна проводится либо в сочетании с антидепрессантами, либо в «чистом виде». Так, Н. Lehmann (1977) сообщает о хороших результатах, полученных у 9 из 16 больных с тяжелой депрессивной симптоматикой, резистентной к терапии антидепрессантами. Депривация сна оказалась эффективной лишь у больных эндогенной, особенно монополярной, депрессией. Терапевтический эффект депривации сна был также подтвержден и в СССР (Бовин Р. Я. и соавт., 1979). Таким образом, для лечения депрессии наиболее широко применяются антидепрессанты, на втором месте стоит ЭСТ, которая по эффективности все еще превосходит остальные виды антидепрессивной терапии; из немедикаментозных методов за последние годы стали применять депривацию сна, хотя оценка ее непосредственных и отдаленных результатов требует дальнейших исследований. ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА АНТИДЕПРЕССАНТОВ Подавляющее большинство антидепрессантов — ингибиторов МАО: ипрониазид, фенелзин, иналамид, фенипразин, изокарбоксазид и др. — являются по химическому строению производными гидразина. Они необратимо тормозят МАО — фермент, осуществляющий дезаминирование моноаминов: серотонина, норадреналина, дофамина, адреналина вне синаптической щели и соответственно приводят к их накоплению в нервной ткани. К необратимым ингибиторам МАО относится также транилципромин, обладающий иной химической структурой. В живом организме МАО достаточно быстро синтезируется, и поэтому проходит определенный период времени, прежде чем МАО будет заблокирована в такой степени, что начнется существенный прирост моноаминов в мозге. Возможно, поэтому от начала лечения ингибиторами МАО до первых проявлений их терапевтического действия проходит 1-2 недели. После того, как МАО была эффективно заторможена, должно пройти 2-3 недели, прежде чем ее активность полностью восстановится за счет синтеза. Ингибиторы МАО с обратимым действием, например, паргилин, как антидепрессанты практически не применяются, так как активность МАО восстанавливается весьма быстро, вследствие чего не удается достичь достаточного и стабильного повышения содержания моноаминов в мозге. Моноаминоксидаза и сходные с ней ферменты, ингибируемые препаратами этой группы, имеются не только в центральных и периферических моноаминергических синапсах, но также в стенках кишечника и в печени, где они участвуют в ее дезинтоксикационной функции. Поэтому торможение МАО приводит к усилению всасывания в кишечнике аминокислот — предшественников биогенных аминов, содержащихся в пище, и снижению дезинтоксикационной функции печени. Как указывалось в гл. 2, механизм действия трициклических антидепрессантов («группы имипрамина») основан на их способности уменьшать обратный захват медиаторов моноамниов из синаптической щели. Помимо адрено- и серотонинопозитивных эффектов, трициклические антидепрессанты обладают значительный холинолитическим действием, более выраженным у диметильных соединений. По мнению некоторых исследователей, холинолитический эффект играет существенную роль в терапевтическом действии антидепрессантов (Щелкунов Е. Л., 1962). В настоящее время синтезировано, фармакологически изучено и широко применяется в клинике значительное число антидепрессаптов группы имипрамина. Все эти препараты имеют три циклическую структуру и по химическому строению близки друг к другу. Имипрамин, дезметилимипрамин, хлоримипрамин, тримепримин, являются производными иминодибензила; амитриптилин, нортриптилин, хлоргептадиен, протиаден, доксепин, а также протриптилин, прогептатриен и хлорпрогептатриен — производными дибензоциклогептанов, инсидон — дериватом иминостильбена, хлорацизин, фторацизин — фенотиазина, траусабун — дигидроантрацена и дибензепин — производным дибензодиазепина. В дальнейшем появились бициклические антидепрессанты, например Lu-3010, который, однако, оказался малоэффективным и является скорее стимулятором, а не антидепрессантом. М. Д. Машковским в качестве антидепрессанта был предложен четырехциклический препарат пиразидол, являющийся производным индола. Зачастую очень близкие по химической формуле лекарства, например, дезметилимипрамин и тримепримин, существенно различаются по характеру антидепрессивного эффекта в клинике, в то время как препараты, относящиеся к разным группам, весьма близки по особенностям терапевтического действия, например амитриптилин и траусабун. Как указывалось выше, исчерпывающая клиническая оценка имипрамина была дана Куном. В 1960 г. появились первые клинические данные об амитриптилине (триптизол, элавил) — новом антидепрессанте с более выраженным, чем у имипрамина, анксиолитическим действием. При использовании факторного анализа для обработки результатов лечения амитриптилином 137 женщин, страдавших эндогенной депрессией, было показано, что амитриптилин оказывал положительное влияние на больных с «синдромом тревоги и ажитации», Значительно превосходя в этом отношении имипрамин (Hordern A., Burt С, Holt N., 1965). Наличие значительного противотревожного компонента в действии амитриптилина и его лучшая переносимость по сравнению с имипрамином существенно расширили круг показаний к его применению. Так, амитриптилин оказался особенно эффективным по сравнению с другими антидепрессантами при лечении депрессий у лиц пожилого возраста. По характеру терапевтического эффекта очень близко к амитриптилину стоит траусабун (мелитрацен). К антидепрессантам с отчетливым транквилизирующим компонентом действия относится доксецин (синекван). По данным A. Krakowski (1969), лучше всего реагировали на терапию доксепином больные с менее выраженной симптоматикой в рамках психотической депрессии. В относительно однородных группах больных было обнаружено, что амитриптилин обладает более выраженным антидепрессивным действием, и то время как у доксепина противотревожный эффект был сильнее. В действии инсидона (опипрамола, эксидона) удельный вес транквилизирующего компонента, очевидно еще больше, чем у доксепина, так что в литературе дебатировался вопрос, следует ли его относить к истинным антидепрессантам или нейролептикам. Тем не менее было показано, что инсидон оказался достаточно эффективным средством при лечении эндогенной депрессии. Терапевтическое действие инсидона было особенно заметным при тревожной депрессии и прежде всего проявлялось в исчезновении тревоги. Лишь за тем начинала поддаваться терапии и витальная тоска. Сходным с инсидоном терапевтическим действием обладает тримепримин (сапилент). В середине 60-x годов большое количество клинических исследований было посвящено новерилу (дибензепину). В первых клинических исследованиях утверждалось, что поверил обладает бимодальным действием, будучи эффективным средством при лечении заторможенной, и ажитированной депрессии. Однако затем в ряде работ отмечалось, что по характеру антидепрессивного действия поверил ближе стоит к имипрамину, поскольку он малоэффективен при лечении депрессий с выраженной тревогой и ажитацией и эффективен при заторможенной депрессии. При лечении тревожной депрессии новерилом часто происходит обострение тревоги и ажитации. Усиление тревоги в процессе лечения новерилом, а также характер побочных реакций (наблюдавшееся в ряде случаев повышение артериального давления с последующим резким обострением психопатологической симптоматики) позволили отнести поверил к антидепрессантам с пре обладающим стимулирующим действием (Михален ко И. Н., Нуллер Ю. Л., 1970). Важной задачей являлось создание антидепрессантов с более быстрым терапевтическим действием. Возможность ускорить наступление терапевтического действия трициклических антидепрессантов как будто бы вытекала из гипотезы, согласно которой антидепрессивный эффект имипрамина (и препаратов его группы) осуществляется не им самим, а одним из продуктов его превращения — монометильным метаболитом дезметилимиирамнном. Применение дезмотилимипромина в качестве самостоятельного лекарственного средства могло бы обеспечить более быстрое действие, и у имипрамина, так как препарат вводится сразу в активной форме и не требуется времени для его предварительного деметилирования в организме больного. Действительно, большинство клинических исследований дезметилимипрамина (пертофран, дезипрамин, норирамин, сертофрен) показали, что его терапевтическое действие развивается быстро. Однако, преимущество дезипрамина в отношении скорости действия не было столь значительным, как можно было ожидать. В первых же клинических испытаниях было обнаружено, что дезметилимипрамин обладает более сильным стимулирующим действием по сравнению с имипрамином. В опытах на здоровых добровольцах он вызвал меньшую сонливость и седацию, чем имипрамин, а у больных депрессией в большей степени, чем имипрамин, влиял на психомоторную заторможенность и слабее — на компонент тревоги. Во всех исследованиях отмечено, что дезметилимипрамин, так же как имипрамин, наиболее эффективен при лечении эндогенной депрессии. Дезметиламитриптилин (нортриптилин, эвентил, вивидил, нортрилен и др.) является другим монометильлным производным три циклического антидепрессанта (амитриптилина), примененным в качестве самостоятельного препарата. Он оказался эффективным и безопасным препаратом при лечении различных по нозологической принадлежности депрессивных состояний и обладает, наряду с тимоаналептическим, несильным транквилизирующим компонентом действия. Несколько более быстрое терапевтическое действие нортриптилина по сравнению с другими антидепрессантами было отмечено в большинстве исследований. Дальнейшие исследования, как указывалось выше, показали, что деметилированные производные отличаются более сильным адренопозитивным и более слабым серотонинергическим эффектами. Для усиления психотропного действия имипрамина в его кольце атом водорода в положении 3 был заменен хлором. Как известно, хлорпромазин (аминазин), отличающийся от пропазина именно такой заменой водорода на хлор, обладает значительно более сильным эффектом. Первые клинические испытания нового препарата — хлоримипрамина (анафранил, минохлоримипрамин) — показали его высокую терапевтическую эффективность, причем, по мнению некоторых исследователей, анафранил при капельном введении не уступает по силе антидепрессивного действии электросудорожной терапии и, во всяком случае, может быть оценен как один из наиболее эффективных антидепрессантов. В отличие от имипрамина анафранил смягчал тревогу в структуре депрессивного синдрома, так что, по данным ряда работ, им одинаково успешно лечились больные как с ажитированной, так и с заторможенной депрессией. Указывают на очень быстрое наступление выраженного терапевтического эффекта анафранила, иногда даже в первые три дня, что, вероятно, связано с капельным способом его введения. За последние годы антидепрессанты — ингибиторы моноаминоксидазы (ИМАО) были в значительной степени вытеснены из психиатрической практики трициклическими антидепрессантами, обладающими большей терапевтической активностью и меньшей токсичностью. Помимо весьма серьезных осложнений, изредка встречавшихся при применении ИМАО, существенную роль в ограничении их использования сыграл страх врачей перед свойственными им тяжелыми реакциями несовместимости с рядом лекарственных средств и пищевых продуктов, иногда имеющими летальный исход. Тем не менее антидепрессанты группы ИМАО не потеряли полностью своего значения, так как при лечении отдельных форм депрессии они все еще превосходят другие методы терапии, а также находят применение у больных, резистентных к трициклическим антидепрессантам. Ниамид зарекомендовал себя как наименее токсичный из ИМАО, хотя по терапевтической эффективности (при приеме внутрь) он несколько уступает другим препаратам этой группы. Антидепрессанты группы ИМАО особенно эффективны при лечении неглубоких депрессивных состояний, характеризующихся астено-депрессинным или депрессивно-анергическим синдромом, без заметной тревоги, напряжения, тоски. Из побочных явлений и осложнений, возникающих при применении ИМАО, на первом месте по тяжести стоят нарушения, связанные с их цитотоксическим действием. Значительно чаще встречаются менее опасные побочные реакции: тахикардия, колебания артериального давления, одышка, сухость во рту, отеки лодыжек, головокружение, головные боли, тошнота, тремор, запоры, задержки мочеиспускания и т. д. Из психопатологических побочных эффектов отмечаются появление или обострение тревоги, часто возникающей по ночам, и нарушения структуры сна. Наиболее частым и стойким побочным эффектом антидепрессантов ИМАО является гипотензия. Среди осложнений, возникающих при лечении ингибиторами МАО, наибольшее внимание привлекли тяжелые реакции несовместимости с рядом лекарственных средств и пищевых продуктов, обусловленные следующими особенностями механизма действия антидепрессантов этой группы: 1. Угнетением МАО в центральных и периферических адренергических синапсах, вследствие чего вещества, обладающие адреномиметическим и адреносенсибилизирующим действием, вызывают чрезмерное возбуждение адренергических структур и соответствующие токсические эффекты; 2. Угнетением МАО стенок кишечника, что обусловливает беспрепятственное всасывание больших количеств предшественников биогенных аминов, содержащихся в ряде пищевых продуктов, и как следствие этого — усиление синтеза адреналина, норадреналина, дофамина и серотонина в нервной ткани; 3. Угнетение ферментативной (дезинтоксикационной) активности печени. Реакция несовместимости может возникнуть лишь в том случае, когда торможение МАО достигло значительной степени и в нервных окончаниях накопилось достаточно большое количество биогенных аминов. Поэтому токсические явления наступают при приеме противопоказанных препаратов у больных, которые до этого долго принимали ИМАО. Обритый порядок приема несовместимых лекарств не приводит к осложнениям. Чаще всего в литературе встречаются описания ре акций несовместимости, в том числе смертельных, при сочетании ИМАО с имипрамином. Это объясняется, во первых, распространенностью имипрамина, а также выраженностью у него стимулирующего компонента действия. Подобные же осложнения встречаются и при сочетании ИМАО с другими трициклическими антидепрессантами, однако у препаратов со значительным транквилизирующим компонентом действия (например, амитриптилин) они протекают несколько легче и наблюдаются относительно реже. Описаны также летальные исходы при сочетании ИМАО с препаратами группы морфина, особенно петидином (лидолом), анестезирующими средствами, симпатомиметиками, резерпином, бемегридом, а также пищевыми продуктами, содержащими большое количество тирамина: некоторыми сортами сыра, пивными дрожжами, молодым вином и др. Возникающие при этом реакции протекают с гипертермией, лейкоцитозом, судорогами, мышечными подергиваниями, гипертоническими кризами, затем возникает кома и очень части смерть. Для их купирования применяются альфа-адреноблокаторы, например фентоламин или всегда имеющийся в психиатрической больнице аминазин. Описанные реакции несовместимости могут возникнуть через 2-3 недели после окончания приема ИМАО. ИМАО также потенцируют и пролонгируют действие барбитуратов. Весьма серьезные осложнения описаны при длительном приеме ингибиторов МАО: у женщины, в течение 10 лет лечившейся обратимым ИМАО — паргилином по поводу гипертонии, развилась выраженная депрессия, а также резкое снижение памяти и интеллекта по типу пресенильной деменции. Эта психопатологическая симптоматика постепенно нарастала в продолжение 3 лет. После отмены паргилина все психические нарушения исчезли в течение нескольких недель. Как указывалось выше, отечественный антидепрессант пиразидол отличается по химическому строению и механизму действия от других аитидепрессантов: он относится к четырехциклическим соединениям и влияет на обмен моноаминов в мозге двояко — уменьшая их обратный захват из синаптической щели и необратимо тормозя МАО (Машковский М. Д., Андреева Н. И., 1975). Первые клинические испытания пиразидола установили его антидепрессивное действие (Авруцкий Г. Я., Громова В. В., Зайцев С. Г., 1975). Дальнейшие исследования (Барштейн Е. И., Точилов В. А., 1978) подтвердили эффективность пиразидола, который благодаря почти полному отсутствию побочных явлений особенно показан соматически ослабленным больным и лицам старческого возраста. По спектру терапевтической активности он все же должен быть отнесен к антидепрессантам с преобладающим стимулирующим компонентом действия, однако по сравнению с другими антидепрессантами такого типа пиразидол значительно реже приводит к обострению тревоги. По «силе» антидепрессивного эффекта пиразидол уступает трициклическим антидепрессантам, но незначительность побочных явлений позволяет существенно повышать дозы препарата, добиваясь терапевтического действия. За последние годы появились сообщения о ряде новых антидепрессантов различной химической структуры, однако они либо но имеют существенных преимуществ перед уже имеющимися препаратами, либо еще недостаточно изучены. СРАВНИТЕЛЬНАЯ ОЦЕНКА ТЕРАПЕВТИЧЕСКОГО ДЕЙСТВИЯ АНТИДЕПРЕССАНТОВ Как уже говорилось, несмотря на различия в химическом строении, среди антидепрессантов выявляются препараты, в действии которых преобладает стимулирующий компонент (например, ИМАО, дезметилимипрамин), и препараты с доминирующим транквилизирующим действием, к которым относятся инсидон, синекван, амитриптилин. Поскольку синдромальная группировка депрессивных состояний определяется в зачительной степени соотношением тревожного и собственно депрессивного (тоскливого) аффектов в их Структуре, становится понятной преимущественная эффективность ИМАО при анергнческой депрессии, а синеквана — при тревожно. Подтверждением этого служат приведенный ниже результаты лечения антидепрессантами 302 больных. Дана сравнительная оценка этих препаратов при 3 основных синдромах в рамках эндогенной депрессии (МДП). Испытываемые препараты использовались в оптимальной для данного больного дозе, так что дозы варьировали в широком диапазоне и подбирались индивидуально для каждого больного Дозы амитриптилина и имипрамина (мелипрамина составляли от 75 до 450 мг в день, в среднем 200 250 мг; анафранила — до 450 внутрь (средняя доза 200 мг) и внутривенно — 50-100 мг; синеквана 150-450 мг, чаще 300-450 мг; новерила — 240 960 мг, чаще 400-560 мг; ниамида — внутрь 300 400 мг, внутривенно (капельно) -500-1000 мг; финелзина — 40-100 мг, в среднем 60 мг внутрь. В качестве положительного эффекта учитывали случаи полного исчезновения депрессивной симптома тики или ее редукции более чем на1/3 (по специальной оценочной градуированной шкале). Меньшая степень улучшения расценивалась как «отсутствие эффекта» (табл. 12). ТАБЛИЦА №12
Далее используются фирменные названия применявшиеся в исследовании препаратов. Поскольку часть больных лечили мелипрамином, а часть тофранилом, то употребляется немеждународное название — имипрамин. Наиболее сильным стимулирующим компонентом действия обладают ингибиторы МАО (ниамид и фенелзин), пертофран и поверил, т.е. эти препараты оказались наиболее эффективными при лечении больных с анергической депрессией. Промежуточное положение занимает имипрамин — его терапевтическое действие более выражено при меланхолическом синдроме, хотя и при анергической депрессии результаты терапии достаточно хорошие. Новерил не уступает имипрамину при меланхолическом синдроме и превосходит его при анегической депрессии, однако малоэффективен при тревожно-депрессивном синдроме. Поэтому он примыкает к промежуточной группе антидепрессантов. Анафранил также отнесен к этой группе, так как его терапевтическая эффективность достигает максимума при меланхолическом синдроме (вероятно, его сильное действие определяется и методом введения — применяемый в последнее время -капельным путем мелипрамин также в ряде случаев оказывает более мощное терапевтическое действие, чем при приеме внутрь или внутримышечном введении). Кроме того, анафранил достаточно эффективен и при тревожной депрессии. Амитриптилин, инсидон и синекван показаны при тревожно-депрессивном синдроме, хотя амитриптилин обладает выраженным действием и при меланхолическом. Обращает на себя внимание относительно низкая общая эффективность инсилона и синеквана. Это обусловлено тем, что, помимо соотношения определенных параметров действия, терапевтический эффект определяется также и абсолютной терапевтической активностью («силой») препарата. «Силу» терапевтического эффекта оценивали по максимальной тяжести депрессивной симптоматики (определенной в баллах по спиральной шкале), которая еще поддается терапевтическому воздействию исследуемым антидепрессантом. Разумеется, это исследование проводилось не на резистентных к терапии больных и при тех синдромах, которые хорошо поддаются лечению данным антидепрессантом. Результаты были получены в условных единицах (Условная единица представляет собой частное от деления суммы баллов, которыми оценивались 6 основных (градуированных) симптомов, на их количество, т.е. на 6.), и хотя они весьма грубы, с их помощью можно приблизительно сопоставить терапевтическую активность различных антидепрессантов. Трициклические антидепрессанты: имипрамин, анафранил, пертофран, амитриптилин — были эффективны у больных с тяжестью депрессивной симптоматики, не превышающей 2,0-2,3 усл. ед. (анафранил был несколько «сильнее» 3 других препаратов, но эти различия не были статистически достоверны). Ингибиторы МАО: фенелзин и ниамид — уступали антидепрессантам группы имипрамина — их «сила» была до 1,8 ул. ед., в то время как «сила» доксепина составляла 1,4 усл. ед., а инсидона — 1,1 усл. ед. Важными характеристиками антидепрессантов являются скорость наступления терапевтического действия и избирательное воздействие препарата на отдельные компоненты депрессивного синдрома. Этими параметрами терапевтического действия приходится руководствоваться и при выборе того или иного препарата, и при определении тактики лечения. Например, если действие антидепрессанта начинает проявляться с неполитического эффекта, то при прочих равных условиях ему следует отдать предпочтение при лечении больного с выраженными суицидными тенденциями, и наоборот, если антидепрессант обостряет в первые дни лечения тревогу, то его можно давать таким больным либо только в условиях больницы, либо в сочетании с сильными анксиолитиками. Для более точной характеристики особенностей терапевтического действия антидепрессаптов была прослежена динамика отдельных симптомов и тяжести депрессивной симптоматики в целом при лечении отдельными препаратами. С этой целью степень проявления 6 основных симптомов депрессии и суммарная тяжесть симптоматики оценивались по шкале до начала терапии, а затем еженедельно в течение 4 недель. Баллы, которыми оценивались отдельные симптомы и общая тяжесть депрессии у каждого пациента, суммировались для всей группы больных, лечившихся исследуемым антидепрессантом. В качестве иллюстрации приводим графики динамодепрессивной симптоматики больных маниакально-депрессивным психозом в процессе лечения пертофраном, амитриптилином и синекваном (рис. 2, 3, 4).
Рис 2. Суммарная тяжесть отдельных симптомов (% от исходной) в процессе лечения пертофраном: 1 - тоска, 2 - снижение общительности, 3 - двигательная заторможенность, 4 - тревога, 5 - снижение интересов, 6 - идеи малоценности. Для того, чтобы иметь возможность сравнить действие антидепрессантов, испытывавшихся в различных численности группах больных, и для более удобного сопоставления динамики отдельных симптомов эти данные были представлены в процентах: исходная сумма баллов принималась за 100%, и показатели последующих еженедельных наблюдений вычислялись в процентах от исходной. Чтобы лучше выявить особенности терапевтического действия исследуемых антидепрессантов, учитывались показатели только успешно лечившихся больных, так как при такой обработке в процессе лечения динамика отдельных симптомов прослеживается более четко. В графиках приводятся данные о динамике симптоматики у больных, положительно реагировавших на лечение тремя антидепрессантами. В них представлены «профили» антидепрессивного действия исследовавшихся препаратов. Сопоставление профилей показывает, что наибольшие различия между антидепрессантами являлись крайними представителями этой группы; имипрамин занимал промежуточное положение.
Рис 3. Суммарная тяжесть отдельных симптомов (% от исходной) в процессе лечения амитриптилином: 1 - тоска, 2 - снижение общительности, 3 - двигательная заторможенность, 4 - тревога, 5 - снижение интересов, 6 - идеи малоценности. Относительная динамика других симптомов менее закономерна. Терапевтическое действие большинства антидепрессантов весьма быстро сказывалось на моторной заторможенности: для препарата с сильным стимулирующим компонентом действия — пертофрана — двигательная активность нормализуется относительно быстрее, чем настроение и тревога. Однако и для антидепрессантов с выраженным транквилизирующим и слабым стимулирующим действием — инсидона и синеквана — моторная заторможенность уменьшилась в более быстром темпе, чем остальные симптомы депрессии, исключая тревогу. В этом отношении интересна динамика симптомов лечении анафранилом: редукция тревоги и двигательной заторможенности шла с приблизительно одинаковой скоростью, значительно опережая регресс основных симптомов. Таким образом, между противотревожным и растормаживающим моторику эффектами антидепрессантов нет обратной зависимости.
Рис. 4. Суммарная тяжесть отдельных симптомов (в % к исходной) в процессе успешной терапии синекваном: тоска; 2 -снижение общительности; 3 -двигательная заторможенность; 4 -тревога; 5 -снижение интересов; 6 -идеи малоценности. Темпы восстановления общительности и интересов были средними по сравнению с регрессом других симптомов. Наиболее равномерной была редукция всех компонентов депрессии при лечении амитриптилином. В этом отношении его можно рассматривать как наиболее «типичный» антидепрессант. Наоборот, крайние представители ряда антидепрессантов, граничащие с чистыми стимуляторами или с седативными нейролептиками типа левомепромазина (тизерцин) или хлорпротиксена, более избирательно воздействовали на отдельные компоненты депрессивного синдрома: первые — на сниженное настроение и психомоторную заторможенность, вторые — на тревогу. Характерными для разных групп антидепрессантов являются не только динамика симптоматики при улучшении состояния больных, но также и ее изменения в случае безуспешной терапии. Так, при безуспешной терапии амитриптилином обычно не наступает обострения депрессии и общая тяжесть симптоматики даже несколько снижается, главным образом вследствие уменьшения тревоги и некоторого увеличения общительности. В группе больных не реагировавших положительно на лечение новерилом, отмечалось утяжеление симптоматики, в основном за счет резкого усиления тревоги, а также обострения идей виновности. Глубина депрессивного настроения существенно не изменялась, двигательная активность повышалась, возможно вторично, как результат нарастания тревоги. В группе больных, безрезультатно лечившихся новерилом, пертофраном и имипрамином, к концу 4-й недели уровень тревоги повысился на 70-90%. Фенелзин, который по всем остальным показателям относился к преимущественно стимулирующим антидепрессантам в сходной группе больных, тревогу усиливал незначительно (на 3%). В группах больных, не поправившихся в результате терапии амитриптилином, инсидоном и синекваном, исходный уровень тревоги снижался на 10-20%. Таким образом, антидепрессанты с преимущественно стимулирующим действием отличались от антидепрессантов с преобладающим транквилизирующим эффектом тем, что первые чаще обостряли депрессивную симптоматику, главным образом за счет тревоги, а в то время как последние в этом случае не вызывали утяжеления депрессии и даже несколько смягчали тревогу. Все приведенные данные (собственные и литературные) подтверждают, что при лечении анергической депрессии эффективными были антидепрессанты из группы ингибиторов МАО — фенелзин и ниамид (а также другие ингибиторы МАО — ипразид, трансамин, марилан). Из трициклических антидепрессантов лучшие результаты получены при применении пертофрана и новерила. При отсутствии других трициклических антидепрессантов и противопоказаниях к применению ингибиторов МАО, о чем было подробно сказано ранее, показано лечение имипрамином (однако в относительно небольших дозах — 75-150 мг в день). Иногда удавалось добиться положительных результатов при сочетании небольших доз имипрамина с хлорацизином 30-45 мг в день).
Рис. 5. Преимущественная эффективность антидепрессантов при различных синдромах эндогенной депрессии: 1 -стимулирующий эффект; 2 -транквилизирующий эффект При меланхолическом синдроме препаратами выбора являются имипрамин и анафранил, причем их капельное введение позволяет добиться терапевтического эффекта в более тяжелых случаях. При лечении тревожно-депрессивных состояний, в зависимости от степени тревоги, показаны амитриптилин синекван или инсидон. При сильной тревоге с ажитацией эти антидепрессанты приходится сочетать с нейролептиками — тизерцином, хлорпротиксеном или меллерилом и таким транквилизатором, как феназепам. В случаях крайней тревоги с резкой ажитацией тизерцин, хлорпротиксен, меллерил или фепазепам применяют в чистом виде и лишь после купирования тревоги к ним добавляют один из антидепрессантов. Схематически выбор антидепрессантов в зависимости от симптоматики депрессивного состояния представлен на рис. 5. На нижнем треугольнике схематически представлено изменение основных симптомов депрессии по мире нарастания удельного веса тревоги и напряжении в структуре синдрома. Эти симптомы распределены по 3 депрессивным синдромам: анергической депрессии, меланхолическому и тревожно-депрессивному. Наверху расположены исследовавшиеся нами антидепрессанты, причем соотношение стимулирующего и транквилизирующего компонентов действия каждого из них схематически представлено соотношением чистой и заштрихованной частей. Препараты расположены таким образом, что слева направо происходит увеличение удельного веса транквилизирующего компонента их действия. Помещенный слева экспериментальный шведский препарат Lu-3010, по существу, оказался не антидепрессантом, а стимулятором, поэтому его характеристика не была дана ранее. Расположенный справа хлорпротиксен также не является антидепрессантом, а относится к нейролептикам с преобладающим седативным эффектом. Сходными показаниями обладает тизерцин. На рис. 5 представлена область показаний каждого из препаратов. Использование их вне очерченных границ, как правило, оказывается малоэффективным, причем когда какой-либо препарат назначается в области, расположенной справа от зоны его показании, он может вызвать обострение тревоги, слева — чрезмерное угнетение, сонливость, вялость. Таким образом, по соотношению стимулирующего и транквилизирующего компонентов действия современные антидепрессанты могут быть расположены в закономерный ряд, причем препараты, расположенные в его начале, эффективны при анергической депрессии, в середине — при меланхолическом («простом депрессивном») синдроме, а далее — при тревожной депрессии. Препараты с преобладающим стимулирующим эффектом чаще обостряют симптоматику, главным образом за счет тревоги, в большей степени действуют по принципу «все или ничего», т.е. либо дают относительно быстрое и полное улучшение, либо оказываются полностью неэффективными и даже обостряю) симптоматику. Наоборот, препараты с преобладающим транквилизирующим компонентом редко дают обострение симптоматики и, как правило, всегда ее несколько смягчают за счет тревоги даже в тех случаях, где в дальнейшем не удается достигнуть существенного улучшения. Терапевтическое действие этих антидепрессантов развивается медленнее, и при их приме-нении несколько чаще отмечается неполное улучшение. Следует отметить, что препараты с сильным стимулирующим эффектом чаще вызывают соматические и вегетативные побочные явления и осложнения. Антидепрессанты с сильным стимулирующим компонентом действия чаще вызывают переход депрессии в манию. Так, возникновение мании в первые 4 недели лечения наблюдалось в 26,4% при лечении пертофраном и ниамидом, в 13,6% — анафранилом, в 11,1% — новерилом, в 10,5% — имипрамином, в 7,4% — фенелзином, в 3,9% — амитриптилином и ни в одном случае при применении инсидона, синеквана и траусабуна. На частоту возникновения мании влиял также и способ ведения препарата: при внутривенном введении (ниамид, анафранил и частично имипрамин) мании отмечались чаще, чем и объясняется неполное совпадение приведенной выше последовательности с распределением антидепрессантов на рис. 5. ВЫБОР ТЕРАПИИ И ЛЕЧЕБНАЯ ТАКТИКА Главным критерием для выбора того или иного препарата является синдромологическая характеристика депрессивного состояния. Как указывалось выше и представлено на рис. 5, при энергической депрессии показаны пертофран, новерил, пиразидол, имипрамин (мелипрамин), ингибиторы МАО: ниамид (нуредал), трансамин и др., при классическом меланхолическом синдроме — имипрамин, анафранил, при тревожно-депрессивном — амитриптилин и траусабун, при более сильной тревоге — тримепрамин (сапилент), синекван, инсидон. Однако, помимо этого общего положения, при выборе метода лечения приходится учитывать ряд факторов: тяжесть депрессии, этап депрессивной фазы, особенности течения заболевания, продолжительность депрессивного приступа, соматическое состояние и возраст больного, нозологическую принадлежность депрессии, условия, в которых будет проводиться лечение (больница, дневной стационар, диспансер), степенью суицидального риска. При среднетяжелой и тяжелой депрессии у соматически здоровых больных молодого и среднего возраста, находящихся в стационаре, терапию антидепрессантами мы обычно начинаем с относительно больших доз (для трициклических препаратов: имипрамина, амитриптилина и др. — уже в первую неделю не менее 200-250 мг в сутки, причем часть дозы желательно вводить парентерально). Наращивание доз проводится по возможности быстро — за 3-5 дней, причем начальная доза составляет 100-150 мг. Такая тактика позволяет сократить время до наступления отчетливого улучшения, а именно этот промежуточный период весьма опасен в отношении суицидных попыток. Кроме того, значительная часть больных с достаточно тяжелой эндогенной депрессией слабо реагируют на дозы трициклических антидепрессантов менее 150 мг. Безусловно, есть больные, у которых положительный эффект можно получить при приеме 100-150 мг, однако в том случае, если заранее не известна реакция больного на антидепрессанты, лучше начинать с больших доз, так как использование недостаточного количества лекарства влечет за собой ряд нежелательных последствий: затягиваются сроки терапии, создаются условия для привыкания к препарату; кроме того, больной теряет веру в успешность лечения и во врача, что также увеличивает риск суицида и затрудняет контакт с больным. Прием антидепрессантов лучше распределять равномерно в течение суток, причем последняя доза может быть назначена поздно вечером. Возможное ухудшение сна обычно купируется снотворными средства-ми (хлорпротиксен, тизерцин или производные бензодиазепина), и, кроме того, оно наблюдается далеко не всегда, а при лечении амитриптилином встречается крайне редко. Равномерный прием антидепрессантов обеспечивает более стабильный уровень этих препаратов в крови, от чего в значительной степени зависит эффективность лечения. Кроме того, вечерний прием смягчает обычное усиление депрессивной симптоматики в утренние часы. Исходя из этого некоторые авторы рекомендуют давать вечером большую дозу, чем в остальные часы. У амбулаторных больных необходимо добиваться того, чтобы первая доза принималась по возможности раньше — до 9 часов. Как известно, современные антидепрессанты не обрывают фазу, а лишь купируют симптоматику. Несвоевременная отмена препаратов приводит к возобновлению депрессии, а иногда к удлинению приступа. Поэтому отменять лекарства следует крайне осторожно. Снижение доз мы начинаем лишь после достижения полного терапевтического эффекта, и оно проводится постепенно: обычно доза уменьшается через каждые 4-5 суток на 25-50 мг, причем последующее снижение осуществляется лишь при условии, что после предыдущего уменьшения не наступило ухудшения. При преждевременной отмене ухудшение обычно наступает на 4-5-й день. В этом случае дозу необходимо вновь повысить, причем не до предыдущей, а больше. Например, если снижение проводилось по 50 мг, то дозу препарата после наступления ухудшения следует повысить на 100 мг. Быстрая отмена показана лишь при переходе в манию или при полной уверенности, что наступила спонтанная интермиссия, что возможно у больных со стереотипными депрессивными фазами. У ослабленных и соматически больных, у лиц пожилого возраста, а также в амбулаторных условиях наращивание доз обычно производится медленнее и осторожнее. При выборе препарата больным с интенсивными суицидными тенденциями и женщинам, у которых депрессия наступила после родов или в период климакса и у которых существует вероятность обострения тревоги, следует предпочесть антидепрессант с более выраженным транквилизирующим компонентом действия по сравнению с тем, который обычно назначается, исходя только из психопатологического статуса данного больного. Например, при напряженном меланхолическом синдроме у больной с послеродовой депрессией лучше назначить не имипрамин, а амитриптилин либо сочетать имипрамин с хлорпротиксеном или тизирцином. В ряде случаев подобный «сдвиг» при выборе антидепрессанта и сторону большего транквилизирующего действия приходится делать и при лечении больных в амбулаторных условиях. В дебюте депрессии, в период нарастания симптоматики более показаны препараты с выраженным транквилизирующим компонентом действия, так как антидепрессанты с сильным стимулирующим эффектом могут привести к обострению депрессии. Наоборот, во второй половине фазы иногда лучшие результаты получаются при применении антидепрессантов с более значительным стимулирующим компонентом. У больных биполярным МДП, особенно при непрерывном циркулярном течении или при сдвоенных фазах, назначение антидепрессантов с сильным стимулирующим эффектом или внутривенное введение больших доз препаратов могут привести к возникновению мании. Поэтому, если у данного больного мания наступает остро и сразу достигает тяжелой степени, лечение лучше проводить антидепрессантами с относительно сильным транквилизирующим действием. В не которых случаях у больных с резкой сменой фаз после появления первых отчетливых признаков улучшения можно начать профилактическую терапию солями лития, хотя, как правило, в период депрессии литий назначать нежелательно. Как указывалось выше, терапия начинается сразу с больших доз трициклических антидепрессантов, а при тяжелой депрессии — до 300-350 мг в сутки. Часть дозы (100-150 мг) желательно вводить парентерально, причем наиболее эффективно капельное введение лекарства. При этом методе антидепрессанты, например мелипрамин, реже вызывают обострения тревоги. чем при приеме внутрь в той же дозе. Возможно, это объясняется тем, что, минуя портальную систему и печень и сразу попадая в кровь, трициклические антидепрессанты в меньшей степени подвергаются демитилированию, а именно монометильные метаболиты обладают более выраженным стимулирующим действием. При крайне тяжелой и мучительной депрессии со стойкими и интенсивными суицидными мыслями или попытками можно сразу начать лечение с ЭСТ. В настоящее время показания к ЭСТ значительно сужены, и ее обычно применяют лишь в тех случаях, когда достаточно длительная медикаментозная терапия оказалась безрезультатной. Однако предубеждение против ЭСТ базируется на опыте 20-30-летней давности и недостаточно обосновано. Частота осложнений при ЭСТ тем меньше, чем чаще ого применяют в данной клинике, т.е. чем больше опыт. Введение миорелаксантов почти полностью сняло опасность вывихов и переломов, а разрабатываемая методика унилатеральной ЭСТ уменьшает степень и продолжительность нарушений памяти (Николаенко Н. Н., 1978). Страх некоторых больных перед ЭСТ, также ограничивающий широкое применение этого метода, снижается внутривенным введением быстродействующих наркотиков, например сомбревина. Методика ЭСТ хорошо известна. Следует лишь отметить, что в начале лечения сеансы лучше проводить ежедневно, а по мере наступления терапевтического эффекта — через 1 -2 дня. На курс, даже при хороших результатах, необходимо не менее 5-6 судорожных припадков, причем после исчезновения депрессивной симптоматики для закрепления эффекта требуется 1-2 дополнительных припадка. После достижения полной ремиссии больного надо держать в стационаре не менее 2 недель, чтобы избежать риска рецидива в амбулаторных условиях. При анергической депрессии, неглубоком меланхолическом синдроме, а также в случаях резистентности к трициклическим антидепрессантам эффективно используются ингибиторы МАО. В СССР относительно широко применяется лишь один из препаратов этой группы — ниаламид (ниамид, нуредал). При назначении ИМАО приходится учитывать и их отрицательные стороны: в том случае, если лечение окажется безрезультатным, из-за угрозы несовместимости нельзя применять другие антидепрессанты в течение 2-3 недель, так что больной должен либо остаться практически без лечения (обычно в этот период назначают транквилизаторы, хлорпротиксен, тизерцин или меллерил, либо перейти к ЭСТ. Кроме того, из-за гепатотоксического действия ИМАО их не следует назначать больным, перенесшим гепатит, а перед началом терапии надо исследовать функцию печени (печеночную трансаминазу и т. п.). В некоторых зарубежных клиниках больным, амбулаторно получающим лечение ингибиторами МАО, дают для постоянного ношения карточку с указанием тех препаратов, которые им противопоказаны. И в случае оказания скорой медицинской помощи, и при посещении врача по поводу соматических заболеваний эта карточка позволяет избегнуть назначения не совместимых с ИМАО лекарств. При использовании ИМАО мы даем больным на руки список противопоказанных им лекарств. Соблюдение этих предосторожностей делает лечение ИМАО безопасным, серьезные осложнения наблюдаются не чаще, чем при терапии другими антидепрессантами. Обычные дозы ниамида составляют 150-300 мг в день внутрь, большие дозы оказывают гепатотоксическое действие. Однако при парентеральном введении дозы ниамида могут повышаться до 500-1000 мг, так как в этом случае препарат минует портальную систему и значительно меньше воздействует на клетки печени. Если ИМАО приходится назначать больные с тревожной депрессией (например, при резистентности к трициклическим антидепрессантам или при аллергической реакции на препараты этой группы), их сочетают с нейролептиками, обычно меллерилом, хлорпротиксеном, тизерцином. Однако такая комбинация может усиливать свойственное ИМАО гипотензивное действие и соответственно создать угрозу коллапса. Сочетание ИМАО с обычными транквилизаторами: седуксеном, элениумом и др. — при выраженной тревоге малоэффективно и также может привести к нарастанию гипотензии или к возникновению симптома «ватных ног». У больных с четко очерченными приступами тревожной депрессии при комбинированной терапии антидепрессантами (ИМАО или трициклическими) с. нейролептиками в начале приступа обычно назначаются большие дозы нейролептика, а затем их постепенно снижают, в то время как дозы антидепрессантов еще остаются прежними или даже повышаются. Таким образом, при медикаментозной терапии депрессий дозы антидепрессантов должны быстро увеличиваться и медленно снижаться, и в начале приступа противотревожный аффект лекарств должен быть максимальным. Разумеется, эти правила приложимы не ко всем случаям, но чаще всего их соблюдение обеспечивает лучшие результаты. Нередко широкое и успешное применение антидепрессантов оттесняет на второй план другие мероприятия, связанные с уходом за больным. Значительной части больных депрессией необходимо назначать послабляющие пли слабительные средства, а при их неэффективности — клизму. Стойкие отказы от пищи, при которых приходилось применять искусственное кормление, в последние годы встречаются редко, но все же иногда возникает необходимость в использования амитал-кофеинового растормаживания, чтобы накормить больного. Поскольку при депрессии аппетит больше всего снижен в первую половину дня, нередко приходится менять режим питания, так как иногда более или менее полноценно накормить таких больных удается только вечером. ТРУДНОСТИ И ОШИБКИ ПРИ ТЕРАПИИ ДЕПРЕССИВНЫХ СОСТОЯНИЙ; ЛЕЧЕНИЕ ЗАМАСКИРОВАННЫХ, ЗАТЯЖНЫХ И РЕЗИСТЕНТНЫХ ДЕПРЕССИЙ Если в первые годы «психофармакологической эры» внимание психиатров было обращено на успехи терапии антидепрессантами, то в последующем его стали фиксировать на некурабельных и малокурабельных случаях. Однако, как указывают Н. Lehmann (1977b) и другие исследователи, большая часть резистентных к терапии депрессий является результатом ошибок, допущенных при их лечении. Схематически случаи безуспешной антидепрессивной терапии можно разделить на 5 групп: 1) отсутствие положительного эффекта обусловлено неправильной методикой лечения; 2) трудностями в распознавании и квалификации депрессивного состояния (например, так называемые «замаскированные» депрессии) и как результат — неправильным выбором препарата; 3) присущей данному психопатологическому синдрому низкой курабельностью (депрессивно-деперсонализационный синдром); 4) большой спонтанной длительностью депрессивной фазы; 5) истинной резистентностью ко всем или отдельным видам терапии, присущей данному больному вне зависимости от психопатологической характеристики депрессивного состояния. Мы но приводим различные определения понятия «терапевтической резистентности», поскольку они весьма разноречивы. В нашей работе мы считали резистентными те депрессивные состояния, которые не под давались терапии, адекватной данному синдрому и применяемой достаточное время в максимальных дозах. Чаще резистентность бывает к одной группе препаратов (например, к трициклическим антидепрессантам) или одному методу лечения и крайне редко ко всем видам антидепрессивной терапии. Низкая курабелыюсть может быть вызвана тем, что для данного состояния еще но разработана адекватная терапии, или затяжным точенном депрессии, поскольку известно, что существующие в настоящее время антидепрессанты не обрывают фазу, а лишь купируют симптома-тику. Поэтому говорить в этом случае о резистентной к терапии депрессии неверно, так как это значит требовать от данных видов терапии тех свойств, которыми они не обладают. Однако иногда в процессе длительного лечения затяжной депрессии у больного может выработаться резистентность к определенным препаратам или методам. Перечисляя наиболее часто встречающиеся ошибки и неточности при лечении депрессивных состоянии, мы не останавливаемся на случаях неправильного выбора препарата. По даже при назначении адекватней» лекарства результаты лечения могут быть негативными, если дозы антидепрессанта слитком малы или если их наращивание производится слишком медленно, так как в этих случаях привыкание к данному препарату (или данным дозам этого препарата) происходит быстрее, чем наступает выраженный терапевтический эффект. Снизить эффективность терапии может и неправильное распределение приема лекарства в течение суток, особенно если его инактивации в организме происходит относительно быстро. Так, назначение трициклических антидепрессантов только в первую половину дня может принести к тому, что в течение нескольких часов (вечерних и ночных) концентрация препарата в крови окажется ниже минимального стабильного уровня, требующегося для проявления терапевтического действия. Другая ошибка — слишком быстрая смена препаратов при отсутствии быстрого терапевтического эффекта. Опыт показывает, что прежде, чем отменять данный препарат (разумеется, если он показан по психопатологической симптоматике и не вызывает серьезных побочных явлений), необходимо довести его дозы до максимальных или изменить способ введения, причем, как указывалось выше, наиболее эффективно капельное введение. Лишь в том случае, если в течение 4- 5 недель при достаточной дозе но удается добиться существенного улучшения, отмена препарата представляется обоснованной. Иногда при отсутствии улучшения вместо наращивания дозы добавляют другой препарат, который не обладает синергизмом с первым. В результате создается комбинации из 3-4 лекарств, каждое из которых применяется в недостаточных дозах. Вообще использование сразу сочетания нескольких препаратов по типу стандартных смесей имеет много отрицательных сторон: не все лекарства оказываются необходимыми, и существует вероятность, что часть из них больной принимает напрасно, увеличивается возможность побочных явлений и реакций несовместимости, и, кроме того, врач лишает себя возможности приобретать опыт в отношении действия отдельных лекарств. Разумеется, сочетание психотропных средств иногда необходимо; например, при интенсивной тревожной депрессии с самого начала можно комбинировать антидепрессанты с нейролептиками, можно также в процессе лечения попытаться усилить или скорригировать эффект одного препарата добавлением другого, но каждый раз такое сочетание должно быть индивидуальным и продуманным. В отношении некоторых нежелательных комбинаций обнаруживается непонятное пристрастие. Так, нередко тремор, возникающий при лечении антидепрессантами, пытаются купировать добавлением циклодола, хотя при этой форме тремора он не эффективен, а его сочетание с антидепрессантами часто приводит к весьма серьезным осложнениям: состояниям спутанности, обычно и ночное время, в результате чего иногда приходится прекращать медикаментозную терапию, а это влечет за собой обострение симптоматики. Ошибки в выборе препарата могут быть обусловлены неправильной квалификацией депрессивного синдрома, его структуры. Наиболее часто такие ошибки встречаются при лечении больных с «атипичными» синдромами: депрессивно-обсессивным, депрессивно-ипохондрическим, «замаскированной» депрессией, при которой преобладают нейровегетативные и соматические проявления, а также некоторыми формами тревожной депрессии. Как указывалось выше, выделение депрессивно-обсессивного или депрессивно-ипохондрического синдромов нам представляется нецелесообразным, поскольку под это определение попадают состояния с совершенно различной аффективной структурой. Среди постоянно наблюдаемой группы больных МДП у 16 (12 мужчин и 4 женщины) депрессивные фазы характеризовались депрессивно-обсессивным синдромом, что составляет приблизительно 5%. Депрессивно-обсессивные (или депрессивно-фобические) состояния чаще всего отмечались у больных с относительно неглубокой депрессией и с обсессивными чертами в преморбиде, которые сочетались с тревожной мнительностью. Наблюдение 2. Типичным представителем этой группы является больной К., 25 лет. Наследственность психическими заболеваниями не отягощена, мать — крайне тревожная, мнительная. В детстве перенес тяжелый туберкулез легких. По характеру застенчивый, замкнутый, не уверенный в себе, тревожный, мнительный. С 15 лет эти черты заострились, появилась склонность к самоанализу, постоянным сомнениям, обдумыванию каждого мелкого поступка. Весной состояние ухудшалось. В одно из ухудшений, в возрасте 24 лет, был госпитализирован в областную больницу по месту жительства, где безуспешно лечился аминазином, малыми дозами мелипрамина. В больнице совершил суицидную попытку. В дальнейшем был помещен и Ленинградский психоневрологический институт им. В. М. Бехтерева. При поступлении — мимика страдальческая, несколько растерянная; во время беседы сжимает руками голову, трет виски, лоб, стонет, охает, хватает врача за руки, умоляет спасти его, повторяет, что он «человек конченный», что до следующего дня он не доживет. Во время беседы часто сбивается, возвращается к сказанному, по многу раз повторяет одни и те же слова, фразы, детали своего рассказа. Эти повторения объясняет тем, что у него «в голове что-то ужасное» и он но может описать свое состояние врачу, который не поймет ого и, следовательно, не сможет помочь. Заявляет, что жить он не хочет, жизнь потеряла смысл и интерес. Настроение снижено, особенно утром. Будущее кажется мрачным. Все встречающиеся люди вызывают чувство острой зависти, представляются счастливыми, то заставляет его еще сильнее ощущать свои страдания. Основным и самым мучительным проявлением своего заболевания считает навязчивые сомнения: из-за них он временами даже не может говорить, так как каждое сказанное им слово кажется неискренним, не отражающим «настоящей мысли». Но и мысль о том, что он «неискренен и лицемерен», также является «неискренней и лицемерной», поскольку этим он хочет казаться лучше и честнее, чем он есть на самом деле, но и эта мысль лицемерна по той же причине — и так до бесконечности. Не может читать, так как сомневается в правильности понимания каждого слова, каждой буквы и подолгу перебирает в уме их возможное значение. Понимает, что эти сомнения — результат болезни, пытается бороться с ними, но безуспешно. К вечеру навязчивые сомнения и тревога выражены наиболее сильно. Больному было начато лечение ингибитором МАО — фенелзином. Постепенно улучшилось настроение и уменьшилась тревога, навязчивости стали менее интенсивными и мучительными. Через 2 месяца настроение нормализовалось, и дозы фенелзина начали постепенно снижать. Однако через неделю вновь появилась тревога, снизилось настроение, усилились навязчивые переживания. Это указывает на то, что ремиссия была лекарственной, а не спонтанной. После повышения дозы препарата состояние полностью нормализовалось, и через месяц больной был выписан. В дальнейшем возникла гипомания, во время которой навязчивости полностью исчезли. При первой госпитализации состояние больного К. было расценено как тяжелое тревожно-депрессивно-обсессивное, в связи с чем и назначили лечение нейролептиком в сочетании с небольшими дозами антидепрессанта. Однако эта терапия лишь усугубила депрессию. Успешное применение ингибитора МАО показывает, что в аффективной структуре синдрома тревога не играла существенной роли, а ее внешние проявления были обусловлены характерологическими особенностями больного. Действительно, в ремиссии он но каждому незначительному поводу проявлял чрезмерное беспокойство, тревогу. В данном случае депрессия распознается по достаточно выраженному снижению настроения, особенно по утрам, наличию некоторых соматических признаков (запоры, снижение аппетита), а также обострению тревоги и навязчивостей вечером. Эти признаки позволяют отграничить депрессию от декомпенсации психастениями невроза навязчивых состояний, для купирования которого необходимы транквилизаторы. Иногда массивная обсессивная симптоматика возникает в дебюте некоторых психозов (инволюционного, соматогенного и др.), причем аффективным стержнем приступа в этих случаях является тревога: больные напряжены, навязчивости аффективно насыщены, проявляются в виде фобий, иногда сочетающихся с идеями отношения, особого значения и др. При неглубокой депрессии возможно заострение других особенностей личности больного, которые «маскируют» депрессивную симптоматику (тревожность, мнительность, ипохондричность, истерические черты др.). Очевидно, именно на основании опыта лечения подобных больных группа английских психиатров (West Е., Dally Р., 1959; Sargant W., 1963, и др) сообщила об эффективности ИМАО при атипичных. депрессиях, характеризующихся навязчивостями, соматическими жалобами, астенией, анергией, ангедонией, раздражительностью и т. п. Весьма часто трудности в выборе препарата возникают в тех случаях, где депрессия «маскируется» соматическими нарушениями и жалобами. Если в психопатологической картине на первом месте стоит тревога, имеются разнообразные ощущения, связанные с резким повышением мышечного тонуса и симпатикотонией (например, тахикардия, гипертензия, сжимающие боли за грудиной и др.), диагноз депрессии (даже «ларвированной») представляется более чем сомни тельным, а назначение антидепрессантов может резко обострить симптоматику: психопатологическую — вплоть до возникновения острого чувственного бреда или синдрома Котара и соматическую — до сердечно сосудистых кризов. Нередко после такого обострения вызванного неадекватным выбором лечения, наступает длительное деперсонализационное или депрессивно-деперсонализационное состояние, крайне плохо поддающееся терапии. Однако иногда сходная клиническая картина бывает и у больных с истинной тревожной депрессией. Как правило, тщательное наблюдение позволяет выявить у них отчетливое снижение настроения с характерными суточными колебаниями. В этих случаях большую помощь для дифференциальной диагностики может оказать диазепамовый тест: у больных депрессией после введения седуксена, несмотря на облегчение и снятие напряжения, смягчение или исчезновение соматических жалоб, более отчетливо выявляется сниженное настроение, в то время как при доминировании тревоги наблюдается полное или частичное снятие всей симптоматики. Лечение больных тревожной депрессией с интенсивными соматическими жалобами лучше начинать с анксиолитиков, особенно с феназепама, в дальнейшем сочетая их с амитриптилином. Лишь при выраженном болевом синдроме в структуре меланхолического состояния эффективным оказывается мелипрамин (обычно в больших дозах или капельно). У таких больных тоска выражена достаточно четко, а локализация болей более или менее определенна, чаще в сердечной или эпигастральной областях. Очень часто разнообразные интенсивные и стойкие ипохондрические жалобы наблюдаются у больных с депрессивно-деперсонализационным синдромом, что затрудняет его распознавание и своевременное назначение адекватной терапии. К депрессивным синдромам, крайне устойчивым ко всем современным методам антидепрессивной терапии прежде всего относится депрессивно-деперсонализационный. Как будет показано в следующей главе, низкая курабельность присуща деперсонализации в рамках различных психических заболеваний. Кроме того приступы аффективных психозов, протекающие депрессивно-деперсонализационным синдромом, имеют как правило, затяжное течение, что само по себе создает предпосылки для возникновения истинной резистентности к антидепрессантам. Подробнее особенности лечения деперсонализации приведены в гл. 8. Как указывалось выше, затяжные депрессивные фазы лечатся плохо, поскольку антидепрессанты не обрывают приступ, а их длительное применение в конце гонцов приводит к привыканию к препарату и более быстрой его инактивации в организме. В том случае, если такая затяжная фаза характеризуется депрессивно-деперсонализационным синдромом, мишенью терапии прежде всего должна стать деперсонализация. При длительных депрессивных состояниях, протекающих с другими синдромами, приходится прибегать к смене препаратов после того, как терапевтическое действие одного из них начинает уменьшаться, a увеличение дозы перестает давать существенное улучшение. Чередование близких по строению трициклических антидепрессантов обычно малоэффективно, т. к. как возникает резистентность ко всей группе. Поэтому целесообразно использовать антидепрессанты, сущесственно отличающиеся химическим строением: напри мер, имипрамин заменяется новерилом, тот — пиразидолом, а затем ингибиторами МАО. Иногда эффективность применяемых трициклических антидепрессантов вновь повышается при добавлении к ним хлорцизина в дозе 45-75 мг в день, поскольку этот препарат замедляет метаболизирование некоторых других лекарств (Авакумов В. М. и Вихляев Ю. И., 197(;|. Очень часто значительные трудности возникает при лечении больных, депрессивные состояния которых ошибочно расцениваются как затяжные. У этих больных (чаще женщин пожилого возраста) до наступления депрессии отмечались выраженные проявления тревоги, которые обычно нарастают в период, предшествующий наступлению фазы, и продолжают оставаться (а иногда и усиливаться) после ее окончания. Поэтому свойственный данному больному преморбидный по отношению к эндогенной депрессии фон, который, по существу, является болезненным, квалифицируется врачом как продолжение приступа, и больного продолжают лечить антидепрессантами, вместо того чтобы перейти на противотревожную терапию транквилизаторами и другими анксиолитическими препаратами, а также сочетать их с психотерапией и реабилитационными мероприятиями. Неадекватное применение антидепрессантов, с одной стороны, приводит ко псе большему привыканию к ним, с другой, что еще важнее, усиливает тревогу и способствует декомпенсации больного, а при тяжелых обострениях — к возникновению тревожно-депрессивных и деперсонализационных состояний. Лишь четко разграничив собственно депрессивную фазу от свойственных данному больному психических нарушений в междепрессивных периодах, можно правильно оценить те максимальные сдвиги, на которые следует рассчитывать, используя антидепрессивную терапию, В противном случае слишком активное лечение приводит к обратным результатам: способствует утяжелению и хронизации депрессии и более быстрому наращиванию патологических изменений в межприступные периоды. Истинная и полная терапевтическая резистентность ко всем видам антидепрессивной терапии если и встречается, то крайне редко. Чаще наблюдается резистентность к отдельным группам антидепрессантов, обычно к трициклическим. Как показали В. Alexanderson, D. Price-Evans, F. Sjoquist (1969) и др., для получения терапевтического эффекта необходимо, чтобы содержание антидепрессантов в крови достигло определенного стабильного уровня, т.е. чтобы в течение суток их концентрация не опускалась ниже какого-то минимально допустимого предела. Если в организме больного инактивация препарата происходит с большой интенсивностью, то добиться минимальной стабильной концентрации бывает невозможно, и такие больные оказываются резистентными к терапии трициклическими антидепрессантами. В этих случаях даже высокие дозы антидепрессантов не только не оказывают терапевтического действия, но совсем или почти совсем не вызывают побочных эффектов. У некоторых больных крайне высокая активность инактивирующих ферментных систем печени обусловлена генетически, у других — она усиливается вследствие длительного приема барбитуратов и, вероятно, некоторых других лекарств (Alexanderson В., Price-Evans D., Sjoquist F., 1969). Именно поэтому плохо поддаются лечению трициклическими антидепрессантами больные эпилепсией, длительное время принимающие противосудорожные средства. Низкая терапевтическая чувствительность больных с чрезмерно продолжительными депрессиями или большим количеством фаз в прошлом, вероятно, частично обусловлена активацией этих ферментных систем под влиянием ранее проводившейся терапии. В дальнейшем полнились данные, что с плохим эффектом терапии нортриптилином коррелирует не только низкий, но и чрезмерно высокий уровень препарата в крови (Relationship between..., 1971), что возможно, связано с затруднением прохождения препарата через мембраны внутрь нейрона. Многочисленные методы, предназначенные для преодоления резистентности, все еще недостаточно эффективны. В ряде случаев приходится подбирать антидепрессанты с другой химической структурой и, и иным механизмом действия (вместо трициклических ИМАО). Иногда активность препарата резко повышается путем капельного введения, при котором лекарство попадает сразу в кровь, минуя портальную систему в печень, в которой в основном и происходит его инактивация. По нашим данным, у части больных весьма эффективно оказывается сочетание трициклических антидепрессантов с хлорацизином, как было указано выше. Описаны и другие способы комбинаты трициклических антидепрессантов с ударными дозами резерпина, с трийодтиронином и рядом других средств, однако эффективность всех этих методов невысока, в поэтому они не получили широкого распространения. Поскольку терапевтической резистентности посвящены специальные обзоры, мы не останавливаемся подробнее на этой проблеме. ЛЕЧЕНИЕ ДЕПРЕССИВНЫХ СОСТОЯНИИ ФЕНАЗЕПАМОМ Тревога играет значительную, иногда ведущую, роль в структуре тревожно-депрессивных состояний, особенно в дебюте некоторых аффективных психозов. Это подтверждается приведенными в гл. 4 результатами диазепамового теста. Однако как основной метод терапии психотических аффективных приступов транквилизаторы практически не применялись (Александровский Ю. А., 1976). Лишь, в самое последнее время появление новых транквилизаторов — производных бензодиазепина: лоразепама и феназепама, обладающих сильным анксиолитическим аффектом, значительно превосходящим действие таких «эталонных» транквилизаторов, как диазепам (седуксен) или хлордиазепоксид (элениум, либриум), сделано возможным их успешное использование в «большой психиатрии». Отечественный препарат феназепам был фармакологически изучен Ю. И. Вихляевым и Т. А. Ворониной (1978) в Институте фармакологии АМН СССР, причем по силе противотревожного действия он превосходил другие известные транквилизаторы. Исходя из этих данных феназепам был использован нами совместно с В. А. Точиловым для лечения психотических депрессивных состояний. Феназепам применялся в таблетках, чаще в суточных дозах 3-5 мг. Иногда для достижения и поддержания терапевтического эффекта было достаточно 1,5-1 мг, в редких случаях дозы превышали 10 мг (максимальная использованная доза составила 36 мг). обычно лечение начиналось с 0,5-1,5 мг в день, доза постепенно повышалась по 0,5-1 мг ежесуточно. При купировании тяжелых и острых состояний изредка приходилось начинать терапию с 3-5 мг в день. Опыт лечения феназепамом более 200 больных депрессией (МДП, инволюционная депрессия, шизофрения, органические заболевания головного мозга, реактивные психозы) показал, что лучшие результаты были получены при 3 показаниях: тревожно-депрессивные состояния, аффективно-бредовые приступы (точнее — тревожно-депроссивно-бредовые), особенно в их дебюте, и при деперсонализационном синдроме. Так, из 90 больных с тревожно-депрессивным синдромом полное исчезновение психопатологической симптоматики наступило у 43, т.е. почти в половине случаев, а значительное улучшение — у 25. Таким образом, положительный эффект был отмечен приблизительно у 3/4 лечившихся феназепамом больных. Лучшие результаты наблюдались в тех случаях, когда тревога отчетливо выступала на первый план. Помимо тревоги и отчетливо сниженного настроения, у таких больных часто отмечались неприятные ощущения в мышцах тела, конечностей, затылке к шее, сжатие и боль за грудиной, чувство жжения, чаще вдоль позвоночника, и т. д. Эти проявления обычно квалифицировались как сенестопатические. У больных нередко имелись элементы деперсонализации, сверхценные идеи: ипохондрические, отрывочные идеи особого значения, отношения, а также фобии. В большинстве это были женщины среднего и пожилого возраста (чаще от 30 до 55 лет) с чертами тревожной мнительности в преморбиде. Их нозологческая квалификация представляла существенны: трудности, и в разных медицинских учреждениях им ставили различные диагнозы: инволюционный психоз (или инволюционная меланхолия), вялотекущая шизофрения, атипичный МДП, соматогенный психоз и т. п. Чаще ставились два первых диагноза, хотя таких симптомов шизофрении, как аутизм, систематизированный бред, синдром Кандинского — Клерамбо, у этих больных не было. Терапевтический эффект наступал быстро, часто в первые дни и даже часы терапии. Прежде всего редуцировалась тревога, выравнивалось настроение, причем иногда наблюдалась эйфория. Весьма быстро исчезали деперсонализационные и сенестопатические явления, нормализовался сон. Затем дезактуализировались идеи отношения, особого значения и, наконец ипохондрические жалобы. В успешных случаях редукция симптоматики иногда завершалась в несколько дней. В дальнейшем для сохранения ремиссии часто требовалась поддерживающая терапия феназепамом или другими транквилизаторами (седуксен, элениум, тазепам). Часто при отсутствии феназепама и недостаточно стабильной ремиссии эти транквилизаторы приходилось комбинировать с меллерилом, хлопротиксеном или тизерцином. В тех случаях, когда отмечалась фазность течения, тоска была отчетливо выражена, имелись суточные колебания настроения, т.е. где диагноз «эндогенная депрессия» (МДП, инволюционная меланхолия) не вызывал сомнений, результаты лечения феназепамом были несколько хуже. У этих больных положительный эффект наблюдался приблизительно в 2/3 случаев, но полное исчезновение симптоматики наступило только у 1/3 больных. Часто после смягчения тревоги настроение оставалось несколько сниженным, больные жаловались на вялость, особенно по утрам, слабость, снижение интересов и работоспособности, хотя и не в такой мере, как до лечения феназепамом. У некоторых больных хороший эффект был получен при таком распределении препарата, когда вся или почти вся доза давалась на ночь. Таким образом, делалась попытка как бы восстановить циркадный ритм секреции кортикостероидов, как известно, нарушенный при эндогенной депрессии. Кроме того, отсутствие феназепама в утренние и дневные часы снижало побочные явления, мешавшие больным в повседневной деятельности. Лечение феназепамом больных с депрессивно-деперсонализационным синдромом описывается в гл. 6. При меланхолическом синдроме и при анергичекой депрессии феназепам лишь умеренно облегчал самочувствие приблизительно у 1/3 больных, снимая чувство напряжения. Описание эффекта феназепама у больных с аффективно-бредовыми приступами выходит за рамки книги. Можно лишь отметить, что раннее назначение препарата, в период нарастания тревоги и появления первых признаков острого чувственного бреда, у 20 из 10 больных или полностью купировало состояние, или привело к его значительному смягчению. Назначенный в дебюте приступа феназепам предотвращал также развитие тревожно-депрессивных и тревожно-депрессивно-деперсонализационных состояний. Его применение при эндогенной депрессии было особенно эффективным в тех случаях, когда наступлению депрессивной фазы предшествовал период нарастания тревоги и присущих ей соматовегетативных проявлений. В целом результаты лечения были тем лучше, чем на более раннем этапе развития депрессивной симптоматики оно было начато. Так как одной из главных задач психоневрологических диспансеров является раннее купирование психотических приступов и обострений, предотвращение госпитализации больных, можно полагать, что феназепам окажется особенно полезным средством в осуществлении этой цели. Побочные эффекты фепазепама были умеренными (миорелаксация, сонливость, вялость, легкое головокружение), что также облегчает его применение в амбулаторных условиях. Лишь при больших дозах у больных пожилого возраста и страдающих сосудистыми и органическими заболеваниями ЦНС феназепам вызывал состоянии спутанности. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 7 ДЕПРЕССИВНО-ДЕПЕРСОНАЛИЗАЦИОННЫЙ СИНДРОМ В РАМКАХ МАНИАКАЛЬНО-ДЕПРЕССИВНОГО ПСИХОЗА |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Выделение этого раздела в отдельную главу обусловлено следующими причинами: депрессивно-деперсонализационный синдром значительно хуже других депрессивных синдромов поддается терапии; его распознавание сопряжено с определенными трудностям!. и его относительно часто неправильно квалифицируют: ошибки и затруднения встречаются и при определение его нозологической принадлежности. Кроме того, в последние годы почти полностью отсутствуют специальные исследования депрессивно-деперсонализационных состояний. Как отмечалось выше, тщательное психопатологическое обследование больных с выраженным меланхолическим синдромом почти всегда обнаруживает у них элементы деперсонализация: anaesthesia dolorosa psychica, реже — соматопсихическую деперсонализацию (отсутствие чувства сна, голода, насыщения я т. д.). Поэтому к депрессивно-деперсонализационному синдрому мы относили только те случаи, когда деперсонализация (Подробное описание деперсонализационной симптома тики дано в гл. 8.) занимала ведущее место в психопатологической структуре депрессивного синдрома, вытесняя или, вернее, блокируя аффекты витальной тоски и тревоги, и проявлялась в виде аутопсихических и соматопсихических переживаний, а также в нарушении чувства времени. Ниже приводится история болезни такого больного. Наблюдение 3. Больной Л., 1899 года рождения. О случаях психических заболеваний с семье не знает, отец умер рано, Рос и развивался нормально. Окончил гимназию, финансовые курсы, работал бухгалтером. Дважды был женат. По характеру мягкий, общительный, веселый, но в то же время впечатлительный, мнительный, тревожный. В 13-летнем возрасте появились выделения из уретры; считал, что заболел гонореей, несколько месяцев находился в подавленном состоянии, возникали суицидные мысли. После этого в течение многих лет опасался последствий венерического заболевания. В детстве частые ангины, В 1945 г. было обнаружено повышение артериальное давление, в 1954-1957 гг. и в мае 1958 г. перенес инфаркты миокарда, в сентябре 1958 г. — динамическое нарушение мозгового кровообращения. Умер в 1965 г. после 4-го инфаркта миокарда. Первую выраженную депрессивную фазу перенес в 1945 г. в возрасте 46 лет после неприятностей на работе: будучи ревизором, не обнаружил крупного хищения в одном из инспектируемых учреждений. Появились бессонница, тревога, опасения, что его отдадут под суд, затем резко снизилось настроение. Заболевание характеризовалось тревожно-депрессивным синдромом с выраженным двигательным беспокойством, тоской, суицидными мыслями, явлениями ауто- и соматопсихической деперсонализации. Фаза продолжалась около 1,5 лет, окончилась после курса ЭСТ. После выписки вновь приступил к работе, чувствовал себя хорошо. Следующее депрессивное состояние возникло в мае — июне 1958 г. вслед за перенесенным в мае инфарктом миокарда. Вначале появились тревога и бессонница, затем — тоска, суицидные мысли; был госпитализирован. Состояние характеризовалось депрессивно-деперсонализационным синдромом: настроение было снижено, имелись тревога, массивные деперсонализационные переживания — потеря чувства привязанности к близким, снижение тактильной, болевой и обонятельной чувствительности, ощущение, что течение времени резко замедлилось. Медикаментозное лечение оказалось неэффективным. С января 1959 г. спонтанно наступило некоторое улучшение: появились суточные колебания настроения, уменьшились тоска и тревога. В мае начата ЭСТ (11 электрошоков), психопатологическая симптоматика исчезла полностью. После l,5 лет полноценной интермиссии в декабре 1960 г. наступила депрессивная фаза, аналогичная предыдущей по симптоматике и течению и продолжавшаяся 18 мес. С марта 1961 г. лечился тофранилом (до 575 мг в день), однако наступившее улучшение было незначительным, и в июне была начата ЭСТ. После 2 сеансов ЭСТ больной полностью поправился и был выписан домой. 1-2 недели после выписки находился в гипоманиакальном состоянии. Интермиссия продолжалась около l,5 лет. Последняя фаза началась в ноябре 1962 г. с тревоги, бессонницы. Затем резко снизилось настроение, появилась тоска, и быстро начали нарастать деперсонализационные явления. 25 января 1963 г. больной был госпитализирован. Психическое состояние: медлителен, мимика бедная, скорбная, речь несколько замедлена, голос глухой, плохо модулированный. Настроение отчетливо снижено, однако тоски но ощущает, так как «все чувства притупились, даже тоска и боль». Испытывает внутреннюю тревогу: «как будто что-то должно случиться, хотя сам знаю, что ничего не может быть хуже». Жалуется «на полную атрофию чувств», даже госпитализация его жены в онкологический институт не вызвала волнения, «утратились все человеческие привязанности». Весь мир как бы отдалился, воспринимается тусклым, бледным, «как будто бы через мутное стекло». Полностью утратились чувства сна, голода, насыщения, исчезли позывы на дефекацию и мочеиспускание. Не ощущает вкуса пищи и запахов. Нарушилось осязание: «между рукой и предметом появился изоляционный слой, предметы не осязаются, такая же прослойка существует и между ногой и полом»). Боль ощущается притупленно, «кожа как не своя, стягивает, как резиновая рубашка», «под кожей появились прокладки, тело стало деревянным, ничего но ощущает», «время остановилось», а сам он стал «бессмертным». Он понимает, что с точки зрения законов природы это кажется; нелепым, но это факт, и он «обречен на вечные муки». «Даже когда исчезнет земля и распадется солнечная система, я буду существовать и вечно мучиться». С грустной улыбкой говорит, что врачи подозревают у него депрессию, по ему даже смешно это слушать. У него «гонорея, мозга... гонококки наводнили весь мозг, и голова стала пустой, без чувств и мыслей, прокладки под кожей также состоят из гонококков, а все внутренности разъедены и давно исчезли». Этим объясняет отсутствие чувства насыщения («все проваливается в пустоту»), В января 1963 г. было начато лечение хлорацизином до 200 мг и день, затем в связи с отсутствием эффекта его начали постепенно заменять мелипрамином. В этот период, когда мелипрамин сочетался с хлорацизином, насту пило улучшение: к вечеру настроение стало менее подавленным, стал ощущать запахи, появилась частичная критика к идеям о «бессмертии». Однако в дальнейшем при лечении одним мелипрамином в больших дозах состояние вновь ухудши лось. От ЭСТ пришлось отказаться после 4 шоков из-за соматического состояния, а большие дозы ниамида (1000 мг парентерально) лишь обострили симптоматику. Вновь начатое лечение мелипримином (до 450 мг) не привело к эффекту, и лишь после добавления к нему 90 мг хлорацизина состояние больного начало постепенно улучшаться: начало выравниваться настроение в вечерние часы, уменьшились проявления соматопсихической деперсонализации, затем частично восстановилось чувство времени, «время стало двигаться, хотя еще медленно», одновременно исчезли мысли о «бессмертии» и появилась критика к ним. Затем стал критически относиться к идеям заражения гонореей, признал, что у него «депрессия, как и у других больных, которых можно вылечить». Появилось чувство насыщения, голода, сна, полностью выровнялось настроение. В конце декабря был выписан, полноценная ремиссия продолжалась до смерти больного, последовавшей в начале 1965 г. после инфаркта миокарда. В случае больного Л., несмотря на атипичность симптоматики, диагноз маниакально-депрессивного психоза основан на фазном течении психоза и полноценности интермиссии, несмотря на большую длительность заболевания и пожилой возраст больного. Все приступы заболевания характеризуются отчетливо выраженным аффективным компонентом, а после одного из них возникло гипоманиакальное состояние. То, что в основе приступов психоза лежат аффективные нарушения, подтверждается сравнительной оценкой фаз, последовательностью развертывании симптоматики и характером ее регресса: перенесенный в 1945 г. приступ характеризовался тревожно-депрессивным синдромом с идеями виновности, сочетающимися со страхом наказания. Кроме того, имелись выраженные деперсонализационные явлении. В последующих приступах деперсонализации нарастала, хотя даже в последней фазе и в высказываниях, и в мимике больного отчетливо определилось депрессивное настроение. Все фазы начинались с тревоги, затем быстро нарастала тоска и появлялась деперсонализация. По море усилении деперсонализации сглаживалась острота тоски и появлялись идеи заражения гонореей и «бессмертия». В основе этих бредовых высказываний лежит интерпретация тяжелых деперсонализационных ощущений, описанных Котаром, что подтверждается их регрессом: идеи бессмертия начали редуцироваться после того, как стало восстанавливаться чувство времени, но мере восстановления тактильной чувствительности и появления ощущении насыщения стали исчезать высказывания больного о «гонококковых прокладках» под кожей, о том, что внутренности сгнили. Таким образом, в основе психопатологической симптоматики приступов лежат тоска, тревога и деперсонализация. Помимо бреда, распознавание МДП затрудняет та малая экспрессивность, с которой больной рассказывает о своих мучительных переживаниях («расщепление»), а многословность и кажущаяся вычурность при их описании напоминают резонерство. Однако наличие массивной аутопсихической деперсонализации объясняет монотонность и отсутствие эмоциональности в высказываниях больного, и необычность переживаний и свойственное деперсонализации отсутствие чувства контакта, понимания вынуждают больного многократно повторять одно и то же и подыскивать сложные метафоры и аналогии, чтобы довести до собеседника свои ощущения. Особенностью данного наблюдения является положительная реакция на ЭСТ, что требует специального анализа, так как в большинстве случаев затяжные депрессивные состояния с массивной деперсоналиционной симптоматикой оказываются резистентны и даже к этому виду терапии (Kalinowslky L., 1959, и др.), что подтверждается приведенными ниже наблюдениями. Однако следует учесть, что во всех случаях ЭСТ применяли у больного во второй половине депрессивной фазы. Лечение большими дозами имипрамина, хлорацизина и ниамида, применявшимися по отдельности, оказалось неэффективным. Лишь про комбинированной терапии имипрамином и хлорацизином удалось достигнуть улучшения. В дальнейшем проверка этой эмпирически найденной методики лечения резистентных к терапии депрессивных состояний показала ее эффективность у некоторых больных. Приводимое ниже наблюдение иллюстрирует формирование многолетней деперсонализации у больного с биполярным течением МДП. Наблюдение 4. Больной В., 1939 года рождения, инженер. В семье психически больных не было. Отец мрачный, замкнутый, рано умер от инфаркта миокарда. Тетка со стороны матери страдает диабетом. Развивался нормально. На работе считался способным, перспективным сотрудником, имеет несколько изобретений. По характеру эмоциональный, мягкий, общительный. В детстве перенес спазмофилию и воспаление легких. В 16-17 лет был обнаружен нетоксический зоб, в 1960 г. в связи с возникновением состояния тревоги, связываемой эндокринологами с заболеванием щитовидной железы, была произведена струмэктомия. С 8-10 лет, по словам больного, возникали кратковременные периоды «грусти» и «заносчивости». С 14 лет колебания настроения приняли отчетливый сезонный характер: летом был грустным, подавленным, малоинициативным, зимой — энергичным, предприимчивым, самоуверенным. Впервые обратился к психиатру в 1968 г., в возрасте 29 лет. Был госпитализирован по поводу депрессивного состояния, характеризовавшегося меланхолическим синдромом с элементами тревоги и продолжавшегося с июня по октябрь 1968 г. С декабря 1968 г. по май 1969 г. длилась маниакальная фаза. В этот период был очень продуктивен на работе, хорошо выполнил несколько исследований, однако часто возникали конфликты с сослуживцами, которых больной раздражал категоричностью, нетерпимостью, самоуверенностью. Светлого промежутка почти не было, с июня 1969 г. воздало затяжное депрессивное состояние. В связи с безрезультатностью медикаментозной терапии в феврале 1971 г. была начата ЭСТ (до 30 билатеральных и унилатеральных токов), однако из-за тяжелых мнестических нарушений ее пришлось прервать, несмотря на умеренное, но кратковременное улучшение настроения. Лечение ингибиторами МАО (ипразид, затем парентерально вводимый ниамид) привело к заметному повышению психомоторной активности и улучшению настроения, однако деперсонализационные расстройства оставались неизменными. При увеличении доз ИМАО наступили серьезные побочные явления: гипотония с коллаптоидными состояниями, задержки при мочеиспускании, симптом «ватных ног». Поэтому ИМАО стали сочетать с предшественником серотонина — триптофаном (до 3 г. в день), В течении первых 2 дней состояние больного значительно улучшилось — прежде всего увеличилась продолжительность сна, появилось ощущение сна, по утрам стал чувствовать себя свежим, отдохнувшим, затем улучшилось настроение, возросла активность, увеличилась работоспособность, появилась способность концентрировать внимание, исчезли идеи малоценности, впервые за время болезни попросил о выписке. Однако, по-прежнему жаловался на «бесчувственность», отсутствие эмоций, но, в отличие от всей предыдущей истории заболевания. Деперсонализационные расстройства не тяготили больного. В апреле 1971 г. больной был выписан с поддерживающей комбинированной терапией (1-триптофан с ингибиторами МАО). Попытки уменьшить дозы 1-триптофана приводили к быстрому возобновлению депрессивной симптоматики. В течение последующего года продолжал получать поддерживающую терапию, настроение было ровным с незначительными субдепрессивными колебаниями, основные жалобы больного — на утрату чувств и «пленку на душе», бесцельность и безрадостность существования. Летом 1972 г. неглубокое депрессивное состояние без острой тоски, но с жалобами на «отсутствие всякого настроения», с отчетливой психической и двигательной заторможенностью. После периода относительно ровного настроения в конце 1972 г. резко повысилась раздражительность, вступал в конфликты с родными, в общественных местах. В связи со ссорой в магазине был госпитализирован. В больнице — оживлен, многоречив, держался с некоторым высокомерием. Впоследствии рассказал, что в этот период не было радости, ощущения повышенного настроения, а лишь «холодная гневливость». Следующая госпитализация летом 1974 г. по поводу депрессии: настроение было сниженным, жаловался на «скованность мыслей и тела», высказывал идеи малоценности, вял, движения замедленны, на глазах слезы. Однако основными были жалобы на «отсутствие инстинкта жизни», потерю чувств к матери, полное отсутствие всяких эмоций, «все делаю лишь по чувству долга», «нет ощущения своего тела», «время течет медленно, но оглядываюсь назад и вижу, как все быстро прошло». В результате лечения лепонексом при суточной дозе 500 мг возникли кратковременные состояния спутанности, ориентации, в дальнейшем значительное улучшение: полностью нормализовалось настроение, появилась активность, уменьшилась интенсивность деперсонализационных переживаний, особенно соматопсихических. но продолжал жаловаться на ощущение пленки, отделяющей от него живую жизнь». Весной 1975 г. — маниакальное состояние: общителен, охот но и много рассказывает о себе, речь сопровождается живой мимикой; часто улыбается, адекватно реагирует на шутки, часто вмешивается в чужие разговоры, пытается ухаживать за медсестрами, высказывает надежду на излечение, но вместе с тем жалуется на отсутствие чувства радости; «работаю как автомат, по чувству долга», нет ощущения контакта с собеседником, нет чувств к близким, «все только в рассудке». После выписки больной продолжал получать профилактическую терапию солями лития. В последующие годы аффективные колебания полностью сгладились, хотя деперсонализация, в основном аутопсихическая, продолжала держаться. В последние 2 года отмечается значительное смягчение явлений деперсонализации: вновь приступил к творческой работе познакомился с женщиной, к которой испытывал теплые чувства. Однако продолжает жаловаться на некоторое притупление эмоций, отсутствие полноценной радости, ощущение своей несостоятельности перед лицом жизненных трудностей. В случае больного В. диагноз МДП (о биполярным течением) подтверждается отчетливыми депрессивными и маниакальными состояниями, появившимися в 14 лет и углубляющимися с возрастом. В 30 лет, в дебюте депрессивной фазы, после резкой тревоги возникла деперсонализация. Эта фаза в отличие от предыдущих, характеризовалась депрессивно-деперсонализационным синдромом и продолжалась около 2 лет. Она отличалась также значительной резистентностью почти ко всем видам антидепрессивной терапии: трициклическим антидепрессантам, ИМАО, ЭСТ. в лишь сочетание триптофана с ИМАО привело к исчезновению депрессивной симптоматики, хотя деперсонализация оставалась неизменной. Деперсонализация приобрела многолетнее, затяжное течение, а под ее ледяной коркой продолжали возникать аффективные приступы, не только депрессивные, по и маниакальные: больной перенес два отчетливых маниакальных состояния (гневливую и солнечную мании), при которых, однако, не испытывал ни чувства радости, ни ощущения собственного настроения, ни привязанностей. Подобная «холодная мания» могла навести на мысль о шизофреническом процессе, однако анамнез заболевания и, главное, постоянное переживание душевной боли в связи с утратой эмоций указывают, что в данном случае имеется не эмоциональный дефект, а деперсонализация. Аффективные приступы полностью исчезли после начала профилактического лечения литием, а начало постепенного смягчения деперсонализации по времени совпало с терапией лепонексом. Постепенное смягчение деперсонализации и возвращение больного к творческой работе, его стремление к восстановлению личных привязанностей также свидетельствуют об отсутствии характерного для шизофрении эмоционально-волевого дефекта. Таким образом, наиболее характерным для данного наблюдения является то, что появившаяся в дебюте тревожно-депрессивного приступа деперсонализация продолжала существовать почти 10 лет и в период депрессии, и в ремиссии, и в период мании. Мы наблюдали лишь 3 больных с отчетливой маниакальной и деперсонализационной симптоматикой: у одной из них был диагностирован МДП, у другого с детства отмечались достаточно типичные маниакальные и депрессивные фазы, а также малые эпилептические припадки. После операции на височной доле серии припадков исчезли, но аффективные приступы приобрели крайнюю интенсивность и напряженность, депрессивные состояния стали протекать с депрессивно-деперсонализационным синдромом, затем деперсонализация стала постоянно захватывать светлые промежутки, а затем распространилась и на маниакальные периоды. При анализе данного случая возникает вопрос, чем обусловлена терапевтическая резистентность больного В. — деперсонализацией или затяжным течением. То, что резистентность к лечению была неполной (в начальном периоде терапии наступало некоторое улучшение), позволяет думать, что сама длительность фазы и соответственно лечения обусловливает привыкание к препарату. Но это рассуждение неприменимо к ЭСТ. Следует также отметить, что у всех резистентных к различным видам антидепрессивной терапии больных МДП, обследованных нами в женском отделении одной из городских больниц, был установлен депрессивно-деперсонализационный синдром, а фазы были затяжными (более 1 года) у 16 из 17 этих больных, причем у 12- более 2 лет (Барштейн Е. И Нуллер Ю. Л., 1975). Для того, чтобы выяснить, связана ли терапевтическая резистентность депрессивно-деперсонализационных состояний только с затяжным течением или же имеют значение и другие факторы, были исследованы результаты терапии больной Л., страдающей маниакально-депрессивным психозом, но с относительно короткими фазами, протекающими с депрессивно-деперсонализационным синдромом. Отличительной особенностью депрессивных состояний больной Л, являлась их низкая терапевтическая чувствительность. Несмотря на разнообразие применявшихся методов лечения: имипрамин, амитриптилин, пертофран, трансамин, ЭСТ и др., — продолжительность депрессионных фаз оставалась неизменной, а улучшения наступали лишь, при применении антидепрессивной терапии в конце спонтанного течения фаз. В данном случае терапевтическая резистентность больной с депрессивно-деперсонализационным синдромом не может быть объяснена затяжным течением депрессии, как в наблюдении 2, поскольку продолжительность фаз у больной Л. обычно не превышала 3 месяцев. Таким образом, крайне низкая курабельность депрессивно-деперсонализационных состояний присущи этому синдрому вне зависимости от длительности приступов. Затяжные депрессии также характеризуются терапевтической резистентностью, а поскольку депрессивно-деперсонализационные состояния, как уже указывалось выше, отличаются длительным течением (Е. И. Барштейн, Ю. Л. Нуллер, 1975), то трудности, возникающие при их лечении, обычно обусловлены двумя факторами: и структурой синдрома, и длительностью фазы. Из 315 больных МДП, находящихся под нашим длительным наблюдением, у 14 депрессивные фазы характеризовались депрессивно-деперсонализационным синдромом (т. е. приблизительно 4,5%), причем у 3 из них фазы продолжались от 2 до 4 лет, у 7 — от 1 до 2 лет, у 2 — от 9 до 12 месяцев и только у 2 — меньше 6 месяцев. У остальных 300 больных МДП, депрессивные состояния которых характеризовались другими синдромами, фазы продолжительностью более 1 года встречались лишь у 32 человек, т.е. у 11%, и то время как в подгруппе с депрессивно-деперсонализационным синдромом затяжные фазы отмечались у 71% больных, Эти различия высокодостоверны (р < 0,001). Средняя длительность фаз, характеризовавшихся депрессивно-деперсонализационным синдромом, составляла 13,4 месяцев, в то время как у остальных 300 больных МДП — 6 месяцев (р < 0,05). Из всех применявшихся методов антидепрессивной терапии (кроме феназепама и лепонекса) относительно лучший аффект давала эмпирически найденная комбинации хлорацизина с имипрамином (мелипрамином): положительный эффект наблюдался у 4 из 12 больных, у 2 наступило резкое обостренно тревоги и тоски, и у 6 лечение оказалось безрезультатным, Обычно мы применяли следующую схему: в течение недели мелипрамин до 250-300 мг, затем в течение недели сочетанное применение 150-200 мг мелипрамине с 45-75 мг хлорацизина, далее в точение недели хлорацизин 90-120 мг, и затем вновь назначался мелипрамин. Подобные циклы лечения проводились 1-3 раза. При лечении больных с деперсонализационно-депрессивным синдромом следует всегда помнить, что эти больные самые опасные в отношении суицида. По-этому рекомендуемое некоторыми авторами применение антидепрессантов с выраженным стимулирующим компонентом действия не только малоэффективно, но и очень опасно, так как возможное обострение симптоматики часто приводит к суицидным попыткам. Но и при лечении анксиолитическими препаратами возможно кратковременное усиление (точнее, высвобождение) тоски в период редукции деперсонализации, что также сопровождается усилением риска суицида. Наиболее эффективными средствами при лечении подобных состояний являются мощные анксиолитики, в частности исследованные нами клозепин (лепонекс) и феназепам. Результаты такой терапии превосходили результаты традиционного применении антидепрессантов. Более подробные данные приведены ниже. Встречающиеся и клинической практике сложности и неудачи при лечении больных с депрессивно-деперсонализационным синдромом в значительной степени обусловлены также трудностями, возникающими при его психопатологической квалификации, и, в частности, с тем, что он часто «маскируется» под астено-депрессивно-ипохондрические состояния. Относительно часто у больных с резко выраженной деперсонализацией при первичном осмотре диагностируется шизофрения. Этому способствуют следующие особенности таких состояний: необычность ощущений, невозможность описать их в обыденных терминах приводят к тому, что больные прибегают к сложным метафорам, необычным сравнениям, производящим, на первый взгляд, впечатление вычурности, нарочитости. Кроме того скрытая тревога и, главное, потеря ощущения контакта с собеседником, опасение, что врач не может понять его состояния, заставляют больного многократно повторять одну и ту же мысль в разных выражениях, подыскивая все новые термины. Это многословие, не свойственное больным с классическим депрессивным синдромом, иногда расценивается как шизофреническое резонерство. Некоторые высказывания больных, вытекающие из их ощущений, например вызванные нарушением чувства времени мысли о бессмертии у больного Л. (наблюдение 3), могут расцениваться как первичный бред. И, наконец, оценку состояния таких больных существенно затрудняет отсутствие у них типичной депрессивной симптоматики: они по испытывают ост рой тоски и не склонны придавать значение сниженному настроению, так как считают его логическим следствием основного, с их точки зрения, проявлении заболевания («омертвения», «потери себя» и т. п.). Такие больные, как правило, но бывают двигателно заторможены они, как указывалось выше, могут быть даже многоречивыми, хотя мимика у них застывшая, но на лице пет выражения страдания. Очень характерно выражение их глаз: пристальный, часто немигающий взгляд, с широко открытыми блестящими глазами, напоминающий взгляд больных с сильной напряженной тревогой. В некоторых случаях распространяющаяся на межфазные промежутки деперсонализация расценивается как специфический шизофренический апатоабуличекий дефект, хотя такие больные мучительно переживают свое состояние. Тщательный анализ структуры синдрома, изучение динамики приступа и течения всего заболевания, выявление роли аффекта позволяют избежать диагностических ошибок и обусловленной ими неправильной терапии. |
||
|
ГЛАВА 8 ДЕПЕРСОНАЛИЗАЦИЯ. КЛИНИКА И ЛЕЧЕНИЕ |
|
|
|
Данные, приведенные и предыдущей главе, показывают, что деперсонализации при МДП значительна ухудшает течение заболевания и резко снижает терапевтическую чувствительность аффективных приступов. Большие трудности возникают при лечении других психических расстройств, если в их психопатологической картине деперсонализация играет существенную роль. Однако, несмотря на важность этой проблемы, деперсонализации посвящено очень мало специальных исследований, и она остается одним из наименее изученных психопатологических явлений. Прежде всего это подтверждается крайне нечеткой терминологией, так как почти каждая школа придает термину «деперсонализация» различные значения. Это частично объясняется неудачностью самого слова: часто его понимают дословно (т. е. «обезличивание», утрата своего «Я») и относят к деперсонализации многочисленные расстройства: раздвоение личности, феномен «сделанности» и т. и. К деперсонализации также часто относят нарушения схемы тела, грубую дереализацию, оптико-вестибулярные расстройства и др. Однако следует помнить, что Дега, введший в употребление этот термин, подчеркивал, что деперсонализация есть не потеря чувства «Я», а чувство (ощущение) потери своего «Я», которое является одним из многочисленных проявлений обозначаемого этим термином психического нарушении. Имеются и другие термины, которыми оно обозначается: «чувство отчуждения», которое, по мнению Л. Л. Меграбяна (1962), является более адекватным, «психическая анестезия», «чувство ирреальности», «гипопатия» и др. Однако слово «деперсонализация» прочно вошло в литературу, и его замена представляется в настоящее время нецелесообразной, несмотря на его явную неудачность. Большая часть работ, посвященных деперсонализации, носит либо чисто описательный характер, либо трактует этот феномен с психологических и философских позиций, в зарубежной литературе — чаще всего с точки зрения психоанализа. При изучении того или иного психопатологического явления возникает ряд вопросов: 1) при каких заболеваниях оно встречается и какова его диагностическая ценность; 2) имеется ли к нему предрасположенность и в ответ на какие воздействия и вредности оно возникает; 3) с какими другими симптомами коррелирует; 4) может ли оно быть причиной или участвовать в образовании других психопатологических нарушений; 5) как влияет на течение заболевания. Накопление подобных данных, очевидно, должно способствовать решению конечной задачи: раскрытию патогенетических механизмов и нахождению эффективных методов лечения и профилактики исследуемого расстройства. Как известно, деперсонализационные расстройства наблюдаются практически при всех психических заболеваниях, эпилепсии, при пограничных состояниях, а также в легкой и кратковременной форме у психически здоровых людей при эмоциональных нагрузках, соматических заболеваниях, после родов. Для проявления деперсонализации характерна утрата эмоционального компонента психических процессов. Это относится не только к классическим симптомам психической анестезии: потере чувств к близким, отсутствию эмоционального восприятия окружающей обстановки, природы, произведений искусства и т. д., но и к деперсонализации мышления, памяти, соматопсихической деперсонализации. У таких больных мысли проходят, не оставляя следа; нет ощущения их оконченности, так как они идут без эмоционального сопровождения, они безлики; память но нарушена, но нет ощущения узнавания; прежние переживания, образы, мысли тусклы, как бы стерты, поэтому кажется, что в памяти ничего нет. Для учета динамики и количественной оценки деперсонализационной симптоматики мы использовали разработанную совместно с Э. Л. Генкиной градуированную оценочную шкалу, включающую следующие проявления: разные степени снижения или изменения отношения к близким, восприятия окружающей обстановки, природы, искусства, а также деперсонализацию мышления, деперсонализацию памяти, нарушение чувства знакоместа, наличие или отсутствие эмоциональных реакций (обиды, злобы, сострадания, радости и т. д.), контакт с окружающими и чувство сопереживания, отчуждение собственного «Я», деперсонализацию представлений, соматопсихическую деперсонализацию (отсутствие или притупление болевой, тактильной, температурной чувствительности, вкуса, голода, насыщения, чувства сна и т. д.) нарушение чувства времени, ощущение душевной боли, связанное с отсутствием чувств, а также такие симптомы, как тревога, тоска, ощущение незавершенности, дереализация, соматические симптомы. Каждый из основных симптомов был разбит на 4-5 градаций. В качестве эталона нами была исследована группа больных (6 мужчин и 12 женщин), у которых психопатологическая симптоматика исчерпывалась массивной или тотальной деперсонализацией, а также аффективными расстройствами (тревога, напряжение, депрессивное настроение). У части больных этой группы деперсонализация не достигала степени тотальной, и отсутствовали некоторые из ее проявлений: чаще отсутствовала полная анальгезия (наблюдавшаяся у 3 больных), «остановка времени» (только у 2 больных), не во всех случаях отмечалась деперсонализация мышления и памяти. У больных этой группы чаще всего диагностировались органические заболевания головного мозга с психическими нарушениями, атипичный МДП, иногда шизофрения. У всех этих больных отмечались общие черты в преморбиде: это были гиперэмоциональные личности, тревожные, впечатлительные, ранимые, обидчивые. В детстве многие из них постоянно боялись смерти родителей. Они крайне болезненно переживали не только лепонексом (клозепином) - нейролептиком, обладающим мощным противотревожным действием. Лепонекс применяли внутрь или внутримышечно в дозах от 150 до 600 мг в день. У 9 больных лечение было начато в первые месяцы после развития деперсонализационного синдрома, характеризовавшегося, помимо аутопсихической деперсонализации, массивной соматической деперсонализацией, тревогой, напряжением, депрессией. У всех 9 больных отмечалось либо полное исчезновение психотической симптоматики, либо настолько значительное ее смягчение, что больные могли быть выписаны из больницы. Интересно, что последовательность регресса симптоматики при лечении лепонексом совпадала с порядком ее возникновения: сначала исчезала тревога, затем депрессия, далее — симптомы соматической деперсонализации и медленнее всего — аутопсихическая деперсонализация. Они сглаживались постепенно, лишь на 4-6-й неделе лечения лепонексом, прячем чаще всего улучшение начиналось с кратковременных периодов «просветления», «возврата чувств», после которых вновь возвращалось «бесчувствие». Первыми возвращались ощущение контакта с собеседником, привязанность и тепло к детям, другим близким людям, позднее всего восстанавливалось эмоциональное восприятие природы, произведений искусства. У 3 больных при быстром наращивании доз лепонекса симптоматика исчезала критически, вслед за наступлением состояния своеобразной спутанности, дезориентировки. У 6 больных с длительным течением заболевания преобладанием явлений аутопсихической деперсонализации и полным отсутствием или наличием лишь не значительной тревоги лечение лепонексом оказалось неэффективным либо вызывало только частичное улучшение. Эти данные подтверждают роль тревоги в патогенезе деперсонализации. То, что положительный терапевтический эффект лепонекса связан именно с его противотревожным действием, подтверждается хорошими результатами, полученными при лечении деперсонализационных состояний феназепамом. Всего феназепамом лечили 42 человека с выраженной деперсонализационной симптоматикой, которая являлась ведущим компонентом синдрома. У всех лечившихся отмечались явления ауто- и соматопсихической деперсонализации, у большей части они сопровождались чувством душевной боли. Как указывалось выше, формально больным выставлялся диагноз «вяло текущая шизофрения», «атипичный МДП», «органическое заболевание головного мозга с психическими нарушениями» и т. п. Большинство больных составляли женщины (34 чел.). Феназепам применяли в суточных дозах 3-6 мг, хотя у отдельных больных доза достигала 20 и даже 30 мг. Вообще при лечении любыми препаратами у больных деперсонализацией обычно требовались большие дозы, чем при сходных заболеваниях, но протекающих без нее. Из 42 больных у 13 психопатологическая симптоматика исчезла полностью, у 12 — значительно уменьшилась, у 9 — улучшение было умеренным и у 8 — положительный эффект отсутствовал. Таким образом, положительные результаты отмечались у 25 из 42 больных, что, учитывая терапевтическую резистентность таких больных, следует расценивать как значительный успех. Лучше реагировали больные, у которых деперсонализация развилась недавно, сопровождалась чувством душевной боли, сочеталась с тревогой, напряжением, сенестопатиями. Действие феназепама прежде всего проявлялось в смягчении внутреннего напряжения и тревоги, затем начинали редуцироваться явления соматопсихической деперсонализации, а далее аутопсихической, хотя различия в темпе регресса между ауто- и соматопсихической деперсонализацией иногда было трудно установить. При хорошем эффекте; обычно в дебюте заболевания, полное исчезновение психопатологической симптоматики наблюдалось в первые дни, и ее регресс происходил одновременно. При затяжных, многомесячных и многолетних деперсонализационных состояниях результаты лечения феназепамом были хуже, по в ряде случаев, когда деперсонализация сочеталась с тревогой и описанными выше характерными соматическими жалобами, эффект оказывался достаточно хорошим. В целом создалось впечатление, что у женщин чаще и острее возникает деперсонализация, причем в большей степени она сочетается с психическими и соматическими и проявлениями тревоги (стресса), но результаты лечения у них оказываются лучшими. У значительной части больных после достижения терапевтического эффекта требовалась длительная (иногда несколько лет) поддерживающая терапия феназепамом. Как указывалось ранее, у многих больных маниакально-депрессивным психозом при классическом меланхолическом синдроме встречаются anaesthesia psychica dolorosa и соматическая деперсонализация. Реже наблюдаются депрессивные фазы, характеризующиеся выраженным депрессивно-деперсонализационным синдромом, при котором деперсонализация занимает ведущее место в структуре синдрома. Деперсонализация возникала либо на высоте тяжелого меланхолического синдрома, с крайне интенсивной витальной тоской, либо у больных с острым дебютом тревожной депрессии, т.е. л в этих случаях деперсонализация появлялась вслед за возникновением напряженного, интенсивного аффекта тревоги или витальной тоски. Для депрессивных фаз МДП, протекающих с депрессивно-деперсонализационным синдромом, была характерной тенденция к затяжному течению. В отдельных случаях деперсонализация после нескольких депрессивных фаз постепенно начинает распространяться на межфазовый промежуток, а у 3 больных с биполярным течением психоза деперсонализация оставалась и в период маниакальных состояний (см. наблюдение 4). Таким образом, создается впечатление, что деперсонализация, запущенная аффектами тревоги и, вероятно, витальной тоски, вначале тесно связанная с ними, в дальнейшем приобретает автономное существование вне зависимости от аффективного фона. В дебюте деперсонализация в большей степени зависит от аффекта. Подтверждением этому служат данные «диазепамового теста». Как было показано в гл. 4, внутривенно вводимый седуксен вызывал у значительной части больных редукцию деперсонализационной симптоматики. Обработка факторным анализом этих данных показала, что деперсонализация оказалась стержневым симптомом двух факторов, причем в одном она была связана с психопатологическими проявлениями тревоги, в другом нет. Интерес представляет реакция на введение седуксена у больной, поступившей в состоянии ступора, возникшего на высоте аффекта страха. До этого больная много лет принимала противозачаточный препарат инфекундин, после отмены которого развилось тревожно-депрессивное состояние, причем тревога и страх быстро нарастали, к ним присоединилась массивная деперсонализационная симптоматика, достигавшая степени тотальной деперсонализации. После введения седуксена и периода сна вместо прежнего бесчувствия больная ощутила острую витальную тоску, которая постепенно, в течение 2 ч, исчезла. Создается впечатление, что в этом случае деперсонализация как бы блокировала аффект тоски и после ее снятия тоска «вырвалась наружу». На способность деперсонализации блокировать продуктивную симптоматику и стабилизировать течение процесса указывают два случая снятия массивной деперсонализации у больных шизофренией. У одного больного в 18 лет возникло тревожно-депрессивное состояние, сменившееся деперсонализацией, продолжавшейся более 5 лет. Медикаментозная терапия была неэффективной. После тяжелого стресса (автокатастрофа, случившаяся по вине больного) деперсонализация полностью исчезла, однако через месяц у больного появились идеи преследования, отношения, воздействия, галлюцинации, синдром Кандинского — Клерамбо. У другого больного с 24 лет отмечались периодические ступорозные состояния, сопровождавшиеся страхом, наплывом мыслей. Была диагностирована кататоническая форма шизофрении, больной получал лечение различными нейролептиками, ЭСТ без существенного эффекта. В дальнейшем в межпристунных периодах развилась деперсонализация, сочетавшаяся с тревожным напряжением. В 1976 г. (па 18-м году заболевания) в результате лечения феназепамом деперсонализация впервые исчезла, и больной был выписан домой. Однако вскоре через месяц остро развилась параноидная симптоматика на фоне выраженного аффекта страха. Эти наблюдения являются единичными, и на их основании трудно делать какие-либо выводы, однако создается впечатление, что у обоих больных деперсонализация стабилизировала болезненный процесс, не давая развиться продуктивной симптоматике, так как вслед за исчезновением деперсонализации и кратковременной ремиссией (до месяца) остро возник галлюцинаторно-параноидный синдром. Наши немногочисленные наблюдения, касающиеся возникновения деперсонализации в клинике пограничных состояний и у психически здоровых лиц, совпадают с литературными данными. Во всех этих случаях деперсонализация возникла после выраженной реакции стресса, вызванной тяжелой и острой психотравмой. Так, многолетняя и массивная деперсонализационная симптоматика возникла у молодой женщины, у которой в тайге потерялась 4-летняя дочь. В другом случае деперсонализация наступила у мужчины после того, как он тонул и был с трудом спасен. Мы также наблюдали длительную аутопсихическую деперсонализацию (более 10 лет) у бывших узников фашистских концлагерей. О возникновении деперсонализации в нацистских лагерях смерти имеются литературные данные (Bluhm H., 1948). Обычно в этих случаях деперсонализация не осознается как болезнь и обнаруживается случайно при встрече с психиатром или психоневрологом, обусловленной другими причинами. Для этих лиц характерны некоторые особенности поведения: по существу они одиноки, стремятся заполнить жизнь цепью формальных задач и правил (например, ежедневные прогулки по одному и тому же маршруту, не доставляющие, однако, никакого удовольствия, посещение «как по обязанности» популярных лекций, концертов, собраний и т. п., мелочное расписание дня по часам, хотя особой нехватки времени нет, и т. д.). Они стараются поступать «как положено», «как принято», хотя внутреннего стимула для тех или иных поступков у них нет. Вспоминая, период времени после наступления деперсонализации, они с трудом отмечают отдельные вехи; «несмотря на то, что каждый день тянется страшно долго, прошедшие годы промелькнули совсем незаметно, почти не оставив следа в памяти». У всех наблюдаемых нами больных этой группы в прошлом также отмечались повышенная впечатлительность и тревожность, склонность к сильным эмоциональным реакциям. Сопоставление приведенных выше наблюдений и литературных данных позволяет ответить на ряд поставленных выше вопросов. 1. Деперсонализация является неспецифической в отношении нозологии реакцией, возникающей при раз-личных психозах, а также у больных с пограничными состояниями и у психически здоровых лиц в условиях сильного эмоционального напряжения (имеются в виду отрицательные эмоции и аффекты: тревога, страх, тоска). 2. Деперсонализация, как правило, возникает у лиц, которых
в преморбиде можно охарактеризовать Как «тревожно-впечатлительных»,
гиперэмоциональных. 3. Деперсонализация, как правило, возникает после интенсивного стресса, психопатологически проявляющегося аффектами тревоги и страха. Часто реакция стресса вызвана тяжелой психотравмирующей ситуацией, реже — обусловлена соматогенно. При эндогенных психозах деперсонализация появляется на высоте психотической тревоги, страха и, вероятно, тяжелой витальной тоски. Связь деперсонализации с тревогой подтверждается эффективностью противотревожных средств (лепонекс, феназепам, большие дозы внутривенно вводимого седуксена) при лечении деперсонализации в дебюте заболевания купируя тревогу, они приводят к редукции деперсонализационной симптоматики. 4. В дебюте деперсонализация обычно сочетается с аффективными расстройствами (тревога, тоска) и различными психическими и соматическими проявлениями тревоги: фобиями, вегетативными и мышечными (спастическими) нарушениями, которые обычно квалифицируются как сенестопатии. 5. Деперсонализация часто лежит в основе ипохондрической фиксации и ипохондрического бреда. 6. При аффективных психозах массивная деперсонализации приводит к затяжному точению депрессивных фаз и обусловливает их резистентность к антидепрессивной терапии. При шизофрении деперсонализация в отдельных случаях стабилизирует течение психоза. Анализ приведенных данных и в особенности результатов лечения деперсонализации противотревожными средствами показывает, что в развитии деперсонализации отчетливо выделяются два этапа: первый, начальный, характеризуется тесной связью деперсонализации с аффектом, поскольку противотровожные средства именно в этот период приводят вслед за снятием тревоги к редукции деперсонализации. В клинической картине выражена соматопсихическая деперсонализации, аутопсихическая деперсонализация сопровождается «душевной болью», отчетливо проявляются аффективные нарушения — тревога, тоска, а также характерные соматические жалобы. Для второго этапа характерно длительное (многомесячное или многолетнее) существование деперсонализации, преобладание и клинической картине монотонной аутопсихической деперсонализации без чувства лущенной боли. Тревога и тоска либо отсутствуют, либо проявляются крайне стерто. Противотревожные препараты на атом этапе малоэффективны, деперсонализация настолько оторвана от аффекта, что при фазно протекающих психозах может существовать не только в межприступных промежутках, но и в период мании. Иначе говоря, на втором этапе деперсонализация как бы отрывается от аффективной патологии и приобретает самостоятельное, автономное существование. |
||
|
ГЛАВА 9 ПРОФИЛАКТИКА ПРИСТУПОВ МАНИЛКАЛЬНО-ДЕПРЕССИВНОГО |
|
|
|
Какое бы активное и успешное лечение ни проводилось больному МДП во время депрессивной фазы, оно не защищает его от наступления следующих фаз. В литературе имеется немало указаний даже на утяжеление течения болезни в целом под влиянием антидепрессантов (Маркие Д. П., 1070). Поэтому предупреждение повторных аффективных приступов при лечении больных МДП составляет особую задачу. О попытках профилактики фаз маниакально-депрессивного психоза упоминаются уже в руководстве для врачей и студентов Крепелина (1904). Он отмечал в некоторых случаях благоприятный эффект от дачи больному за несколько дней до предполагаемого начала фазы по 12-15 г. бромида натрия в сутки. Комплекс, общеукрепляющих средств, способствующий удлинению светлых промежутков, был разработан П. В. Бирюковичем (1958). Английскими исследователями сообщалось о попытках предотвратить депрессию профилактическими ежемесячными сеансами ЭСТ (Karliner W., Wehrhein H., 1965). И, наконец, в клиниках, многих стран и в своей практической работе, наверно, каждым врачом делались назначения постоянного приема небольшой дозы антидепрессантов в надежде предупредить этим возникновение повторных депрессий. На большом материале выявлялась, как правило, несостоятельность этого метода: достоверной разницы в числе рецидивов не было (Grof P., Vinar О., 1966). И все таки до применения солей лития истинной профилактики аффективных фаз не было. Успокаивающее действие лития на нервную систему известно с, прошлого века (бромид лития, минеральные воды, содержащие литий). Однако лишь в 1949 г. литий был применен для лечении маниакальных состояний. Австралийский психиатр J. Cade создал рабочую гипотезу, согласно которой в здоровом организме присутствует неизвестная субстанция X, избыток которой приводит к маниакальному состоянию, не достаточное содержание — к депрессии. Чтобы определить эту субстанцию X, исследовалась моча маниакальных больных. При впрыскивании ее морским свинкам у животных наблюдались судороги, иногда и смерть. Возникло подозрение, что токсический эффект связан с высоким содержанием мочевины, и для проверки в контрольном опыте свинкам стали вводить урат лития. Результат оказался необычным: токсические явления не усиливались, судороги снимались, животные становились сонными, малоподвижными. J. Cade провел курс лечения литием 10 больным с маниакальным состоянием, и все 10 поправились. Сообщение в печати об этом успехе совпало с поступлением сведений о тяжелых токсических состояниях, вызванных применением хлористого лития как заменителя поваренной соли для больных с сердечной недостаточностью. Теперь ясно, что эти осложнения были вызваны бесконтрольным применением лития людьми с заведомо больными почками, но внедрение лития в психиатрическую практику было задержано этим сообщением. Постепенно подтверждения эффективности лития при состояниях мании накапливались, но к этому времени в психиатрическую практику вошли аминазин, галоперидол, и литий был всего-навсего еще одним успокаивающим средством. Совсем исключительное положение в психиатрии литий занял после сообщений G. Hartigan (1963), P. Baastrup, M. Schou (1967). Выяснилось, что у больных, которым были свойственны сдвоенные фазы (мания — депрессия), при лечении мании карбонатом лития последующая депрессия не наступала. Закономерность такого предупреждающего действия лития бурно обсуждалась в течение последних 40 лет и сей час может считаться доказанной и общепризнанной Остаются, однако, невыясненными механизм действия лития и в связи с этим — проблема резистентности части больных к этому методу профилактики. Не разработаны методы преодоления некоторых побочных явлений. Основные вопросы: показания, методика, длительность профилактического лечения — сходно освещаются исследователями разных клиник, с небольшими вариантами повторяющих те установки, которые были даны в работе P. Baastrup и М. Shou в 1967 г. Показанием для профилактического применения солей лития являются маниакально-депрессивный, шизе-аффективный и органический аффективный психозы, их биполярные и монополярные формы. Профилактика литием оправдана, если заболевание протекает злокачественно, т.е. приступы возникают раз в год и чаще. Назначать карбонат лития больному после первой депрессивной фазы, как бы тяжело она не протекала, неправильно, так как вариабельность течения маниакально-депрессивного психоза очень велика, и после глубокой депрессии длительностью более года может наступать светлый промежуток на десятки лет; заставлять больного постоянно принимать литий все эти годы нет оснований. Профилактическую терапию солями лития следует начинать в светлые промежутки или в маниакальном состоянии, так как начало лечения во время депрессии иногда задерживает выход из депрессивной фазы, о чем будет в дальнейшем сказано подробнее. К настоящему времени практически все соли лития вытеснены карбонатом. Очень редко, при выраженном гипоцидном гастрите целесообразнее назначать цитрат лития (углекислый литий заметно понижает кислотность желудочного сока). Профилактику начинают с 600 мг карбоната лития в сутки. Реже в первые дни приходится давать 300 мг или даже 150 мг и затем повышать дозы очень постепенно. Медленное наращивание доз проводится при наличии соматических заболеваний (например, почек) и при отсутствии возможности регулярно определять концентрацию лития в крови. Обычно же дается по 300 мг карбоната лития утром и вечером так, чтобы интервал между приемами равнялся 12 ч. Через 6-7 дней производится определение концентрации лития в плазме крови, и если она не достигает необходимого уровня, дозу увеличивают до 900-1200 мг. Таким образом, под контролем концентрации в крови подбирают дозу индивидуально для каждого больного. Она должна обеспечивать концентрацию в плазме не ниже 0,6 ммоль/л, если кровь на анализ берется не позже, чем через 10-12 ч после последнего приема лития. Принято делать эти анализы утром, перед первым приемом, но каждая лаборатория может организовать и взятие крови на анализ в вечерние часы 1-2 раза в месяц — для работающих больных; наша практика показала его необходимость. В этих случаях в день, анализа дневной прием лития пропускается. Обычно концентрация 0,6-0,7 ммоль/л достаточна для профилактического действия, но в резистентных случаях ее приходится повышать до 0,8-0,9 ммоль/г. Повышают концентрацию и при возникновении маниакального состояния. Концентрация выше 1 ммоль/л плохо переносится больными, но, по литературным данным, верхний предел допустимого содержания лития в плазме — 1,4-1,6 ммоль/л. Необходимая концентрация обеспечивается чаще всего дозами 900- 1200 мг карбоната лития, но иногда ее приходилось повышать до 2400 мг; у некоторых же больных нужного содержания лития в крови вовсе не удается добиться. В среднем дозы солей лития выше у молодых больных (в связи с быстрым почечным клиренсом). Препарат лучше распределять равномерно в течение суток и наращивать дозы медленно, чтобы уменьшить проявление побочных эффектов. После того, как адекватная доза карбоната лития найдена, больной должен принимать ее в течение длительного времени (практически профилактическая терапия продолжается бессрочно). Концентрация лития в крови должна определяться регулярно, не реже одного раза в два месяца. Регулярный контроль по только предотвращает опасность передозировки, но и позволяет выявить нарушения в приеме препарата. Снижение дозы пли пропуски приводят к возобновлению приступов даже после многих лет благополучия. Если аффективные приступы но возникают, подобранные дозы карбоната лития остаются стабильными в течение многих лет. Уменьшение дозы необходимо при соматических заболеваниях, когда есть опасность обезвоживания: высокая температура, повышенная потливость, поносы; при назначении бессолевой диеты, при которой изменяется электролитный баланс, и по той же причине — при назначении диуретиков. Все лекарства, кроме диуретиков, практически совместимы с карбонатом лития, и при возникновении у больных в процессе профилактики литием маниакальных и депрессивных фаз их можно лечить и антидепрессантами, и нейролептиками в обычных дозах. При проведении ЭСТ надо соблюдать осторожность. Были наблюдения, что применяемые перед сеансом анестетические вещества на фоне лития усугубляют нарушения дыхания (Jephcott G., Kerry R., 1974). В наших 7 случаях комбинированного лечения — литий и ЭСТ — с применением для кратковременного наркоза сомбревина осложнений не возникало. Из интеркуррентных соматических заболеваний основанием для снижения дозы лития являются заболевания почек, сердца, гипотиреоз. Снизив дозу, при первых признаках соматического неблагополучия, необходимо уточнить соматический диагноз. При пиелонефрите лечение карбонатом лития можно продолжать в обычных дозах, при гломерулонефрите — тщательно проверить функцию почек (фильтрация, клиренс) и заново решить, насколько необходимо в этом случае лечение литием. Если течение МДП было тяжелым, а эффект лития несомненно положительным, профилактику можно продолжать, по проводить ее при частых контрольных исследованиях как функционального состояния почек, так и концентрации лития в крови. Вопрос о продолжении приема лития в этом случае надо решать вместе с нефрологом. В нашей группе больных, более 10 лет без осложнений принимающих карбонат лития, двое страдали хроническим гломерулонефритом, один — перенес острый гломерулонефрит, не прекращая приема лития, а один больной имеет одну почку, функция которой понижена. При заболеваниях сердца должны настораживать нарушения проводимости; лечение литием нужно продолжать под контролем ЭКГ и содержания в плазме крови калия и натрия. При гипотиреозе необходимо подобрать адекватную дозу тиреоидина или трийодтиронина и затем вернуться к прежней дозе лития. Если при перечисленных заболеваниях не удается проводить необходимые исследования — литий приходится отменять. Еще одна причина для отмены — беременность. В первую треть беременности принимать карбонат лития не следует из-за возможного тератогенного действия. Сообщений о дефектах развития человеческого зародыша у матерей, принимающих литий мы не нашли. Датский «Register of Lithium Babies», периодически сообщающий сведения о состоянии детей, не привел данных о специфических нарушениях развития детей, связанных с приемом лития их матерями. В наблюдениях над крысами и мышами отмечалась, однако, большая, чем в популяции, частота врожденных уродств: атрезия наружного уха, деформация лапок и т. п., но это может быть объяснено видовой чувствительностью (Shou M., Amdisen А., 1971). Несомненно, что во вторую половину беременности прием солей лития необходимо возобновить, так как опасность возникновения депрессии после родов велика, а послеродовые депрессии протекают особенно тяжело и сказываются не только на матери, но и на ребенке. Шестеро детей наших больных женщин, принимавших карбонат лития, родились и развиваются нормально. Старшему из них сейчас 7 лет. Иногда суточную дозу карбоната лития приходится менять из-за изменившегося психического состояния. При возникновении мании прежде, чем обращаться к нейролептикам, следует повысить суточную дозу карбоната лития на 600 и даже 900 мг (маниакальные больные переносят соли лития лучше). Если этой меры недостаточно, можно комбинировать литий с аминазином или галоперидолом. О терапевтическом действии лития при депрессивных состояниях до сих пор не существует единого мнения. Об успешном применении солей лития именно для лечения (не профилактики) депрессивных фаз сообщалось неоднократно, но во всех этих работах можно найти методические ошибки в оценке результатов. Обычно не учитывается глубина депрессии, этап депрессивной фазы, когда назначался литий, и мн. др. По нашим наблюдениям (согласующимися с данными М. Shou), литий не обладает антидепрессивным эффектом (Михаленко И. Н., Киселева И. и Лапин И. П., 1976). В первые годы применения лития мы назначали его на любом этапе заболевания, хотя имели целью в основном профилактическое применение. В 55 случаях карбонат лития был назначен при депрессии, и у 24 больных вскоре наступило отчетливое ухудшение состояния. Это были больные, у которых к моменту назначения лития уже исчезли наиболее тяжелые депрессивные симптомы. На 2-3-й день после начала приема карбоната лития они вновь начали жаловаться на ухудшение настроения, появлялись заторможенность, молчаливость, снижалась активность. Это происходило несмотря на то, что доза антидепрессантов, которую к тому времени получали больные, не менялась. За тот же период времени литий был назначен 53 больным в маниакальном состоянии и 59 — в светлом промежутке, и депрессивные симптомы появились только у 4. У части больных депрессивные состояния, несмотря на профилактику литием, продолжали возникать повторно и протекали достаточно тяжело. Состояние больных требовало назначения антидепрессантов. Чтобы получить данные для сравнения, мы назначали этим больным те же антидепрессанты, которыми они лечились в депрессивном состоянии, предшествующем началу профилактики. Дозы повышали, пока не наступал лечебный эффект. У 20 из 68 больных активная терапия антидепрессантами не приносила облегчения, хотя в прошлом те же препараты и в тех же дозах купировали депрессивные проявления. Как правило, это наблюдалось у больных, получавших относительно высокие дозы карбоната лития (1500-1800 мг в сутки), имевших значительную концентрацию лития в крови (0,9-1,0 ммоль/л). Снижение суточной дозы карбоната лития и соответствующее уменьшение концентрации лития в плазме (оптимально до 0,5 ммоль/л) без изменения дозы антидепрессанта вызывали положительные сдвиги. Таким образом, высокая доза лития, очевидно, препятствует проявлению лечебного действия антидепрессантов. В последнее время при наступлении депрессии мы стали снижать дозу карбоната лития до 900 мг в сутки. Все эти клинические данные подтверждают, что литий не обладает антидепроссивным эффектом. Клинические наблюдения по многом согласуются с данными фармакологических экспериментов на животных. Так, в опытах по взаимодействию лития с резерпином и его производными, а также с фенамином черты сходства лития с антидепрессантами установлены не были (Михаленко И. Н., Киселева И. П., Лапин И. П., 1976). Не выявлено типичных для антидепрессантов адренопозитивного, серотонинопозитивного и холинолитического эффектов, наличие и соотношение которых определяют механизм и характер их терапевтической активности. Профилактическое действие лития обычно начинает проявляться лишь после нескольких месяцев терапии. У 1/3 больных аффективные фазы прекращаются сразу после начала лечения. Однако чаше происходит постепенная редукция депрессивных и маниакальных фаз. Наступившая после начала профилактики фаза протекает легче и менее продолжительна, чем раньше; следующая фаза — еще легче и короче — и т. д. Больные перестают поступать в стационары и даже не прерывают свою трудовую деятельность. Нами отмечались три типа постепенной редукции депрессивных состояний в последующих фазах. Первый тип— наиболее распространенный. Это постепенное гармоническое ослабление всех симптомов депрессивного синдрома, но в первую очередь — аффективного напряжения. Наблюдавшаяся в предыдущих фазах тяжелая тоска с физическим ощущением сжатия в груди сменялась легкой тоскливостью, затем просто сниженным настроением, вялостью, понижением активности, желаний и интересов, по уже без неприятного депрессивного оттенка настроения. У части больных эти облегченные фазы выражались в своеобразных астенических состояниях с повышенной утомляемостью, неуверенностью, нерешительностью, некоторой вязкостью мышления, обычно этим больным не свойственной. У значительной части больных этой группы после нескольких редуцированных фаз аффективные колебания исчезают полностью. Второй тип — распад целостной структуры фазы. Полная картина депрессии уже в первой (после начала приема лития) фазе не развертывалась, а появлялись отдельные редуцированные признаки: нарушения сна, нежелание двигаться, работать в первую половину дня. Часто все основные симптомы отсутствовали, а сохранялись мелкие второстепенные признаки или привычки, характерные для больных в прошлых фазах: например, не застилать утром постель или носить какое-то старое, обычно не употребляемое платье (по этому признаку родные больного знали, что «идет депрессия»). Такой тип преобразования депрессивной картины оказался менее благоприятным: полного исчезновения аффективных колебаний не наступало и в дальнейшем, хотя приступы заболевания стали несравненно легче. Третий тип редукции наблюдался у больных с очень затяжными и тяжелыми депрессиями в прошлом и у больных, у которых можно было предполагать неблагоприятный органический фон. У них, наряду со смягчением депрессивной симптоматики, стали проявляться или усиливаться маниакальные эпизоды. Депрессивные же фазы заменялись состояниями, которые можно назвать смешанными. Оставалось чувство тоски, но оно уже сосуществовало не с идеями малоценности, а скорее с обидой на свою судьбу, раздражительностью, идеями дурного обращения. Как правило, исчезали заторможенность и депрессивная мимика, больные часто казались даже повышенно разговорчивыми. Нередко хорошо знающие их родственники квалифицировали такой приступ как маниакальный, сами же больные говорили врачу о плохом самочувствии, просили о назначении антидепрессантов. Первый тип редукции депрессивных фаз наиболее благоприятен. При втором типе аффективные колебания еще долго продолжаются. Однако облегчение настолько очевидно, что необходимость продолжения приема лития ни возражений у больного, ни сомнении у врача не вызывает. При третьем типе редукции жизнь больного даже немного облегчается, так как отсутствие заторможенности сохраняет ему работоспособность, социальное положение, поэтому профилактическую терапию следует продолжать, упорно убеждать в этом и больных, и его родственников. Оттенок недовольства, обиды, ворчливость, которая сопутствует этим смешанным состояниям, приводят к тому, что и родственники считают прежние приступы болезни более легкими, «лучшими». Действительно, тихий, покорный, совестливый мученик легче в быту, но состояние усугубляется, и требуется госпитализация. В преобразованной же литием фазе больной, ворча на своих близких и лечащего врача, все-таки остается на работе, переносит болезненный период, не выбывая из семьи и служебного коллектива, что очень важно для сохранения социальной адаптации больного. Тщательный подсчет продолжительности депрессивных фаз у этих больных также улавливает тенденцию к сокращению, что важно использовать при психотерапевтических беседах со всей семьей. В последние годы в литературе появились описания состояний особого типа, вызванных как будто длительным приемом лития. Это — постоянное, не фазное снижение активности, снижение интересов, ярких душевных реакций, как бы легкая деперсонализация, окрашенная чувством мучительного сожаления утраты «настоящих эмоций», «настоящего восприятия действительности», как будто у этих больных снижается и уровень интеллектуальной активности. Авторами приводится богатый перечень этих проявлений. Именно богатый набор симптомов, хоть и однозначно окрашенных («дефицитарность»), позволяет усомниться, действительно ли они порождены длительным приемом лития. Мы наблюдали всего двух больных с подобными симптомами. Один из больных страдал затяжными депрессиями, до начала лечения литием фазы продолжались по два года и более. На фоне приема лития его депрессивные состояния значительно уступили но глубине аффективного напряжения, длительность же их изменилась мало. Тоска, тревога, грубые идеи самообвинения отсутствовали, некоторая же заторможенность мышления, снижение инициативы, побуждений выступили на первый план, и все это длилось в течение двух лет. При этом больной аккуратно принимал литий, а не отменив литий, состояние с равной правдоподобностью можно было расценивать как «литиевый дефект» или как затянувшуюся депрессивную фазу, напряженность симптомов которой ослаблена литием. Отменить же литий было опасно, так как в прошлом депрессии протекали очень тяжело, в анамнезе была суицидная попытка. Вторая больная до профилактики литием переносила сезонные фазы в 2-3 месяца дважды в год. Помимо тоски и других проявлений меланхолического состояния, всегда ярко выступали симптомы деперсонализации: исчезала яркость восприятия музыки, красок, содержание книг не вызывало переживаний, домашние обязанности утратили всякую привлекательность, муж, сын становились чужими. На фоне приема лития четкая сезонность (весна и осень) исчезла, депрессия появлялась в основном в зимние месяцы, но по продолжительности одна фаза равнялась двум прежним, т.е. количество месяцев болезни за год но изменилось. В период приступа отчетливо проявлялись симптомы деперсонализации, а меланхолическая симптоматика сгладилась, так что больная производила впечатление потускневшей, поблекшей эмоционально. Эти два примера иллюстрируют нашу точку зрения: специфического дефекта вследствие приема лития не возникает, описываемые как дефект картины являются казуистическими вариантами редукции депрессивных состояний под влиянием лития. Конечно, необходимо специальное, тщательное исследование большого числа подобных больных для окончательного решения вопроса о специфическом «литиевом дефекте». Но наши наблюдения, несмотря на большое количество лечившихся больных, противоречат этим утверждениям. В целом профилактика фаз маниакально-депрессивного психоза солями лития оказывается успешной у 60-70% больных. Нами с 1967 г. наблюдается группа больных (около 350 человек), принимающих карбонат лития. Из них 250 имеют достаточно подробный анамнез, чтобы провести количественное сравнение течения болезни до назначения лития и после него. Это 220 больных МДП а 21 больной циркулярной шизофренией. У 188 из них наблюдалось биполярное течение психоза, у 62- монополярное (только депрессии). Среди больных 138 женщин и 112 мужчин в возрасте от 16 до 90 лет. Длительность приема лития варьировала от 2 до 12 лет. Для оценки эффективности лития все аффективные колебания, которые были и до начала профилактики литием, и возникшие при ее проведении, регистрировались на специальной учетной карте. Количественную оценку результатов осуществляли путем сравнения у каждого больного числа фаз и их суммарной длительности за время профилактики с аналогичными показателями в течение контрольного периода до начала, равного длительности времени профилактики. Результаты приведены в табл. 13. ТАБЛИЦА № 13
В таблице суммированы месяцы болезни всех больных и все фазы. Подсчеты показывают, что основной показатель тяжести течения аффективного психоза — суммарная длительность приступов — уменьшился за время лечения на 64,8%, т.е. на 2/3. Число фаз уменьшилось лишь на 40%. Следует учесть, что мы рассматривали как фазу даже самые короткие легко выраженные периоды изменения настроения. Сходные результаты были получены А. Б. Смулевичем и Э. И. Минскером (1977). Поскольку эффективность профилактики проявляется только через много месяцев после начала приема лития, для клинициста чрезвычайно важно иметь ранние прогностические критерии. Найти четкие психопатологические признаки в картине болезни, предсказывающие успех или неуспех профилактики, пока не удалось. «Типичность» картины приступов, так же как фактор семейного отягощения, имеет очень относительное значение. Первое впечатление о том, что соли лития лучше помогают при биполярном течении, разделяют не все исследователи. Наши данные об эффективности профилактики в группе с би- и монополярным течением даны в табл. 14. При сопоставлении эффекта лития у больных этих групп учитывалось влияние профилактики только на депрессивные фазы, чтобы исключить лечебное действие лития в период мании. Как видно, достоверных различий между группами нет. ТАБЛИЦА № 14
В связи с тем, что ни симптоматика приступа, ни течение заболевания не дают достаточной информации о прогнозе лечения литием, внимание исследователей Давно обращено на выявление особенностей метаболизма у больных, реагирующих и не реагирующих на это печение. Почти сразу была установлена связь эффекта не столько с дозой карбоната лития, сколько с его концентрацией в плазме крови (Baastrup P., Schou M., 1967). Эффект профилактики лучше, если в крови, как уже говорилось, поддерживается концентрация не ниже 0,6 ммоль/л. Для достижения этой концентрации требуются разные дозы лития у разных больных, и, по нашим наблюдениям, эффект лучше там, где доза ниже. Больная И., у которой фазы не возникали 12 лет, принимала всего 600 мг карбоната лития, концентрация лития в плазме при этом была 0,6-0,86 ммоль/л. Однако и достижение оптимальной концентрации лития в плазме не всегда обеспечивает успех профилактики. Теоретически более ценным показателем должно явиться внутриклеточное содержание лития. При изучении электролитного транспорта в организме принято пользоваться в качестве модели клеточной мембраны эритроцитами. В настоящее время отработаны методики определения концентрации ионов в этих клетках и скорости прохождения их через мембрану — в клетку и из клетки — в опытах in vitro (Dunner D., Meltzer H., Fieve R., 1978). Литий пассивно проникает в клетку, из среды с большей концентрацией ионов в среду с меньшей. Выводится же он активно «литиевым насосом» (аналогично натрию) в среду с большей концентрацией против градиента. Это является существенной деталью механизма действия лития, и, наверно, определение работы «литиевого насоса» в каждом конкретном случае помогало бы судить о будущем эффекте. Однако эти определения очень трудоемки и не могут применяться в клинической практике. Оказалось, что работа «насоса», о которой судят по соотношению скорости проникновения ионов лития в клетку и скорости его выведения (эти показатели скорости, определяемые в тонких экспериментах), коррелируют с «эритроцитарным индексом», т.е. соотношением концентраций ионов лития в эритроцитах и плазме крови. Эритроцитарный индекс поэтому мог бы быть еще более достоверным показателем при оценке прогноза терапии. Этой теме посвящено много исследований. В части работ находят корреляцию между клиническими и биохимическими показателями, в части — нет. У 125 больных нашей группы, в течение 5 лет многократно определяя концентрацию лития в плазме и эритроцитах, высчитывали их соотношение (так называемый эритроцитарный индекс) и сопоставляли с эффективностью лечения (совместно с Г. Н. Златкиной). Однако ни абсолютная концентрация в эритроцитах, ни соотношение концентраций в эритроцитах и плазме с эффектом не коррелировали. Обычно содержание лития в эритроцитах составляет 1/3-1/2 содержания в плазме. Чем ближе к единице было соотношение концентраций, тем хуже в целом переносился литии, и тем чаще возникали серьезные осложнения, которые будут описаны далее. В пашей группе больных при высокой концентрации лития в клетках нарастала частота побочных действий. В связи с поисками «реакторов» и «нереакторов» на литий изучалась и скорость выведения лития с мочой. И все-таки какого-то единственного — достоверного — признака, по которому можно судить об эффективности лития, выделить не удалось, и лишь по сочетанию особенностей можно прогнозировать исход профилактической терапии. Например, если у больного наблюдается типичная клиническая картина со строго очерченными фазами, известно, что его родственники успешно лечились литием, что при дозе 600-900 мг карбоната лития у больного создалась концентрация около 0,6 ммоль/л и что после разового приема 600 мг карбоната лития за сутки с мочой выделилось менее 12 мг лития, можно с уверенностью ждать благоприятного исхода. Механизм терапевтического действия лития остается нераскрытым. Вероятно, он сложен и включает в себя много звеньев. Для практических целей важно знать, что при приеме лития возникают нарушения электролитного обмена. Искусственно вводимый в организм литий включается в деятельность «натриевого насоса» — основного механизма, обеспечивающего прохождение возбуждения по нервному волокну. Возможно, что, заменяя в клетках натрии, литий создает и более оптимальные условия для нервной деятельности и это обеспечивает его профилактический эффект. Не исключено, однако, что влияние на электролиты вызывает изменение в обмене моноаминов, и это уже является основным фактором, предупреждающим аффективные приступы. Побочные действия можно разделить на ранние и поздние. Ранние появляются обычно почти у половины больных и проходят сами собой за недели, иногда 1-2 месяца. Диспепсические расстройства. Наиболее частыми инициальными побочными явлениями были расстройства со стороны желудочно-кишечного тракта: отсутствие аппетита, ощущение переполнения желудка, боли в эпигастральной области, неприятный вкус во рту, тошнота, рвота, понос. Они в той или иной степени наблюдаются у всех больных, но постепенно проявляются все меньше и исчезают на 2-3-й неделе лечения. Приблизительно у 10% больных эти проявления не проходят, а сопутствуют приему лития много лет. Иногда больные сами находили способы, помогающие избавиться от этих нарушений: прием карбоната лития перед едой (это помогало нескольким больным, чаще его предпочитают принимать все-таки после приема пищи), запивание чем-то кислым. В части случаев, чтобы преодолеть желудочно-кишечные расстройства, пришлось прибегнуть к препаратам желудочного сока (ацидинпепсин, ацепепсол, бетацид). Известно, что карбонат лития снижает кислотность желудочного сока и обостряет анацидные гастриты, поэтому такое лечение оказалось оправданным. Оно назначалось курсами по 10 дней с 10-дневными перерывами. У части больных периодически появлялись поносы — литий оказывал острое послабляющее действие, внезапное, непреодолимое. В этих случаях помогают также препараты желудочного сока. Иногда таким больным следует разрешить 1 раз в неделю сделать пропуск в приеме лития, в этот день поесть побольше соленого. Опасно, если в связи с поносами больной назначает себе голодную (а значит, бессолевую) диету. Нарушение водного обмена. На втором месте по частоте были нарушения водного обмена. Эти нарушения появлялись иногда после нескольких лет приема лития. Часто наблюдалась жажда, сопровождающаяся обычно полиурией. В моче ни разу не было обнаружено патологических изменений, если их не находили до назначения карбоната лития. Удельный вес мочи при полиурии был низким (1,001 — 1,005). Состояния эти по проявлениям напоминали клинику несахарного диабета. Встречаются больные, выпивающие до 10 л воды в день. Пастозности, отечности (кроме области лодыжек), так же как и жалоб на сердечную слабость, не бывает, но полиурия, особенно ночная, причиняет больным большие мучения. Бороться с литиевой полидипсией трудно. Прежде всего надо стараться приучать больных не пить много, а только смачивать рот, делать глоток воды, не больше, объяснять им вред поглощения больших количеств жидкости. Можно уменьшить жажду, разбив суточную дозу лития на большее число приемов и соответственно уменьшив разовую дозу. В тяжелых случаях иногда эффективными были небольшие дозы (50 мг) гипотиазида по утрам, иногда финлепсин (тегретол 200 мг) вечером. Назначение средств, применяемых при лечении несахарного диабета, результатов не дает. Применяя салуретик гипотиазид и любые другие препараты, цель которых — воздействовать на диурез, необходимо помнить, что этим можно нарушить установившийся баланс электролитов, изменить концентрацию лития в крови. Назначая салуретики, необходимо часто определять содержание лития в плазме, тщательно прислушиваться к соматическим жалобам, чтобы не пропустить интоксикацию. Нарушения со стороны центральной нервной системы. Побочные явления со стороны центральной нервной системы выражались чаще всего в легком треморе пальцев, двигательной атаксии, мышечной слабости, дизартрии, чувстве легкой оглушенности. Известно, что тремор, вызванный солями лития, не купируется антихолинергическими средствами. Приходилось советовать больным приспосабливаться к нему и ждать его спонтанного исчезновения. Действительно, он исчезал иногда через много месяцев после начала приема карбоната лития. Если тремор настолько выражен, что мешает и профессиональной деятельности, и самообслуживанию, можно прибегнуть к назначению препаратов: обзидана (анаприлина) по 10 мг 3 раза в день курсами по 10 дней, и с десятидневными перерывами; трийодтиронина (по 60 мкг в сутки). Иногда облегчение приносят внутримышечные инъекции витамина В6. Тремор рук возникал у больных с различной концентрацией лития в крови, в том числе и с низкой (меньше 0,6 ммоль/л). Такие же явления, как атаксия, дизартрия, оглушенность, обнаруживались при относительно высоких показателях содержания лития в плазме крови: 1,0-1,4 ммоль/л. Часто эти симптомы проявлялись у больных, которые при суточной дозе 1500 мг карбоната лития имели в крови концентрацию лития ниже 0,6 мэкв/л, а при повышении дозы на 300 мг в сутки наступал резкий подскок концентрации до указанных выше цифр. В этих случая; необходимо снизить суточную дозу наполовину, а затем увеличивать ее очень постепенно, по 150 мг в сутки раз в 5-6 дней. Реже отмечались такие побочные явления, как отек в области лодыжек, отек лица, напоминающий аллергические отеки, кожный зуд. К поздно проявляющимся побочным эффектам относятся: а) явления гипотиреоза, б) изменения электрокардиограммы, в) пародонтоз с выпадением зубов, г) резкое увеличение массы тела. Гипотиреоз. Уже в 1967 г. М. Schou (1967) сообщал о большой частоте образования зоба у больных принимающих литий. Зоб развивался как на фоне эутиреоза, так и при понижении функции железы. Свойство лития подавлять гормональную деятельность щитовидной железы стали в дальнейшем использовать при лечении тиреотоксикоза (Петрова Н. С, Риффель Л. А., 1975). В нашей группе из 250 больных у 17 (6,8%) были клинические признаки нарушения функции щитовидной железы. У 13 был обнаружен зоб: в 5 случаях узловатый и в 8 — диффузный. У 2 из этих больных до начала лечения литием были легкие признаки гипертиреоза. У других двух больных с диффузным зобом были яркие проявления гипотиреоза (отечность и уплощение черт лица, редкий пульс, сухая шелушащаяся кожа, вялость, сонливость). Еще у 4 больных появились начальные явления микседемы без зоба. Поскольку об активности щитовидной железы судят по интенсивности йодного обмена, мы исследовали у 123 больных поглощение железой радиоактивного йода. У 90 были обнаружены отклонения от нормы. Поглощение иногда составляло всего лишь 1,1- 0,5% через 24 ч, т.е. железа почти не захватывала вводимый йод. Часто эти низкие цифры никак не проявлялись клинически, и мы не только не прибегали к гормональному лечению; но даже не снижали дозы лития. Только при симптомах гипотиреоза и в случаях, когда при низких показателях поглощения йода обнаруживались также высокий холестерин и увеличение массы тела, мы назначали гормональные препараты: тиреоидин по 0,1 3 раза или трийодтиронин по 10 мкг 3 раза. Лечение продолжалось обычно 1,5-2 месяца. В результате наступало даже рассасывание зоба. Только одна больная по собственной инициативе прекратила прием лития, у всех остальных деятельность щитовидной железы удалось нормализовать при продолжающемся приеме лития. Таким образом, при лечении карбонатом лития необходимо учитывать возможности влияния этого препарата на щитовидную железу, при осмотре больных пальпировать их шею, а раз в 1,5 года проводить хотя бы одно из доступных исследований функции железы. Изменения ЭКГ были отмечены также вскоре после широкого внедрения лития в лечебную практику. Нами были подвергнуты анализу ЭКГ 95 больных-, много лет принимающих литий (оценка проводилась канд. мед. наук Л. Г. Гепштейн). Были найдены изменения, аналогичные приводимым в литературе. Чаще всего это уплощение волны Т, иногда до слияния с изолинией; встречается и отрицательная волна Т, и двухфазная. Эти изменения ЭКГ, судя по соматическому состоянию больных, не связаны с органическими изменениями в сердечной мышце и не требуют специфической терапии. Эти нарушения обратимы. Однако больным, длительно принимающим литий, необходимо делать ЭКГ не реже раза в год, чтобы своевременно выявить возникновение интеркуррентного заболевания сердца. Увеличение массы тела чаще, чем другие осложнения, приводит к тому, что больные вопреки совету врача перестают принимать литий. Почти всегда увеличение массы тела сочетается с полиурией, полидипсией, и борьба с ней должна быть комплексной, но при этом следует помнить, что методы лечебного голодания при приеме лития противопоказаны. Выпадение зубов вследствие хронического пародонтоза иногда наблюдается у больных, принимающих литий более 10 лет. Имеется ли причинная связь между пародонтозом и действием лития, до сих пор точно не установлено. Интоксикация солями лития развивается при пере дозировке и повышении концентрации лития в плазме до 1,4-1,6 ммоль/л. Часто больные плохо переносят концентрацию выше 1,0-1,2 ммоль/л. Другая причина интоксикации — повышенная чувствительность, в основном нервной системы, даже к более низким концентрациям лития, что бывает у больных с органическим поражением ЦНС. Интоксикация характеризуется нарушением сознания, иногда до комы, повышением мышечного тонуса и сухожильных рефлексов, в некоторых случаях наблюдается ригидность мускулатуры. Возникают судорожные подергивания рук и ног. Такие приступы длятся секунды или полминуты, возникают как спонтанно, так и в ответ на прикосновение или даже оклик. Большие эпилептиформные припадки наблюдались у этих больных редко. В ряде случаев возникали несимметричные неврологические симптомы с патологическими рефлексами, что иногда заставляло предполагать инсульт. Функция почек у этих больных, а также ЭКГ почти не нарушались, а если изменения все же наступали, то они были обратимыми. При регулярном наблюдении за больными и определении концентрации лития в плазме выраженная интоксикация не встречается. Специфического лечения интоксикации литием не существует. В связи с тем, что выведение лития замедляется при недостатке натрия в организме, первое время рекомендовалось вводить большие количества солей натрия. Однако исследования выведения лития с мочой показали, что соли натрия не ускоряют его. Введение хлорида калия также не сказывалось на изменении литиевого клиренса. Клинического улучшения эти меры также не давали. Предполагается, что ускорить выведение лития могут аминофиллин (эуфиллин), бикарбонат натрия и мочевина, но эти предположения подкреплены очень малочисленными наблюдениями. В настоящее время лечение интоксикаций проводится как симптоматическое и предупреждающее развитие основного осложнения — пневмонии, которая является наиболее частой причиной смерти при интоксикации литием. Имеются сообщения о хорошем действии внутривенного вливания валиума (седуксена). Наиболее эффективным методом является гемодиализ. Интоксикация развивается постепенно, и при внимательном наблюдении за больным всегда можно заметить ее первые проявления и снизить дозу лития до того, как состояние потребует применения реанимационных мер. За все 12 лет применения нами лития у 350 больных было не более 5 случаев, когда пришлось прибегнуть к капельному введению дезинтоксикационпых средств. Таким образом, профилактика аффективных фаз карбонатом лития может считаться достаточно эффективным и безопасным методом при правильной его организации и контроле. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
ГЛАВА 10 СИСТЕМНЫЙ ПОДХОД И КЛАССИФИКАЦИЯ ДЕПРЕССИВНЫХ И ДЕПЕРСОНАЛИЗАЦИОННЫХ СОСТОЯНИЙ |
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
С точки зрения традиционной психиатрии значение депрессии и деперсонализации несравнимо: первая рассматривается как самостоятельная болезнь или синдром, вторая — как симптом. Поэтому существующие классификации деперсонализации основаны либо на чисто феноменологическом принципе (ауто-, сомато — и аллопсихическая деперсонализация), либо на том, в рамках какого заболевания она встречается (шизофреническая, депрессивная, невротическая, органическая) (Смулевич А. Б., Воробьев В. А., 1973). Попытки классифицировать депрессию основаны на представлении о ней как о самостоятельном заболевании (или группе заболеваний). Однако данные, приведенные в гл. 2, показывают, что состояния психотической депрессии в рамках различных нозологических форм имеют одни и те же патогенетические механизмы. Эти механизмы заключаются в замене отрицательной обратной связи в регуляции системы «моноамины мозга — глюкокортикоиды» положительной, т. о. установлением «порочного круга»: «мало моноаминов — много глюкокортикоидов, много глюкокортикоидов — мало моноаминов» и т. д. Очевидно, депрессия как специфическое патологическое состояние возникает тогда, когда устанавливается такая система нарушенной регуляции. Подобное нарушение регуляции может возникнуть в результате первичной существенной неполноценности каких-то звеньев (вероятно, ферментативных, участвующих в обмене моноаминов). Тогда потребуется лишь ничтожное давление внешних факторов, чтобы привести к декомпенсации всей этой системы. В других случаях регуляция нарушается вследствие чрезмерного по силе и длительности стресса. В этом случае эндогенная предрасположенность может быть минимальной. Однако чрезмерная реакция стресса может быть обусловлена рядом экзогенных и эндогенных факторов: тяжестью стрессора — например, психотравмирующей ситуации, индивидуальным порогом чувствительности к данному стрессору. Очевидно, для людей с тревожно-мнительным характером этот порог будет низок, и различные житейские трудности, которые более или менее легко преодолеваются другими людьми, для них явятся чрезмерными и приведут к декомпенсации. Снижение этого порога может быть обусловлено и возрастом, что, вероятно, является одним из факторов, обусловливающих большую частоту депрессий в старости. С другой стороны, различные органические поражения и неполноценность ЦНС, па-пример обусловленные атеросклерозом сосудов головного мозга, тяжелыми инфекционными заболеваниями или врожденные, могут быть причиной того, что для обеспечения нормальной деятельности мозг должен работать на «аварийном режиме», с постоянным перенапряжением, т.е. по существу находиться в состоянии хронического стресса, который рано или поздно может привести к той же декомпенсации регуляторной системы, т.е. к депрессии. Именно этим фактом, Очевидно, объясняется повышение вероятности МДП у людей, перенесших в детстве тяжелые инфекции с мозговой патологией, а также большую частоту депрессий в старости и при атеросклерозе сосудов мозга. Повышение вероятности возникновения депрессии при наследственной отягощенности олигофренией эпилепсией и другими органическими заболеваниями, вероятно, частично связано с той же причиной. Дексаметазоновый тест показывает, что один и тот же
комплекс патогенетических механизмов характерен для депрессивных состояний в
рамках биполярного и монополярного МДП, шизофрении, органического и
инволюционного психозов. Таким образом, эти патогенетические механизмы и
психопатологические явления образуют единый блок, или регистр (по
терминологии Крепелина). Этот блок может выступать как единственное или
основное нарушение (в этом случае заболевание определяется как «эндогенная
депрессия») или быть включенным в структуру психоза наряду с другими
регистрами, например депрессивно-параноидный синдром в рамках шизофрении с
тяжелой тоской и галлюцинаторно-бредовой симптоматикой. Если этот
депрессивный регистр возникает в глубокой старости или при выраженных
психических и неврологических проявлениях сосудистого заболевания головного
мозга, то депрессивная симптоматика будет сочетаться с присущими этим
заболеваниям нарушениями памяти, интеллекта, слабодушием. Но во всех этих
случаях депрессивная симптоматика будет выступать как единый
симптомокомплекс, обусловленный специфическими патогенетическими механизмами,
а не как отдельный симптом сниженного настроения. Если же сниженное
настроение выступает как симптом в рамках других нарушений, то
дексаметазоновый тест не обнаруживает отклонений. Таким образом, реактивное состояние сменяется психотической депрессией в тот момент, когда отрицательная обратная связь в регуляции системы «моноамины мозга — глюкокортикоиды» сменяется положительной обратной связью, т.е. образованием «порочно го круга». При этом нарушается подавление секреции глюкокортикоидов дексаметазоном (патологический дексаметазоновый тест). Приведенные данные позволяют рассмотреть классификацию депрессивных состояний под несколько иным углом зрения. Как известно, первоначально концепция Э. Крепелина о маниакально-депрессивном психозе объединила в единую группу все психотические формы депрессии при том условии, что депрессивная симптоматика составляет основное содержание болезненного состояния и не включена в рамки какой либо другой нозологической единицы — шизофрении, органических психозов и т. п., что можно установить по течению психоза и по наличию других психопатологических проявлений. В отечественной психиатрии это понимание МДП сохраняется и по настоящее время, в ряде западных стран чаше стал употребляться термин «эндогенная депрессия». В последние годы стали делаться многочисленные попытки дробления эндогенной депрессии. По характеру течения были выдвинуты две формы, рассматриваемые часто как самостоятельные заболевания: монополярная депрессия и биполярный МДП. В табл. 15 приведены собственные и литературные данные, по которым обе формы обнаруживают существенные различия. Помимо перечисленных различий, имеется и ряд других, однако подтвержденных не во всех исследованиях или нуждающихся в проверке. Как указывалось раньше, между монополярной и биполярной формами эндогенной депрессии не существует четкой грани, поскольку при большом количестве перенесенных депрессивных фаз обычно начинают появляться и маниакальные эпизоды, хотя бы кратковременные. ТАБЛИЦА №15
Н. Lehmann (1977) приводит различные критерии, используемые для группировки депрессивных состояний: наличие или отсутствии психотравмирующего фактора, связанного с началом депрессии (т. е. реактивная — эндогенная депрессия); наличие соматической провокации, возникновение депрессии при соматическом заболевании (например, атеросклерозе мозговых сосудов, раке), возникновение депрессии вследствие медикаментозного воздействия (резерпин, кортикистероиды, противозачаточные средства и др.); наличие предшествующих эпизодов другого психического заболевания, сочетание депрессии с другим «функциональным психозом», т.е. шизофренией, позднее или раннее начало и т. д. На основании этих критериев психотические депрессии подразделяются на первичные и вторичные (к последним относятся депрессии, возникающие в рамках шизофрении или других психозов, вследствие нервных и соматических заболеваний, лекарственных воздействий и т. д.), функциональные (эндогенные, психогенные вторичные в рамках шизофрении) и органически-токсические (соматогенные — при органических, сосудистых, инфекционных заболеваниях ЦНС и симптоматические — при лекарственных воздействиях). Выделяются также психогенные (малые) депрессии (реактивная и невротическая) и эндогенные. Грани между этими группами весьма нечетки, и по существу различные формы депрессий можно представить как переходы в едином континууме. Схема P. Kielholz (1970) иллюстрирует такой подход. В ней все депрессивные состояния по глубине поражения (от психогенных, на невротическом уровне, до органических, предполагающих относительно грубые поражения мозга) представлены в едином ряду. В основу различных принципов группировки, представленных выше, положен причинный фактор, иногда клинический (биполярный — монополярный МДП) и редко патогенетический (попытка разделить депрессии на серотониндефицитные и норадреналиндефицитные). При группировке депрессивных состояний нам представляется крайне важным учитывать характер их развития. В одних случаях депрессия возникает и без внешних толчков, и без предшествующего состояния тревоги, напряжения, соматических нарушений, а если такой период бывает, то он непродолжителен (несколько дней или часов), и психические и соматические проявления тревоги менее интенсивны. Такие фазы чаще наблюдаются при биполярном течении психоза, при раннем дебюте монополярной депрессии, при более массивной наследственной отягощенности типичным МДП у лиц с гипертимным характером и пикнической конституцией. В других случаях депрессии предшествует длительный (иногда многомесячный и даже многолетний) период тревоги, фобий, бессонницы, различных соматических проявлений (миозиты, радикулиты, колиты, другие спастические явления, боли, сенестопатии и т. п.). Иногда в этот период преобладают соматические, иногда психические проявления тревоги: фобии, ипохондрические идеи, идеи отношения, особого значения и др., но обычно и те и другие симптомы сочетаются. Эти продромальные явления всегда протекают со сниженным настроением. Поэтому они часто квалифицируются как приступы эндогенной депрессии: инволюционная меланхолия, фаза МДП, «замаскированная депрессия». Основанием для такого диагноза является депрессивное настроение. Однако, как показывают результаты диазепамового теста, терапии различными, психотропными средствами и дексаметазоновый тест, в значительной части подобных состояний психотической депрессии еще нет: больные хорошо лечатся противотревожными средствами, например феназепамом, а антидепрессанты нередко обостряют состояние, и их приходится сочетать с тизерцином, хлорпротиксеном и другими «седативными» нейролептиками, диазепамовый тест показывает полную или значительную редукцию симптоматики, при дексаметазоновом тесте обнаруживается нормальный процент подавления секреции 11-ОКС, по их исходный уровень высокий. Таким образом, эти состояния нельзя считать депрессией, по существу они являются состояниями психотической тревоги со сниженным настроением. В ряде случаев они могут «перейти» в настоящую депрессию, в других — развиваться в сторону усиления тревожно-ипохондрической или тревожно-бредовой (идей отношения, преследования и т. п.) симптоматики; возможно также возникновение деперсонализации. Очевидно, значительная часть случаев так называемой «замаскированной депрессии», «депрессивных эквивалентов» и является подобными состояниями хронической или приступообразной тревоги с массивными соматическими проявлениями. Поэтому говорить здесь о «замаскированной депрессии» нет смысла, поскольку депрессии нет или, во всяком случае, еще нет и соответственно «маскировать» нечего. Подобное развитие наблюдается чаще при поздней монополярной депрессии, у лиц с тревожно-мнительным характером, особенно у женщин. Преморбид таких больных напоминает описанный в гл. 9 анамнез больных деперсонализацией. Однако деперсонализации обычно развивается после приступа острой тревоги, вызванного либо эндогенными причинами, либо интенсивным, отрицательным психогенным воздействием. а депрессия чаще возникает как результат длительного напряжения. То, что дебют почти всех случаев деперсонализации и части депрессивных состояний связан во времени со стрессом, с психическими и соматическими проявлениями тревоги, позволяет поставить вопрос об их целесообразности с точки зрения поддержания гомеостаза. В пользу этого говорит и то обстоятельство, что, несмотря на значительную наследственную предрасположенность, эндогенная депрессия не только не элиминировалась в процессе эволюции, а даже проявляет тенденцию к нарастанию. Данные, приведенные в гл. 8, показывают, что защитная роль деперсонализации в период крайне интенсивной тревоги, тяжелого психогенного стресса по вызывает сомнения: снимая, точнее блокируя, непереносимое аффективное напряжение, лишая поступающую в сознание информацию ее эмоционального, чувственного компонента, деперсонализация предотвращает дезорганизацию психических процессов, предотвращает возможность соматической катастрофы, которая может быть обусловлена неконтролируемой реакцией стресса. В этом отношении образ «окаменевшей от горя матери, трагически потерявшей единственного ребенка», стал своего рода литературным штампом. Описания бывших узников фашистских лагерей смерти показывают, что именно эти «окаменелость», «бесчувствие» помогли некоторым из них выжить в непереносимых условиях постоянного нечеловеческого напряжения. Наконец, мы наблюдали больных с развивающимся острым чувственным бредом, сопровождавшимся нарастающей тревогой, страхом, дезорганизацией мышления, повышением артериального давления, уровня сахара крови и т. д., у которых появление деперсонализации приводило к затуханию психических и соматических проявлений стресса. Значительно труднее выявить приспособительную роль депрессии. В этом отношении представляет интерес проведенное совместно с Н. Г. Клементовой исследование артериального давления у больных эндогенной депрессией с гипертонической болезнью в анамнезе. За период обследования в двух отделениях (женском и мужском) городской психиатрической больницы № 2 было 19 таких больных (17 женщин и 2 мужчины) в возрасте от 36 до 70 лет (в среднем — 61 год). У 5 больных МДП характеризовался биполярным течением, у 14 — мопополярным, у 15 — первая фаза возникла после 50 лет, у 2 — в 47 лет и лишь у 2 больных — раньше 40 лет (в 36 и 21 год). У этих больных до наступления данной депрессивной фазы была диагностирована гипертоническая болезнь I—II стадии, причем у 18 заболевание гипертонией предшествовало возникновению первого приступа МДП, и лишь у 1 больного психоз начался раньше. Сопоставлялись средние цифры артериального давления в светлом промежутке, предшествовавшем депрессии, и показатели на 2-й день госпитализации (до назначения психотропных средств). У 17 на 19 больных артериальное давление в период депрессии снизилось или полностью нормализовалось, и лишь у 2 больных с биполярным течением психоза изменение артериального давления не наступило или было незначительным. У 11 больных в светлом промежутке отмечались гипертонические кризы, однако в период депрессии они не возникли ни у одного больного. Средние показатели систолического давления в светлом промежутке составляли 172,6 ±4,4 мм рт. ст., в депрессии — 136 ± 5,6 мм рт. ст. (р < 0,001), а диастолического — 101 ± 3,1 и 86 ±4,1 мм рт. ст. соответственно (р<0,01). Таким образом в депрессии показатели систолического давления в среднем снизились на 21%, а диастолического — на 15%. Эти данные требуют дальнейшего изучения, однако они указывают на стабилизирующую роль эндогенной депрессии в отношении гипертензии и гипертонических призов. Как указывалось выше, все эти данные позволяют поставить вопрос о приспособительном значении депрессии и деперсонализации. Если для исследователей, воспитанных в традициях медицины конца прошлого и начала нынешнего века всякая патологическая реакция прежде всего рассматривалась как нарушение нормальной функции, как непосредственный результат действия вредности, то после работ Г. Селье и Н. Винера стало более естественным пытаться обнаружить в ее основе защитные приспособительные механизмы. Как известно, весь организм в целом и мозг являются очень большими саморегулирующимися гомеостатическими системами функционирующими по принципу отрицательной об ратной связи. Всякое воздействие, грозящее нарушить гомеостаз этой системы, вызовет противореакцию, направленную на восстановление гомеостаза. Если компенсаторная реакция окажется чрезмерной (например, вследствие слишком сильного и длительного повреждающего воздействия), то она сама может нарушить, гомеостаз и, в свою очередь, вызвать компенсаторную реакцию второго порядка, направленную против возникших при первой защитной реакции отклонений и т. д. Чем сложнее саморегулирующаяся система и чем более высокий уровень гомеостаза необходим для ее нормального существования, тем менее вероятно, что повреждение какого-либо механизма проявится однозначными признаками выпадения его функции. Наоборот, в этом случае такая система ответит каскадом последовательных компенсаторных реакций, причем на выходе будут обнаружены типовые, достаточно неспецифические реакции п-го порядка. Исходя из этих представлений, можно предположить, что в основе психопатологической симптоматики лежат целесообразные, с точки зрения поддержания гомеостаза, реакции. Функция мозга заключается в обработке информации и основанной на ней регуляторной деятельности. Нарушение этой функции может быть вызвано разнообразными поломками в центральной нервной системе: органическими повреждениями различных структур мозга, нарушением метаболизма, дефицитом биологически активных веществ, интоксикацией и т. д. С другой стороны, нормальная деятельность мозга может быть нарушена за счет чрезмерной нагрузки: массивного потока значимой информации, которую он не в состоянии полностью воспринять и обработать. Учитывая большие компенсаторные возможности центральной нервной системы, следует предположить, что во втором случае нарушение функции мозга может быть обусловлено какими-то наследственными или приобретенными дефектами, которые проявляются в условиях предельной нагрузки. Таким образом, нарушения деятельности мозга самого различного происхождения могут иметь одно и то же следствие: мозг перестает справляться с функцией адекватной обработки поступающей информации. В таком случае можно ожидать, что и первая компенсаторная реакция окажется однозначной и будет направлена на активацию деятельности мозга, т.е. первым этапом компенсации окажется реакция стресса. Если первичная поломка будет нарастать и окажется настолько значительной, что активация будет не в состоянии восстановить нормальное функционирование мозга, то сама реакция стресса может достичь такой интенсивности и продолжительности, что станет не совместимой с нормальным существованием организма. Иначе говоря, сама защитная реакция в этом случав создаст угрозу сохранению гомеостаза. Действительно, при крайне тяжелых стрессорных состояниях и не-редко в дебюте психоза возникают интенсивная тревога, растерянность, дезинтеграция психической деятельности, а также различные соматические нарушения: гипертензия, повышение свертываемости крови и т. п. В этих случаях защитные реакции могут стать опасными для самого существования организма. Поэтому следует ожидать, что для компенсации этих нарушений возникнут защитные реакции второго порядка, целесообразность которых будет заключаться в снижении нагрузки, падающей на мозг. На основании изучения проявлений психозов можно выделить как минимум 3 типа таких компенсаторных реакций второго порядка: 1) общее снижение психической активности, замедленно темпа мышления, повышение порогов чувствительности и как следствие — ухудшение регуляторной функции мозга; 2) уменьшение притока информации; 3) уменьшение или полное блокирование восприятия эмоционального компонента информации, поступающей в сознание, поскольку именно эмоциональная значимость информации определяется способность вызывать стресс. Первая из перечисленных защитных реакций является самой неспецифической и в большей мере, чем остальные, затрагивает весь организм и целом, Вторая — более специфична и касается, в основном, лишь психической деятельности, третья — ограничивается только эмоциональной сферой и является в этом смысле самой прицельной и «человеческой» из всех трех. Депрессия вполне соответствует 1-му типу реакции она может возникнуть по описанным уже механизмам — чрезмерный стресс увеличивает оборот моноаминов мозга и приводит к уменьшению их содержания в мозге. Когда происходит падение концентрации серо тонина и норадреналина в некоторых отделах мозга ниже определенного предела, «красной черты», то нарушается центральная регуляция секреции глюкокортикоидов и устанавливается порочный круг «дефицит моноаминов мозга — гиперкортицизм», который является одним из существенных патогенетических механизмов депрессии. Вероятно, патологический процесс поддерживается и другими системами положительной обратной связи, в частности системой «дефицит норадреналина в мозге — гиперадреналинемия и симпатотония на периферии» (Бару А. М., 1070; Нуллер Ю. Л., 1970). Легкость включения патологической системы положительной обратной связи, т.е. уровень «красной черты», определяется устойчивостью входящих в нее звеньев: при значительной наследственной предрасположенности эта система включается и ответ на незначительное и даже не улавливаемое давление стресса (спонтанный дебют психоза), в других случаях требуется длительный период интенсивного стрессорного напряжения. Этот фактор представляется важным для прогнозирования течения и классификации депрессивных состояний. 2-я реакция, по существу, является «сенсорной аутодепривацией» и, вероятно, лежит и основе аутизма и других проявлений «типичной» шизофрении. 3-я реакция соответствует деперсонализации, психическому отчуждению. В этом смысле деперсонализация может быть определена как снятие, блокирование чувственного, эмоционального компонента информации, поступающей в сознание. Защитная целесообразность и преимущество деперсонализации заключаются в том, что, лишая информацию ее эмоционального («стрессогенного») компонента, она не нарушает процесс мышления, не вызывает ни психической, ни двигательной заторможенности, не препятствует поступлению необходимой для нормального функционирования информации. Однако при определенных условиях сама деперсонализация становится тяжелым психопатологическим симптомом. Представление о «регистрах», «блоках» или «типовых реакциях» делает понятными и динамику психозов, и структуру психопатологических состояний: так, по море углубления патологического процесса могут последовательно истощаться компенсаторные возможности отдельных «регистров», что приводит к «включению» других. Нередко психоз дебютирует типичной меланхолией (что было описано еще Пинелем и Эскиролем), а затем присоединяется галлюцинаторно-параноидная симптоматика с постепенным нарастанием аутизма и исчезновением основных проявлений депрессии. Отдельные регистры могут одновременно сосуществовать, и характер индивидуальной психопатологической картины в значительной степени определяется соотношением «включившихся» регистров и выраженностью аффективного напряжения. Основанное на характере динамики «включения» депрессии разделение депрессивных больных имеет практическое и теоретическое значение. По этому признаку можно выделить 2 полярные группы: 1-я характеризуется возникновением депрессии на фоне полного здоровья, у больных 2-й группы депрессии предшествует более или менее длительный (от нескольких недоль до многих лет) период нарастания тревоги, ее психических и соматических проявлений: собственно тревоги как отдельного симптома, напряжения, вегетативных сдвигов, таких как гипертензия, тахикардия, повышение мышечного тонуса, повышение уровня кортикоидов, адреналина, сахара крови и т. д. Эти симптомы в значительной мере могут рассматриваться как проявлении стресса. Подобные состояния в связи с развитием депрессии подробно описаны Ф. Б. Березиным (1970) и связаны с нарушениями на уровне гипоталамуса. Типичный анамнез таких больных был описан выше, иногда он напоминает анамнез описанных Маньяном «дегенерантов». Сопоставление этих двух групп выявляет следующие различия: Для 1-й группы характерны следующие признаки: депрессивная фаза начинается со сниженного настроения и с уменьшения психической, а также моторной активности; фазы четко очерчены, относительно чаще характеризуются меланхолическим синдромом, реже бывают затяжными; заболевание дебютирует обычно в молодом или среднем возрасте, течение часто биполярное (подавляющее число больных с биполярным МДП относится к этой группе); в межпристунных периодах больной ощущает себя психически здоровым, антидепрессанты чаще оказываются эффективными, профилактическое действие солей лития хорошо выражено. Для больных 2-й группы свойственно постепенное начало депрессии с тревоги, фазы очерчены менее четко, чаще протекают с тревожно-депрессивным, депрессивно-деперсонализационным или (по внешним про явлениям) с депрессивно-ипохондрическим синдромами, относительно чаще бывают затяжными, депрессия дебютирует обычно в пожилом, реже — среднем возрасте, характеризуется монополярным течением («поздняя монополярная депрессия»). Если все же формируется биполярное течение, то после большого числа депрессивных состояний, причем фазы обычно бывают сдвоенными. В межпристунных промежутках больные не чувствуют себя выздоровевшими, так как в эти периоды проявляются черты тревожности, иногда обсессии, вегетосоматические нарушения и т. д. (как указывалось в гл. 6, это создает большие трудности в лечении), антидепрессанты менее эффективны, лучше действуют антидепрессанты с выраженным транквилизирующим компонентом действия. Отчетливый положительный эффект часто дают такие транквилизаторы, как феназепам, особенно на начальных этапах развития депрессивного приступа. Иногда в самом начале неглубокого депрессивного состояния положительное действие оказывает релаксирующая психотерапия (Cerny M., Cerna H., 1978). Профилактическое действие солей лития менее выражено. Иногда приступы депрессии предотвращаются длительным приемом транквилизаторов. Среди больных 2-й группы преобладают женщины. Приведенная группировка имеет практическое значение, определяя прогноз терапии, профилактики и спонтанного течения болезни. Эта группировка имеет некоторое сходство с разделением депрессий на первичные и вторичные, однако единственным критерием для такого разделения является наличие или отсутствие в прошлом других психических заболеваний и нарушений, включая асоциальное поведение без анализа развития аффективного пси-юза (Robins E., Guze В., 1972). У больных 2-й группы часто возникает и деперсонализационная симптоматика, обычно после появления тревожно-депрессивных состояний. У некоторых больных со сходными преморбидными чертами (иногда еще более утрированными) деперсонализация в чистом виде возникает сразу, без предшествующих депрессивных состояний. Вероятно, как предлагают некоторые авторы, для таких случаев применим термин «деперсонализационная болезнь». Депрессивные состояния, отнесенные ко 2-й группе, в значительная часть случаев «деперсонализационной болезни» возникают на фоне и как следствие развития состояний тревоги, достигающих психотического уровня. Поэтому 1-ю группу депрессивных состояний можно условно обозначить как «чистую эндогенную депрессию», а 2-ю — как тревожно обусловленную или «анксиогенную психотическую депрессию». Депрессия и деперсонализация являются неспецифическими в отношении этиологии типовыми запрограммированными патологическими реакциями («регистрами»), имеющими, однако, определенное приспособительное значение. Эндогенная депрессия, в значительной степени генетически обусловленное заболевание, которое не только не элиминировалось из популяции за тысячелетнюю эволюцию человека, но даже проявляет отчетливую тенденцию к учащению. Среди причин этого указывают на резкое усиление напряженности и ритма жизни в индустриально развитых странах, что подтверждается данными о роли хронического эмоционального стресса в возникновении депрессии и об участии биохимических механизмов тревоги в «запуске» депрессии, поэтому профилактика депрессии и деперсонализации у значительной части больных должна заключаться в профилактике и лечении тревоги. Исходя из представления о депрессии как компенсаторной реакции на тревогу, Ф. Б. Березов (1970) обосновал применение транквилизаторов для ее лечения на ранних этапах. Очевидно, в случаях «чистой эндогенной депрессии», при которых обнаруживается более значительная наследственная отягощенность, имеется генетически обусловленная неполноценность тех же механизмов, которые в экстремальных условиях включают компенсаторные реакции, лежащие в основе депрессии. Патология этих механизмов приводит к тому, что порог их устойчивости крайне низок и депрессия может возникнуть без видимых внешних причин. Учащение депрессии находит обоснование в концепции В. М. Дильмана (1974), согласно которой с возрастом повышается порог чувствительности гипоталамуса к гомеостатическому ингибированию. В результате нарушается регуляция и увеличивается секреция ряда гормонов, в том числе глюкокортикоидов. Это может создать предпосылки для возникновения депрессии, при которой, как показывают данные дексаметазонового теста, порог чувствительности к тормозящему действию глюкокортикоидов резко возрастает. В этом смысле эндогенная депрессия наряду с атеросклерозом, диабетом и др. может быть отнесена к так называемым болезням компенсации (Дильман В. М., 1974), которые встречаются все чаще в связи с увеличением продолжительности жизни. Все вышеизложенное указывает на необходимость комплексного мультидисциплинарного изучения депрессии и деперсонализации и интенсивного поиска принципиально новых методов их терапии и профилактики. |
|||||||||||||||||||||||||||||||||||||||||||
|
СПИСОК ЛИТЕРАТУРЫ |
|
||||||||||||||||||||||||||||||||||||||||||
|
Абакумов В. М-, Вихляев Ю. И. К вопросу о специфичности потенцирования действия барбитуратов и фенамина антидепрессантами. — В кн.: Современные психотропные средства. М., 1970. В. 3, с. 63-70. Авербух Е. С. Депрессивные состояния. Л., 1962. Авруцкий Г. Я., Громова В. В., Зайцев С. Г. Лечение депрессий пиразидолом. — Журн. невропатол. и психиатр., 1975, в. 5, с. 734-741. Александровский Ю. А. Состояния психической дезадаптации и их компенсация. М., 1976. Варкая Д. В. О патоморфозе клинической картины МДП под влиянием антидепрессантов (мелипрамин, тизерцин) и нейролептиков. — В кн.: Фармакологические основы антидепрессивного эффекта. Л., 1970, с. 163-165. Вару А. М. Катехолампновые механизмы в патохимической структуре и фармакологическом контроле депрессивных состояний. — В кн.: Фармакологические основы антидепрессивного эффекта. Л., 1970, с. 57-61. Варштейн Е. И., Нуллер Ю. Л. Некоторые клинические особенности затяжных депрессий в позднем возрасте, резистентных к терапии. — В кн.: Тер. резистентность при шизофрении и аффективных психозах. Л., 1975, с. 39-44. Барштейн Е. И., Точилов В. А. Лечение депрессивных состояний пиразидолом. — В кн.: Новые лекарственные препараты. Экспресс-информация. М., 1978. В. 5, с. 16-23. Березин Ф. Б. Соотношение транквилизирующего и антидепрессивного эффекта антидепрессантов и психосоматическая и психовегетативная интеграция. — В кн: Фармакологические основы антидепрессивного эффекта. Л., 1970, с. 147-150. Вирюкович П. В, Патофизиологическая характеристика больных маниакально-депрессивным психозом и пути профилактики его приступов. Киев, 1958. Вальдман А. В., Козловская М. М., Медведев О. С. Фармакологическая регуляция эмоционального стресса. М., 1979. Васильев В. 3., Нуллер Ю. Л. Связь психогенных провоцирующих факторов с особенностями личности у больных маниакально-депрессивным психозом. — В кн.: Проблемы медицинской психологии. Л., 1976, с. 72-74. Вихляев Ю. И., Вороника Т. А. Фармакология феназепама. — Экспресс-информация. Новые лекарственные препараты. М., 1978, № 3, с. 2-6. Вовик Р. Я., Аксенова И. О., Свердлов Л. С. Использование депривации сна в целях терапии затяжных депрессивных состояний. — Журн, невропатол. и психиатр., 1979, в. 4, с. 449-453. Нильман В. М. Эндокринологическая онкология. Л., 1974. Каннабих Ю. В. Циклотимия, ее симптоматология и течение — М., 1914. Лапин И. В. Антидепрессанты группы имипрамина. — В в кн. Антидепрессанты и лечение депрессивных состоянии. Л. 1966, с. 31-51. (Лапин И. П., Оксенкруг Г.) Lapin I. P., Oxenkrag G. F. Inten sification of the central serotoninergic processes as a pessible determinant of thymoleptic effect. — Lancet, 1969, N 1 p. 132-136. Лапин И. П., Гура С. Повышенное образование кинуренинов, в частности никотиновой кислоты, как одна из возможных причин резистентности к антидепрессантам. — В кн.: депрессии и их лечение. Л., 1973, с. 123-130. Машковский М. Д., Андреева Н. И. Фармакологические основы антидепрессивной активности нового психотропного препарата пиразидола. — Журн. невропатол. и психиатр., 1975, в. 3, с. 430-435. Меграбян А. А. Деперсонализация. Ереван, 1962. Михаленко И. Н. Опыт применения предшественников биогенных аминов при лечении депрессии. — В кн.: Фармакодиагностика и фармакотерапия в психиатрии. Л., 1973, с. 43- 47. Михаленко И. В., Нуллер Ю. Л. Профили антидепрессивного действия антидепрессантов новерила и анафранила и их сравнительная оценка. — В кн.: Современные психотропные средства в клинике психических и нервных заболеваний. Л. 1970, с. 95-104. Михаленко И. Н., Киселева И. П., Лапин И. П. Отсутствие антидепрессивного действия лития в клинике и эксперименте. — Журн. невропатол. и психиатр., 1976, в. 8, с. 1219- 1224. Николаенко В. В. Клинпко-электроэнцефалографические критерии прогноза эффективности унилатеральной электросудорожной терапии при шизофрении. — В кн.; Алкогольные и эндогенно-органические психозы. Л., 1978, с. 283-290. Нуллер Ю. Л. Механизмы обратной связи в патогенезе эндогенной депрессии и их возможное значение для терапевтического действия аитидепрессантов. — В кн.: Фармакологические основы антидепрессивного эффекта. Л., 1970, с. 130- 134. Остроумова М. Н., Цыркина Е. В. Возрастная динамика регуляции в адаптационном гомеостазе и возрастная патология. — Физиология человека, 1978, № 4, с. 629-635. Смулевич А. В., Воробьев В. А. Деперсонализация, клинико-психопатологические аспекты. — Журн, невропатол. и психиатр., 1973, в. 8, с. 1242-1252. Смулевич А. В., Минскер Э. И. Проблемы предсказания эффективности солей лития в психиатрической клинике. — Журн. невропатол. и психиатр., 1977, в. 8, с. 1170-1178. Щелкунов Е. Л. Фармакологическое обоснование применения отечественного препарата хлорацизина в качестве антидепрессанта. — Журн, невропатол. и психиатр., 1963, в. 3 с. 4415-1419. Щелкунов Е. Л. О значении центрального холинолитического действия для антидепрессивнгого аффекта. — В кн.: Антидепрессанты и лечение депрессивных состояний. Л., 1966, с. 81-94. Хвиливицкий Т. Я. Опыт лечения аффективных интермиттирующих психозов и попытка их клинической группировки. — В кн.: Вопросы психиатрии и невропатологии. Л., 1959, с. 214-232. |