
Активность предшествующих нейронов влияет на рост дендритов
Системная нейрофизиология (nan)
Ген OSTN стал включаться в активно работающих нейронах. Сигнальный белок, кодируемый геном OSTN (красные кружочки), выделяется в межклеточную среду и регулирует рост дендритов.
Вес уверенности:
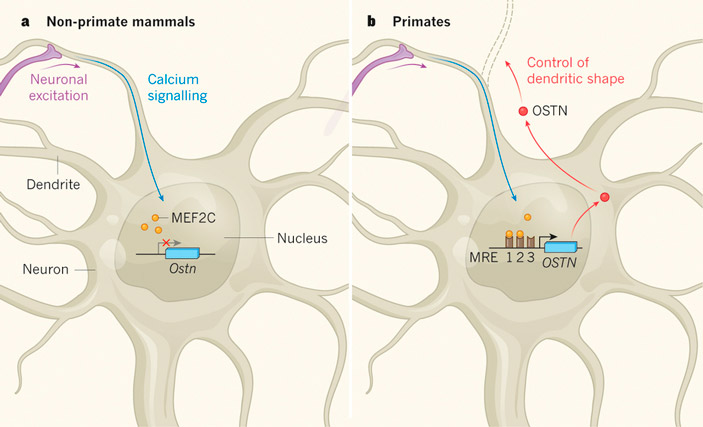
В развитии коры головного мозга млекопитающих важнейшую роль играют гены, включающиеся в нейронах при их возбуждении. При этом о конкретных генетических механизмах формирования неокортекса известно немного. В частности, непонятно, чем объясняется более сложная организация неокортекса обезьян по сравнению, например, с мышами. Американские нейробиологи обнаружили, что ген OSTN, который у большинства млекопитающих работает в костях и мышцах и не экспрессируется в мозге, у человека и других обезьян включается в нейронах неокортекса при их возбуждении и регулирует рост дендритов. Ген приобрел новую функцию на заре эволюции обезьян благодаря замене всего нескольких нуклеотидов в регуляторной области гена. В результате работа OSTN оказалась под контролем регуляторного белка MEF2, который активируется в нейронах при возбуждении. Полученные данные согласуются с предположением о том, что смена функции OSTN, создавшая новый механизм регуляции развития неокортекса в зависимости от приобретаемого опыта, внесла вклад в эволюцию интеллекта у высших приматов.
Неокортекс (см. также Neocortex) обезьян отличается от неокортекса других млекопитающих большим относительным объемом, высоким морфологическим разнообразием нейронов и сложной структурой межнейронных связей. Кроме того, для обезьян вообще, а для человека в особенности характерно долгое детство, во время которого нейронные контуры быстро развиваются под влиянием приобретаемого опыта (см.: , «Элементы», 29.05.2012).
Хотя кора головного мозга человека разительно отличается от, например, мышиной как по структуре, так и по функциональности, мы почти ничего не знаем о генетическом базисе этих различий. Вопрос тем более интересный, что число, да и набор генов в геномах человека и мыши почти одинаковы — уж во всяком случае, по этим показателям мы отличаемся от мышей гораздо меньше, чем по строению неокортекса и умственным способностям.
Американские нейробиологи, чья статья в свежем выпуске журнала Nature, попытались приблизиться к ответу на этот вопрос, сравнив наборы человеческих и мышиных генов, активирующихся в нейронах мозга при их возбуждении. Такие гены играют ключевую роль в обучении и памяти, то есть в формировании структуры межнейронных связей неокортекса под влиянием опыта. Поэтому логично предположить, что именно с этими генами могут быть связаны различия между человеческим и мышиным интеллектом.
Авторы работали с клеточными культурами, выращенными из суспензии разрозненных клеток мозга человеческих эмбрионов. Большинство клеток в этих культурах по своим свойствам (таким как набор экспрессирующихся генов) соответствует нейронам неокортекса. Возбуждение нейронов имитировалось путем добавления в среду хлорида калия. Это приводит к деполяризации клеточных мембран, как и при настоящем возбуждении нервных клеток (см.: Потенциал действия). Ранее на грызунах было показано, что стимуляция при помощи KCl ведет к активации тех же самых генов, которые включаются в нейронах живого мозга при настоящем возбуждении, вызываемом, например, сигналами, поступающими от органов чувств.
Набор генов, активирующихся при возбуждении, определяли при помощи секвенирования РНК (RNA-seq). Оказалось, что в человеческих нейронах, как и у грызунов, стимуляция ведет к последовательному включению двух групп генов. В течение первого часа включаются «гены раннего ответа» (early-response genes), такие как NPAS4, FOS, JUNB, NR4A1, NR4A3 и FOSB. Это в основном гены транскрипционных факторов (ТФ), то есть белков, которые работают в клеточном ядре и контролируют активность других генов. Во вторую очередь, часов через шесть после начала стимуляции, включаются более многочисленные «гены позднего ответа» (late-response genes), такие как BDNF, ADCYAP1, PCSK1 и GPR22. Белки, кодируемые этими генами, работают в цитоплазме, клеточной мембране или выделяются клетками наружу (секретируемые белки). Понятно, что активность «генов позднего ответа» отчасти контролируется белковыми продуктами «генов раннего ответа».
В человеческих нейронах стимуляция активировала в основном те же гены, что и у грызунов, однако кое-какие отличия все же нашлись. Три «гена позднего ответа», начинающие активно транскрибироваться в ответ на стимуляцию в человеческих нейронах, в нейронах грызунов вообще не работают. Два из них — это гены, специфичные для приматов, то есть у грызунов их просто нет (белок-кодирующий ген ZNF331 и длинная некодирующая РНК LINC00473).
Наиболее интересным авторам показался третий ген — OSTN (Osteocrin), и именно на нем они сосредоточили свои дальнейшие усилия. Экспрессия этого гена повысилась при стимуляции нейронов сильнее, чем экспрессия всех остальных генов позднего и раннего ответа. Но самый интригующий факт состоит в том, что ген OSTN есть у грызунов, однако у них он работает исключительно в костях и мышцах, а вовсе не в мозге. Этот ген кодирует маленький секретируемый (выделяемый в межклеточную среду) сигнальный белок, который, по-видимому, регулирует метаболизм и рост тканей.
Изучение срезов мозга человеческих эмбрионов, а также данные из существующих баз по экспрессии генов в мозге человека на разных стадиях развития показали, что OSTN действительно экспрессируется в человеческом неокортексе, особенно в затылочных и теменных долях, и, в меньшей степени, в миндалевидном теле, но не работает в других отделах мозга, таких как стриатум, мозжечок или гиппокамп. Максимальная активность OSTN наблюдается на поздних эмбриональных стадиях и в детстве, когда процессы формирования межнейронных связей в неокортексе идут наиболее интенсивно (рис. 2).
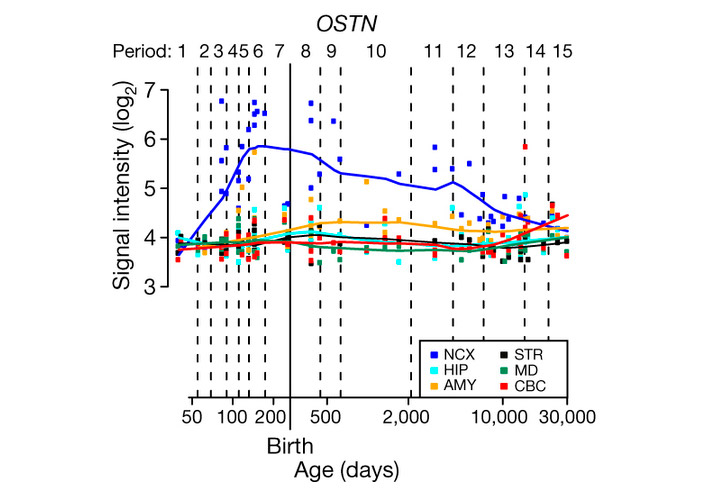
Рис. 2. Уровень экспрессии OSTN в разных отделах человеческого мозга на разных стадиях развития. По горизонтальной оси — возраст от момента зачатия в днях (шкала логарифмическая). NCX — неокортекс, HIP — гиппокамп, AMY — миндалевидное тело, STR — стриатум, MD — медиодорзальное ядро таламуса, CBC — кора мозжечка. Рисунок из обсуждаемой статьи в Nature
Почему ген, который у мышей (и у большинства других млекопитающих, см. ниже) работает только в мышцах и костях, у человека стал работать в неокортексе? С технической точки зрения, это могло произойти либо в результате изменения регуляторных участков ДНК, от которых зависит, какими ТФ регулируется работа OSTN, либо в результате изменения экспрессии самих ТФ. В первом случае ген OSTN мог попасть под контроль какого-то ТФ, который давно экспрессировался в мозге, но геном OSTN ранее не заведовал. Во втором случае ТФ, издавна контролировавший работу гена OSTN, но не работавший в мозге, мог начать экспрессироваться в нейронах коры.
Эксперименты с трансгенными нейронами показали, что в данном случае эволюция шла по первому сценарию. Исследователи вставляли в нейроны человека и мыши, выращиваемые в культуре, генетическую конструкцию, содержащую ген люциферазы, соединенный с предполагаемой регуляторной областью OSTN(участок некодирующей ДНК длиной в 2000 пар оснований (п. о.), расположенный непосредственно перед геном). Выяснилось, что человеческая (но не мышиная) регуляторная область OSTN обеспечивает экспрессию подконтрольного гена (в эксперименте — люциферазы, а в естественных условиях — OSTN) и в человеческих, и в мышиных возбужденных нейронах. Значит, дело именно в регуляторной области OSTN, а не в разных наборах ТФ в клетках мозга человека и мыши.
Дальнейшие опыты, в ходе которых от найденного регуляторного участка отрезались те или иные кусочки, показали, что экспрессия OSTN в работающих нейронах зависит от небольшого (длиной 85 п. о.) фрагмента ДНК (энхансера), расположенного в 600 п. о. перед точкой начала транскрипции OSTN. Внутри энхансера находятся три коротких (длиной по 10 нуклеотидов) последовательности, к которым могут прикрепляться ТФ из семейства MEF2 (рис. 3).
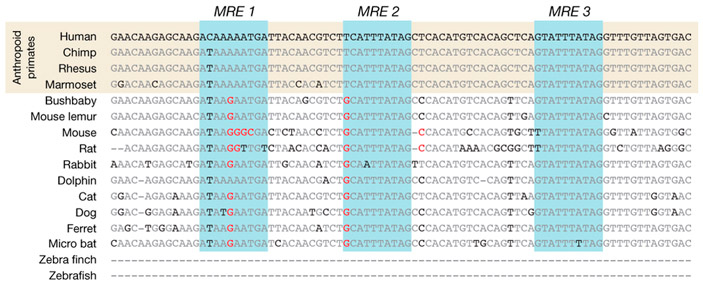
Рис. 3. Регуляторный участок (энхансер) гена OSTN у разных видов млекопитающих. Голубым цветом выделены три сайта связывания транскрипционных факторов MEF2 (MRE — MEF2-responsive elements). Серым цветом показаны консервативные (одинаковые у всех) нуклеотиды, черным — варьирующие, красным — нуклеотиды, которые не позволяют транскрипционным факторам MEF2 прикрепляться к ДНК. Видно, что только у обезьян (Anthropoid primates) все три MRE пригодны для прикрепления MEF2. Изображение из обсуждаемой статьи в Nature
Этот факт показывает, что исследователи, возможно, действительно наткнулись на что-то важное. Дело в том, что транскрипционные факторы MEF2 играют весьма существенную роль в развитии неокортекса млекопитающих. Эти ТФ активируются в ответ на поступление в цитоплазму нервной клетки ионов кальция (это происходит при возбуждении нейрона). Перейдя в активное состояние, белки MEF2 отправляются в клеточное ядро и запускают экспрессию ряда генов, важных для обучения и умственного развития. Ранее было показано, что мутации MEF2 (а также генов, подконтрольных MEF2), ведут к различным нарушениям — от расстройств аутистического спектра до тяжелой умственной отсталости. У человека (но не у мыши) в число генов, контролируемых MEF2, попал и ген OSTN.
Авторы сравнили строение найденного энхансера у разных млекопитающих (рис. 3). Оказалось, что только у обезьян (включая человека) все три 10-нуклеотидные последовательности действительно пригодны для прикрепления MEF2. Дополнительные эксперименты на клеточных культурах подтвердили, что MEF2 прикрепляются к обезьяньему, но не к мышиному варианту энхансера, запуская экспрессию OSTN в активно работающих нейронах.
Из этого следует, что исходно у млекопитающих ген OSTN в мозге не работал. Однако у обезьян, благодаря всего нескольким нуклеотидным заменам, он попал под управление MEF2 и начал экспрессироваться в нейронах коры при их возбуждении. Впрочем, MEF2, по-видимому, не являются единственными регуляторами экспрессии OSTN в неокортексе обезьян; возможно, дальнейшие исследования позволят выявить дополнительные регуляторы.
Были проведены также опыты на макаках-резусах — классическом объекте для изучения работы неокортекса, в особенности — зрительных отделов затылочной доли. Обезьянам блокировали передачу нервных импульсов в зрительную кору от одного глаза, чтобы сравнить экспрессию генов в клетках зрительной коры, получающих и не получающих сигналы от сетчатки. Выяснилось, что OSTNизбирательно экспрессируется в тех нейронах зрительной коры, которые получают зрительную информацию, и не экспрессируется в бездействующих нейронах. Более того, оказалось, что экспрессия OSTN приурочена лишь к одному из шести слоев неокортекса, а именно к слою IV (см. Cerebral cortex: Layered structure). Нейроны слоя IV специализируются на получении и обработке сигналов, приходящих от органов чувств, а также от других отделов мозга.
После этого авторы поставили еще одну серию экспериментов на клеточных культурах, чтобы проверить, влияет ли OSTN на рост дендритов — отростков, служащих для получения нейронами входящих сигналов. Структура сетей межнейронных взаимодействий определяется в первую очередь количеством и разветвленностью дендритов. Выяснилось, что уровень экспрессии OSTN влияет на рост дендритов самым радикальным образом: отключение этого гена ведет к бурному разрастанию дендритной сети, а искусственное повышение его экспрессии резко подавляет рост дендритов (рис. 4).

Рис. 4. Экспрессия OSTN влияет на рост дендритов. На каждой картинке показана дендритная сеть одного нейрона. Нейроны в клеточной культуре подвергались постоянной искусственной стимуляции при помощи KCl. a — контроль, b — ген OSTNвыведен из строя, c — экспрессия OSTN искусственно усилена. Изображение из обсуждаемой статьи в Nature
Наряду с другими исследованиями (см.: , «Элементы», 19.11.2013), данная работа показывает, что появление у некоторых генов новых функций в мозге, обусловленное мутационными изменениями регуляторных участков этих генов, по-видимому, сыграло важную роль в усложнении мозга и развитии умственных способностей у обезьян вообще и у человека в частности.
Источник: Bulent Ataman, Gabriella L. Boulting, David A. Harmin et al. // Nature. 2016. V. 539. P. 242–247.
См. также:
, «Элементы», 19.11.2013.
Источник:
Дата создания: 26.11.2018
Последнее редактирование: 26.11.2018
Относится к аксиоматике: Системная нейрофизиология.
Другие страницы раздела "Развитие и регенерация нейросети":
Чтобы оставить комментарии нужно авторизоваться: Авторизация пользователя
Рис. 1. Смена функции гена OSTN у высших приматов (обезьян). У всех прочих млекопитающих в регуляторной области OSTN нет участков для прикрепления регуляторного белка MEF2C (желтые кружочки), который активируется в нейронах при их возбуждении (Neuronal excitation; Calcium signalling). Поэтому ген OSTN не работает в нейронах мозга (слева). У обезьян в результате нескольких мутаций (нуклеотидных замен) появились такие участки (MRE — MEF2-responsive element). Поэтому у обезьян ген OSTN стал включаться в активно работающих нейронах. Сигнальный белок, кодируемый геном OSTN (красные кружочки), выделяется в межклеточную среду и регулирует рост дендритов. Рисунок из к обсуждаемой статье в Nature