Формирование синапсов
Формирование синапсов
http://ruels.narod.ru/articleS/synapFrm.htm
Federica Montanaro Harvard University, Boston, Massachusetts, USA
Salvatore Carbonetto McGill University, Montreal, Quebec, Canada
Montanaro, Federica and Carbonetto, Salvatore (March 2001 ) Developmental Biology of Synapse Formation. In: Encyclopedia of Life Sciences, London: Nature Publishing Group, http://www.els.net/
В 19-м столетии, Golgi в Италии и испанский учёный Ramon y Cajal независимо разработали первые гистохимические методы для визуализации нейронов головного мозга и вызвали многочисленные споры о природе соединений между нейронами. Сторонники ‘клеточной теории’ полагали, что нейроны формируют независимые единицы, тогда как сторонниrи ‘protoplasmic theory’ утверждали, что протоплазматические мостики соединяют нейроны др. с др. В 1843, Du Bois-Reymond впервые продемонстрировал, что электрический ток вызывает мышечные сокращения и проведение импульсов по нервам, это привело к идее, что прямая электрическая передача ответственна за общения между нервными клетками. Более того, быстрый перенос информации между нервами и мышцами говорил вроде бы в пользу протоплазматической теории. See also: Golgi, Camillo; Ramon y Cajal, Santiago; Du Bois-Reymond, Emil Heinrich
Montanaro, Federica and Carbonetto, Salvatore (March 2001 ) Developmental Biology of Synapse Formation. In: Encyclopedia of Life Sciences, London: Nature Publishing Group, http://www.els.net/
В 19-м столетии, Golgi в Италии и испанский учёный Ramon y Cajal независимо разработали первые гистохимические методы для визуализации нейронов головного мозга и вызвали многочисленные споры о природе соединений между нейронами. Сторонники ‘клеточной теории’ полагали, что нейроны формируют независимые единицы, тогда как сторонниrи ‘protoplasmic theory’ утверждали, что протоплазматические мостики соединяют нейроны др. с др. В 1843, Du Bois-Reymond впервые продемонстрировал, что электрический ток вызывает мышечные сокращения и проведение импульсов по нервам, это привело к идее, что прямая электрическая передача ответственна за общения между нервными клетками. Более того, быстрый перенос информации между нервами и мышцами говорил вроде бы в пользу протоплазматической теории. See also: Golgi, Camillo; Ramon y Cajal, Santiago; Du Bois-Reymond, Emil Heinrich
В 1921, Otto Loewi получил впервые прямые доказательства химической
передачи в своих элегантных экспериментах. Он показал, что жидкость,
омывающая сердце, чей нерв vagus был стимулирован, изменяет сердцебиения
не стимулированного сердца. Это указывало на то, что химические
субстанции, высвобождаемые нервами регулируют активность сердца. Loewi и
др. позднее идентифицировали этот нейротрансмиттер как acetylcholine, a в
1936 Dale с коллегами показали, что acetylcholine высвобождается
двигательными нервами после электрической стимуляции. See also: Loewi,
Otto; History of neurochemistry;
Neurotransmitters
ЭМ определенно продемонстрировала, что нейроны полностью окружены
своими собственными мембранами, как независимые клетки и выявила интимные
структурные детали соединений между нейронами и их мишенями. В 1897,
Sherrington уже ввел термин synapse (от греч. ‘synapsis’, рукопожатие) для
обозначения структуры, которая включала нервные окончания, целевые
клеточные специализации ниже их и пространство разделяющее их. Хотя многие
нейроны, как было показано позднее, электрически купированы, химическая
передача остаётся основным способом общения внутри центральной нервной
системы (ЦНС). See also: Neurons; Sherrington,
Charles Scott; Synapses
Многие исследования функции и формирования синапсов были
сфокусированы на neuromuscular junction (NMJ), на синапсах между
двигательными нейронами и скелетными мышцами, из-за их относительной
доступности и простоты. Они показали, что формирование синапсов нуждается
в сложном обмене информацией между нейроном и его мишенью, это делает
возможным взаимное распознавание и инициирует сигнальные каскады, которые
ведут к дифференцировке и формированию пресинаптических и
постсинаптических специализаций. Большинство исследований было
сфокусировано на сборке постсинаптического аппарата. Однако сравнительно
недавние исследования по идентификации белков, участвующих в высвобождении
нейротрансмиттеров на нервных окончаниях привели к важному пониманию
формирования пресинаптических компонентов. Роль идентифицированных белков
в формировании NMJ была подтверждена с помощью экспериментальных подходов
с использованием мощных инструментов reverse genetics. Эти эксперименты
пролили также свет на положение этих белков в иерархии двунаправленной
передачи сигналов между мышцами и нервами. В работах с плодовыми мушками
Drosophila melanogaster была использована прямая
генетика для открытия новых генов, участвующих в формировании NMJ у мух.
See also: Synapse
formation
Большая часть полученной информации оказалась непосредственно
пригодной для понимания, как формируются и функционируют синапсы в ЦНС и
привела к мнению, что NMJ могут рассматриваться как ‘model’ синапсов.
Кроме того, NMJ служат в качестве тестовой основы для разработки
экспериментальных алгоритмов, протоколов и новых технологий,
приспособленных для изучения синапсов между нейронами. Последние выглядят
как чрезвычайно динамические синапсы, меняющие количества
высвобождаемых ими нейротрансмиттеров или плотность рецепторов
нейротрансмиттеров в течение миллисекунд или секунд. Более радикальные и
более длительные изменения в форме синаптических контактов происходят в
течение минут, часов. Эта пластичность синапсов ЦНС наиболее очевидна во
время развития, хотя сходные молекулярные и клеточные события лежат и в
основе адаптивных измененеий у взрослых, таких как обучение и память. Хотя
исследования NMJ продолжают вносить вклад в новую информацию о
формировании синапсов, различия от синапсов ЦНС становятся всё более и
более очевидными. See also: Synaptic plasticity: short term
The Vertebrate Neuromuscular Junction
Structure
NMJ это синапсы между двигательным нейроном и скелетной мышцей.
Эволюция отладила эти синапсы для реального. эффективного и быстрого
переноса информации из ЦНС в скелетные мышцы. Зрелые NMJ состоят из
синаптических окончаний двигательного нейрона, субсинаптической мембраны
скелетного мышечного волокна и глиальной клетки (terminal Schwann cell),
которая покраывает шапочкой соединение (Figure 1c). See also: Motor neurons and
spinal control of movement; Schwann
cells
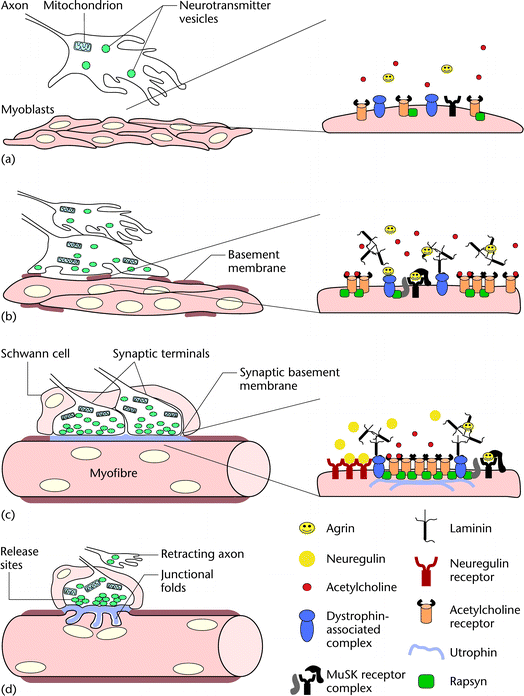 Figure 1 The axons of motor neurons enter the differentiating muscle mass while continuously releasing acetylcholine and agrin. At this stage, myoblasts are aligning and have just started to fuse. They express low levels of acetylcholine receptors, muscle-specific receptor tyrosine kinase (MuSK), rapsyn and the dystroglycans, all of which are distributed diffusely over the myoblast surface. (b) The growing tip of the first axon contacts the differentiating myoblasts and stops growing. Myoblasts are still fusing to form the primary myofibres. They have started secreting a scant and disorganized basement membrane, composed mainly of laminin. The expression of acetylcholine receptors, rapsyn, MuSK and dystroglycans increases. MuSK can be activated by neural agrin at this stage, indicating that all the components of the MuSK receptor complex are now expressed and functional. Aggregation of acetylcholine receptors begins. (c) Each multinucleated myofibre is surrounded by a continuous basement membrane and contacted by one or more axons. The basement membrane at the synaptic region becomes biochemically specialized. The tips of the axons have differentiated into synaptic terminals with organized sites for neurotransmitter release. Schwann cells are enveloping the nerve terminals. Acetylcholine receptors are concentrated at the postsynaptic membrane, where they become anchored to the basement membrane and the cytoskeleton via the dystroglycans. Synthesis of acetylcholine receptors is maintained selectively at the synapse by neuregulin released by the nerve. (d) Competition eliminates supernumerary synapses, leaving one synapse per muscle fibre. The postsynaptic membrane is raised and junctional folds appear. Neurotransmitter release sites become aligned with the troughs of the folds.
Figure 1 The axons of motor neurons enter the differentiating muscle mass while continuously releasing acetylcholine and agrin. At this stage, myoblasts are aligning and have just started to fuse. They express low levels of acetylcholine receptors, muscle-specific receptor tyrosine kinase (MuSK), rapsyn and the dystroglycans, all of which are distributed diffusely over the myoblast surface. (b) The growing tip of the first axon contacts the differentiating myoblasts and stops growing. Myoblasts are still fusing to form the primary myofibres. They have started secreting a scant and disorganized basement membrane, composed mainly of laminin. The expression of acetylcholine receptors, rapsyn, MuSK and dystroglycans increases. MuSK can be activated by neural agrin at this stage, indicating that all the components of the MuSK receptor complex are now expressed and functional. Aggregation of acetylcholine receptors begins. (c) Each multinucleated myofibre is surrounded by a continuous basement membrane and contacted by one or more axons. The basement membrane at the synaptic region becomes biochemically specialized. The tips of the axons have differentiated into synaptic terminals with organized sites for neurotransmitter release. Schwann cells are enveloping the nerve terminals. Acetylcholine receptors are concentrated at the postsynaptic membrane, where they become anchored to the basement membrane and the cytoskeleton via the dystroglycans. Synthesis of acetylcholine receptors is maintained selectively at the synapse by neuregulin released by the nerve. (d) Competition eliminates supernumerary synapses, leaving one synapse per muscle fibre. The postsynaptic membrane is raised and junctional folds appear. Neurotransmitter release sites become aligned with the troughs of the folds.
Окончания двигательного нерва контактируют примерно с 0.1% поверхности мышечного волокна и содержат пузырьки, наполненные нейротрансмиттером acetylcholine. Эти пузыртьки или прикреплены к цитоскелету, формируя резервный пул, или закреплены в местах высвобождения с помощью комплекса белков, которые делают возможным их слияние с плазматической мембраной и высвобождение нейротрансмиттеров, который они содержат, в синаптическое пространство. Сайты высвобождения на кончиках являются очень специализированными структурами, которые, как было показано, предварительно собираются в теле клетки двигательного нейрона и транспортируются в аксон в качестве одиночных единиц, уже готовых для вставки в мембрану окончаний нерва. Слияния пузырьков и высвобождение нейротрансмиттера запускается в действие с помощью потенциала действия, который проникает в нервные окончания, чтобы открыть локальные кальциевые каналы. Это приводит к локальному увеличению концентраций внутриклеточного кальция, которые активируют белки, необходимые для слияния мембран. Этот процесс д. приводить к увеличению нервных окончаний, если при этом не действует. See also: Synaptic vesicle traffic; Action potential: ionic mechanisms; Calcium and neurotransmitter release
 Figure 1 The axons of motor neurons enter the differentiating muscle mass while continuously releasing acetylcholine and agrin. At this stage, myoblasts are aligning and have just started to fuse. They express low levels of acetylcholine receptors, muscle-specific receptor tyrosine kinase (MuSK), rapsyn and the dystroglycans, all of which are distributed diffusely over the myoblast surface. (b) The growing tip of the first axon contacts the differentiating myoblasts and stops growing. Myoblasts are still fusing to form the primary myofibres. They have started secreting a scant and disorganized basement membrane, composed mainly of laminin. The expression of acetylcholine receptors, rapsyn, MuSK and dystroglycans increases. MuSK can be activated by neural agrin at this stage, indicating that all the components of the MuSK receptor complex are now expressed and functional. Aggregation of acetylcholine receptors begins. (c) Each multinucleated myofibre is surrounded by a continuous basement membrane and contacted by one or more axons. The basement membrane at the synaptic region becomes biochemically specialized. The tips of the axons have differentiated into synaptic terminals with organized sites for neurotransmitter release. Schwann cells are enveloping the nerve terminals. Acetylcholine receptors are concentrated at the postsynaptic membrane, where they become anchored to the basement membrane and the cytoskeleton via the dystroglycans. Synthesis of acetylcholine receptors is maintained selectively at the synapse by neuregulin released by the nerve. (d) Competition eliminates supernumerary synapses, leaving one synapse per muscle fibre. The postsynaptic membrane is raised and junctional folds appear. Neurotransmitter release sites become aligned with the troughs of the folds.
Figure 1 The axons of motor neurons enter the differentiating muscle mass while continuously releasing acetylcholine and agrin. At this stage, myoblasts are aligning and have just started to fuse. They express low levels of acetylcholine receptors, muscle-specific receptor tyrosine kinase (MuSK), rapsyn and the dystroglycans, all of which are distributed diffusely over the myoblast surface. (b) The growing tip of the first axon contacts the differentiating myoblasts and stops growing. Myoblasts are still fusing to form the primary myofibres. They have started secreting a scant and disorganized basement membrane, composed mainly of laminin. The expression of acetylcholine receptors, rapsyn, MuSK and dystroglycans increases. MuSK can be activated by neural agrin at this stage, indicating that all the components of the MuSK receptor complex are now expressed and functional. Aggregation of acetylcholine receptors begins. (c) Each multinucleated myofibre is surrounded by a continuous basement membrane and contacted by one or more axons. The basement membrane at the synaptic region becomes biochemically specialized. The tips of the axons have differentiated into synaptic terminals with organized sites for neurotransmitter release. Schwann cells are enveloping the nerve terminals. Acetylcholine receptors are concentrated at the postsynaptic membrane, where they become anchored to the basement membrane and the cytoskeleton via the dystroglycans. Synthesis of acetylcholine receptors is maintained selectively at the synapse by neuregulin released by the nerve. (d) Competition eliminates supernumerary synapses, leaving one synapse per muscle fibre. The postsynaptic membrane is raised and junctional folds appear. Neurotransmitter release sites become aligned with the troughs of the folds.
Окончания двигательного нерва контактируют примерно с 0.1% поверхности мышечного волокна и содержат пузырьки, наполненные нейротрансмиттером acetylcholine. Эти пузыртьки или прикреплены к цитоскелету, формируя резервный пул, или закреплены в местах высвобождения с помощью комплекса белков, которые делают возможным их слияние с плазматической мембраной и высвобождение нейротрансмиттеров, который они содержат, в синаптическое пространство. Сайты высвобождения на кончиках являются очень специализированными структурами, которые, как было показано, предварительно собираются в теле клетки двигательного нейрона и транспортируются в аксон в качестве одиночных единиц, уже готовых для вставки в мембрану окончаний нерва. Слияния пузырьков и высвобождение нейротрансмиттера запускается в действие с помощью потенциала действия, который проникает в нервные окончания, чтобы открыть локальные кальциевые каналы. Это приводит к локальному увеличению концентраций внутриклеточного кальция, которые активируют белки, необходимые для слияния мембран. Этот процесс д. приводить к увеличению нервных окончаний, если при этом не действует. See also: Synaptic vesicle traffic; Action potential: ionic mechanisms; Calcium and neurotransmitter release
Базальная мембрана покрывает мышечное волокно целиком (Figure 1d) и
состоит в основном из laminin, collagen IV и heparan sulfate
proteoglycans. Базальная мембрана проникает между нервными окончаниями, и
т.к. мышца биохимически отлична, она содержит специфические изоформы
laminin и collagen IV, субнабор heparan sulfate proteoglycans и
acetylcholinesterase, энзим, который инактивирует acetylcholine. Кроме
того, два фактора дифференцировки, agrin и neuregulin, которые действуют
как организаторы постсинаптического аппарата (Figure 1, and
discussed below) закреплены на базальной мембране. У зрелых мышц базальная
мембрана очень резистентна к деградации и сохраняется в течение
длительного периода времени после повреждения и мышцы или дегенерации
нерва. Такая метаболическая стабильность важна, т.к. синаптическая
базальная мембрана используется в качестве матрицы для регенерации
синапсов после повреждения. See also: Extracellular matrix; Regeneration of muscle
Постсинаптическая мышечная мембрана собрана в глубокие складки со
"ртом" каждой складки в точности расположенным напротив сайта
высвобождения в окончании нерва (Figure 1d). Ацетилхолиновые рецепторы
обнаруживаются только на верхушках складок (Figure 2), с очень высокой
плотностью вблизи места высвобождения нейротрансмиттера. Напряжением
регулируемые натриевые каналы, необходимые для генерации потенциала
действия и запуска мышечного сокращения, собраны в кластеры на дне складок
(Figure 2). Образование складок постсинаптическими мембранами и
ограниченное распределение ацетилхолиновых рецепторов и натриевых каналов
поддерживаются с помощью специализированного субмембранного цитоскелета и
комплекса трансмембранных белков, связывающих цитоскелет с покрывающей
синаптической базальной мембраной
(Figures 1 and 2;
discussed below). See also: Nicotinic acetylcholine receptors in muscle;
Acetylcholine; Muscle
contraction; Postsynaptic membranes at the
neuromuscular junction: molecular organization
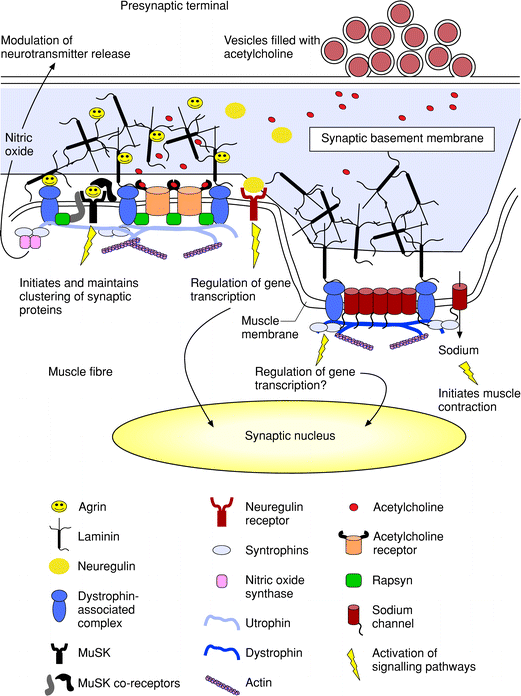 Figure 2 Molecular interactions and signalling at the vertebrate neuromuscular junction (NMJ). Acetylcholine release sites in the nerve terminal are aligned precisely with the mouths of the synaptic folds in the muscle postsynaptic membrane. The presynaptic and postsynaptic elements are separated by a highly organized synaptic basement membrane, which includes laminin, collagen, heparan sulfate proteoglycan and acetylcholinesterase (not shown). Incorporated into this basement membrane are also found proteins released by the nerve, such as agrin and neuregulin, which participate in the formation and maintenance of the NMJ. Agrin is anchored to the synaptic basement membrane via laminin, and interacts with two receptors on the muscle surface, incuding a-dystroglycan and muscle-specific receptor tyrosine kinase (MuSK). Activation of MuSK by agrin initiates clustering of acetylcholine receptors at the top of the folds, and sodium channels at the bottom of the folds. Acetylcholine receptors are aggregated via activation of rapsyn, which also self-associates and recruits a- and ?dystroglycan. The dystroglycans are believed to enlarge and stabilize the cytoskeletal network by interacting with utrophin and dystrophin, and indirectly with syntrophins. In addition dystrophin, utrophin, dystroglycans and laminin are required for the proper folding of the postsynaptic membrane. The syntrophins can interact with dystrophin at the bottom of the folds as well as utrophin and signalling proteins such as nitric oxide synthase. Neuregulin released by the nerve activates ErbB receptors, which are also trapped in the postsynaptic membrane, and activates the transcription of acetylcholine receptor genes in synaptic nuclei.
Figure 2 Molecular interactions and signalling at the vertebrate neuromuscular junction (NMJ). Acetylcholine release sites in the nerve terminal are aligned precisely with the mouths of the synaptic folds in the muscle postsynaptic membrane. The presynaptic and postsynaptic elements are separated by a highly organized synaptic basement membrane, which includes laminin, collagen, heparan sulfate proteoglycan and acetylcholinesterase (not shown). Incorporated into this basement membrane are also found proteins released by the nerve, such as agrin and neuregulin, which participate in the formation and maintenance of the NMJ. Agrin is anchored to the synaptic basement membrane via laminin, and interacts with two receptors on the muscle surface, incuding a-dystroglycan and muscle-specific receptor tyrosine kinase (MuSK). Activation of MuSK by agrin initiates clustering of acetylcholine receptors at the top of the folds, and sodium channels at the bottom of the folds. Acetylcholine receptors are aggregated via activation of rapsyn, which also self-associates and recruits a- and ?dystroglycan. The dystroglycans are believed to enlarge and stabilize the cytoskeletal network by interacting with utrophin and dystrophin, and indirectly with syntrophins. In addition dystrophin, utrophin, dystroglycans and laminin are required for the proper folding of the postsynaptic membrane. The syntrophins can interact with dystrophin at the bottom of the folds as well as utrophin and signalling proteins such as nitric oxide synthase. Neuregulin released by the nerve activates ErbB receptors, which are also trapped in the postsynaptic membrane, and activates the transcription of acetylcholine receptor genes in synaptic nuclei.
 Figure 2 Molecular interactions and signalling at the vertebrate neuromuscular junction (NMJ). Acetylcholine release sites in the nerve terminal are aligned precisely with the mouths of the synaptic folds in the muscle postsynaptic membrane. The presynaptic and postsynaptic elements are separated by a highly organized synaptic basement membrane, which includes laminin, collagen, heparan sulfate proteoglycan and acetylcholinesterase (not shown). Incorporated into this basement membrane are also found proteins released by the nerve, such as agrin and neuregulin, which participate in the formation and maintenance of the NMJ. Agrin is anchored to the synaptic basement membrane via laminin, and interacts with two receptors on the muscle surface, incuding a-dystroglycan and muscle-specific receptor tyrosine kinase (MuSK). Activation of MuSK by agrin initiates clustering of acetylcholine receptors at the top of the folds, and sodium channels at the bottom of the folds. Acetylcholine receptors are aggregated via activation of rapsyn, which also self-associates and recruits a- and ?dystroglycan. The dystroglycans are believed to enlarge and stabilize the cytoskeletal network by interacting with utrophin and dystrophin, and indirectly with syntrophins. In addition dystrophin, utrophin, dystroglycans and laminin are required for the proper folding of the postsynaptic membrane. The syntrophins can interact with dystrophin at the bottom of the folds as well as utrophin and signalling proteins such as nitric oxide synthase. Neuregulin released by the nerve activates ErbB receptors, which are also trapped in the postsynaptic membrane, and activates the transcription of acetylcholine receptor genes in synaptic nuclei.
Figure 2 Molecular interactions and signalling at the vertebrate neuromuscular junction (NMJ). Acetylcholine release sites in the nerve terminal are aligned precisely with the mouths of the synaptic folds in the muscle postsynaptic membrane. The presynaptic and postsynaptic elements are separated by a highly organized synaptic basement membrane, which includes laminin, collagen, heparan sulfate proteoglycan and acetylcholinesterase (not shown). Incorporated into this basement membrane are also found proteins released by the nerve, such as agrin and neuregulin, which participate in the formation and maintenance of the NMJ. Agrin is anchored to the synaptic basement membrane via laminin, and interacts with two receptors on the muscle surface, incuding a-dystroglycan and muscle-specific receptor tyrosine kinase (MuSK). Activation of MuSK by agrin initiates clustering of acetylcholine receptors at the top of the folds, and sodium channels at the bottom of the folds. Acetylcholine receptors are aggregated via activation of rapsyn, which also self-associates and recruits a- and ?dystroglycan. The dystroglycans are believed to enlarge and stabilize the cytoskeletal network by interacting with utrophin and dystrophin, and indirectly with syntrophins. In addition dystrophin, utrophin, dystroglycans and laminin are required for the proper folding of the postsynaptic membrane. The syntrophins can interact with dystrophin at the bottom of the folds as well as utrophin and signalling proteins such as nitric oxide synthase. Neuregulin released by the nerve activates ErbB receptors, which are also trapped in the postsynaptic membrane, and activates the transcription of acetylcholine receptor genes in synaptic nuclei.
Neuromuscular junction formation
The nerve terminal
Во время развития аксоны от двигательных нейронов выходят из спинного
мозга в виде стереотипических паттернов и проводятся к своим мишеням с
помощью клеточных и молекулярных сигналов, которые могут или привлекать
или отталкивать их. Рост аксонов происходит со скоростью приблизительно
10–50 &micri;m
h-1, покрывая расстояния от
миллиметров до метров в зависимости от вида животного. Оказавшись в
непосредственно близи к мишени аксональный рост замедляется и в конечном
итоге останавливается. Кончик аксона контактирует с мишенью и тем самым
инициируется дифференцировка пресинаптических окончаний. Эти ранние
решения о прекращении роста и дифференцировке в основном обусловливаются
локальными модифицирующими предсуществующими молекулами, тем самым
предваряется необходимость в ожидании информации, переносимой между
кончиком аксона и довольно удаленным телом клетки нейрона. Однако,
установлено, что могут быть необходимы коммуникации на длинные расстояния
для некоторых аспектов дифференцировки. В самом деле, один из наиболее
сложных структурных признаков окончаний зрелых нервов, места высвобождения
пузырьков, действительно собираются в теле клетки, транспортируются в
аксон и вставляются en bloc в мембрану нервных
окончанаий. See also: Vertebrate peripheral nervous system; Axon growth; Axon
guidance; Axonal transport and the neuronal
cytoskeleton
Целенаправленные сигналы, которые запускают изменения, от подвижного
ростового конуса к значительно более статичным нервным окончаниям,
специализированным для высвобождения нейротрансмиттеров, ещё неизвестны.
Молекулы клеточной адгезии, такие как neuroligin (Figure 3), которые
участвуют в межклеточном распознавании в др. системах, являются
потенциальными кандидатами и активно исследуются. See
also: Adhesive specificity and the
evolution of multicellularity
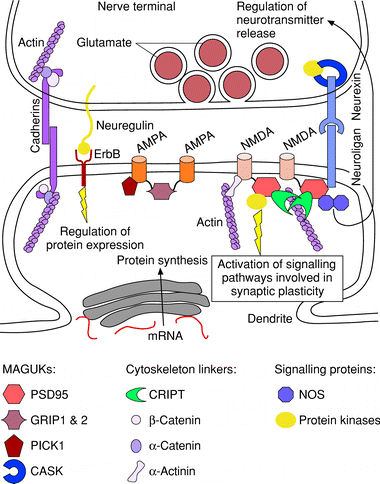 Figure 3 Model of some of the molecular interactions occurring at a central excitatory synapse. The nerve is in close apposition with a dendritic spine of the postsynaptic neuron. Some of the molecular interactions at the synapse involve cell adhesion molecules, such as cadherins and neurexin?neuroligan complexes. These link the presynaptic terminal to the postsynaptic membrane, ensuring contact, organizing the actin cytoskeleton and, possibly, aligning vesicle release sites with glutamate receptor clusters in the postsynaptic membrane. Neurexin in the presynaptic terminal interacts with the membrane-associated guanylate kinase (MAGUK) calcium/calmodulin dependent serine protein kinase (CASK), which recruits calcium calmodulin kinase II, a tyrosine kinase activated by calcium and involved in cytoskeletal remodelling. The nerve synthesizes a membrane-bound form of neuregulin which binds to the postsynaptic ErbB receptor and regulates N-methyl-D-aspartate (NMDA) receptor synthesis. NMDA and a-amino-3-hydroxy-5-methylisoxazole-4-proprionic acid (AMPA) receptors interact with specific MAGUKs, which ensure their localization at the synapse, anchor them to the cytoskeleton and recruit signalling proteins, such as nitric oxide synthase (NOS) and the tyrosine kinase Fyn. GRIP, glutamate receptor interacting protein; mRNA, messenger ribonucleic acid; PSD, postsynaptic density.
Figure 3 Model of some of the molecular interactions occurring at a central excitatory synapse. The nerve is in close apposition with a dendritic spine of the postsynaptic neuron. Some of the molecular interactions at the synapse involve cell adhesion molecules, such as cadherins and neurexin?neuroligan complexes. These link the presynaptic terminal to the postsynaptic membrane, ensuring contact, organizing the actin cytoskeleton and, possibly, aligning vesicle release sites with glutamate receptor clusters in the postsynaptic membrane. Neurexin in the presynaptic terminal interacts with the membrane-associated guanylate kinase (MAGUK) calcium/calmodulin dependent serine protein kinase (CASK), which recruits calcium calmodulin kinase II, a tyrosine kinase activated by calcium and involved in cytoskeletal remodelling. The nerve synthesizes a membrane-bound form of neuregulin which binds to the postsynaptic ErbB receptor and regulates N-methyl-D-aspartate (NMDA) receptor synthesis. NMDA and a-amino-3-hydroxy-5-methylisoxazole-4-proprionic acid (AMPA) receptors interact with specific MAGUKs, which ensure their localization at the synapse, anchor them to the cytoskeleton and recruit signalling proteins, such as nitric oxide synthase (NOS) and the tyrosine kinase Fyn. GRIP, glutamate receptor interacting protein; mRNA, messenger ribonucleic acid; PSD, postsynaptic density.
 Figure 3 Model of some of the molecular interactions occurring at a central excitatory synapse. The nerve is in close apposition with a dendritic spine of the postsynaptic neuron. Some of the molecular interactions at the synapse involve cell adhesion molecules, such as cadherins and neurexin?neuroligan complexes. These link the presynaptic terminal to the postsynaptic membrane, ensuring contact, organizing the actin cytoskeleton and, possibly, aligning vesicle release sites with glutamate receptor clusters in the postsynaptic membrane. Neurexin in the presynaptic terminal interacts with the membrane-associated guanylate kinase (MAGUK) calcium/calmodulin dependent serine protein kinase (CASK), which recruits calcium calmodulin kinase II, a tyrosine kinase activated by calcium and involved in cytoskeletal remodelling. The nerve synthesizes a membrane-bound form of neuregulin which binds to the postsynaptic ErbB receptor and regulates N-methyl-D-aspartate (NMDA) receptor synthesis. NMDA and a-amino-3-hydroxy-5-methylisoxazole-4-proprionic acid (AMPA) receptors interact with specific MAGUKs, which ensure their localization at the synapse, anchor them to the cytoskeleton and recruit signalling proteins, such as nitric oxide synthase (NOS) and the tyrosine kinase Fyn. GRIP, glutamate receptor interacting protein; mRNA, messenger ribonucleic acid; PSD, postsynaptic density.
Figure 3 Model of some of the molecular interactions occurring at a central excitatory synapse. The nerve is in close apposition with a dendritic spine of the postsynaptic neuron. Some of the molecular interactions at the synapse involve cell adhesion molecules, such as cadherins and neurexin?neuroligan complexes. These link the presynaptic terminal to the postsynaptic membrane, ensuring contact, organizing the actin cytoskeleton and, possibly, aligning vesicle release sites with glutamate receptor clusters in the postsynaptic membrane. Neurexin in the presynaptic terminal interacts with the membrane-associated guanylate kinase (MAGUK) calcium/calmodulin dependent serine protein kinase (CASK), which recruits calcium calmodulin kinase II, a tyrosine kinase activated by calcium and involved in cytoskeletal remodelling. The nerve synthesizes a membrane-bound form of neuregulin which binds to the postsynaptic ErbB receptor and regulates N-methyl-D-aspartate (NMDA) receptor synthesis. NMDA and a-amino-3-hydroxy-5-methylisoxazole-4-proprionic acid (AMPA) receptors interact with specific MAGUKs, which ensure their localization at the synapse, anchor them to the cytoskeleton and recruit signalling proteins, such as nitric oxide synthase (NOS) and the tyrosine kinase Fyn. GRIP, glutamate receptor interacting protein; mRNA, messenger ribonucleic acid; PSD, postsynaptic density.
The postsynaptic membrane
Комплекс последовательных событий запускается уже при первом контакте
врастающего аксона с дифференцирующейся мышцей. Когда аксон впервые
достигает мышечной массы, миобласты всё ещё сливаются др. с др.,
заканчивая формирование первичных и вторичных миобибрилл. одним из
наиболее важных событий, которое следует сразу после контакта аксона с
дифференцирующимся мышечным волокном является быстрый сбор (в течение
минут) до этого диспергированных ацетилхолиновых рецепторов под
формирующимся нервным окончанием (Figure 1b). Эта быстрая агрегация
рецепторов нейротрансмиттера является характерной особенностью образования
NMJ. McMahon и др. показали, что синаптическая базальная мембрана содержит
всю информацию, необходимую для запуска и управления всеми аспектами
образования NMJ у взрослых после повреждения. Их биохимическая
характеристика привела к идентификации agrin в качестве компонента,
который запускает агрегацию ацетилхолиновых рецепторов. See also: Postsynaptic
membranes at the neuromuscular junction: molecular organization
Agrin синтезируется и в мышцах и нервах и секретируется и проникает в
базальную мембрану. Альтернативный сплайсинг генерирует несколько форм
agrin, но только те, которые продуцируются двигательными нейронами,
способны эффективно агрегировать ацетилхолиновые рецепторы, натриевые
каналы, acetylcholinesterase и др. синаптически важные молекулы на
формирующихся синапсах. Нейральный agrin действует путем активации
muscle-specific receptor tyrosine kinase (MuSK), которая запускает
внутриклеточный сигнальный каскад, существенный для формирования NMJ.
MuSK, подобно нейральному agrin, концентрируется на зрелых NMJs, где она.
как полагают, формирует комплекс с двумя др. мембранными белками,
muscle-associated specificity component (MASC) и rapsyn-associated
transmembrane linker (RATL) (Figure 1b–d and Figure 2). Так если MASC
необходим для связывания agrin с MuSK и активации MuSK, то RATL
существенен для точной привязки ацетилхолиновых рецепторов к сайтам, где
MuSK активна, т.е. под нервными окончаниями. Критическая роль agrin и MuSK
в формировании NMJ подтверждена на мутантных мышах, у которых отсутствует
любой из этих двух белков. Мутантный мыши, лишенные MuSK не имеют NMJs,
хотя аксоны врастают в мышечную массу. Инициация постсинаптической и
пресинаптической дифференцировки отсутствует, указывая темс самым, что
MuSK и ассоциированные с нею белки управляют не только постсинаптической
дифференцировкой, но и также обеспечивают поток информации от мышцы к
нерву, который инструктирует последний заканчивать рост и переходить к
дифференцировке в нервные окончания. See
also: Synapse formation; Protein kinases: physiological roles; Mouse knockouts
До иннервации ацетилхолиновые рецепторы, подобно большинству
мембранных белков, свободно диффундируют в плазматическую мембрану. Каждый
рецептор проводит около 1 дня в мембране прежде чем будет
деградирован и замещен вновь синтезированным ацетилхолиновым рецептором.
Активация MuSK ведет к рекрутированию и захвату ацетилхолиновых рецепторов
на этих местах зарождения (nucleation). Ацетилхолиновые рецепторы
оказываются связанными с MuSK посредством RATL, и один с др. посредством
малого мембранного белка, называемого rapsyn, и с клеточным цитоскелетом
(dystrophin, utrophin, actin) посредством большого трансмембранного
комплекса (dystrophin-ассоциированного белкового комплекса; Figures 1 and
2). Сборка такой мембраны и цитоскелетной сети эффективно захватывает
ацетилхолиновые рецепторы под нервными окончаниями и уменьшает
десятикратно скорость, с которой они удаляются из мембраны. See also: Membrane
proteins; Membrane dynamics; Cytoskeleton
Maturation of presynaptic and postsynaptic
structures
Высвобождение acetylcholine нейронами этими формирующимися синапсами
запускает мышечные сокращения и инициирует вторую фазу образования NMJ с
использованием регуляции продукции ацетилхолиновых рецепторов. Т.к.
мышечная активность ингибирует транскрипцию гена ацетилхолиновых
рецепторов во всём мышечном волокне, то нерв высвобождает neuregulin,
фактор роста-дифференцировки, который соединяется с ErbB рецепторной
тирозин киназой (Figures 1c and 2). Активация этого рецептора увеличивает
синтез ацетилхолиновых рецепторов в субсинаптических ядрах. Т.к.
neuregulins связаны с базальной мембраной внутри синаптической щели, то
пределы его активности ограничиваются пространственно мышечными ядрами
вблизи синапсов. See also: Signal transduction: overview
Ацетилхолиновые рецепторы синтезируются локально и проникают в
созревающие синапсы, чтобы заместить в мембране те, которые деградировали
в ходе нормального жизненного цикла клеточных белков. Это формирует
синаптическую область с высокой концентрацией ацетилхолиновых рецепторов,
инициированную с помощью agrin и поддерживающейся с помощью neuregulin,
тогда как огромная остальная часть мышечного волокна лишена
ацетилхолиновых рецепторов. В самом деле, NMJ образует компартмент.
который распространяется от нервного окончания через базальную и мышечную
плазматическую мембраны и подлежащий цитоскелет к субсинаптическим ядрам,
делая последние отличными от их соседей в этой во всем остальном
гомогенной клетке
В конечном итоге ацетилхолиновые рецепторы в постсинаптических
мембранах оказываются крепко закрепленными на субсинаптическом
цитоскелете, защищая их от диффузии в этой области. Agrin, как и
neuregulin, запутаны внутри базальной мембраны, определяя эту область как
часть синаптической матрицы. С созреванием синапсов каналы, чувствительные
к эл. напряжению, и синаптические изоформы цитоскелетных белков и белки
включаются в синапсы. Напр., acetylcholinesterase нейромышечного
соединения имеет коллаген-подобный хвост и соединяется с proteoglycan,
который соединяется, в свою очередь, с α-dystroglycan. Чувствительные к
напряжению натриевые каналы, необходимые для инициации мышечных
сокращений, закреплены на дне соединительных складок, где они
взаимодействуют с syntrophin, ассоциированным с мембраной белком, который
также связывает dystrophin и utrophin (Figure 2). See also: Ion
channels; Sodium channels
На финальной стадии созревания синапсов, мелкие желобки, которые
формируются первоначально под нервными окончаниями, углубляются в
синаптические складки (Figure 1d). Формирование зрелых складок нуждается в
синаптических формах белка базальных мембран laminin, а также
цитоскелетных белков dystrophin и utrophin. На этой стадии
постсинаптическая мембрана возвышается над гладкой цилиндрической
структурой мышечного волокна и то, что первоначально было бляшкой
ацетилхолиновых рецепторов, приобретает крендель-образную форму.
Пресинаптические окончания также дифференцируются, с образованием активных
зон и их соотношением с "ртами" соединительных складок. Дифференцировка
пресинаптических окончаний нуждается в контактах с мышечным волокном во
время развития; однако, синаптическая базальная lamina может управлять
всеми аспектами пресинаптической дифференцировки в отсутствие мышц во
время регенерации у взрослых. Это указывает на то, что ещё не
идентифицированные молекулы, секретируемые мышцами и вставляющиеся в
синаптическую базальную ламину, участвуют в аресте роста и в
дифференцировке нервных окончаний и в обеспечении двунаправленной передачи
сигналов между мышцей и нервом.
Neuromuscular Junction in Drosophila
Drosophila melanogaster позволяют использовать комбинацию
электрофизиологической техники и идентификацию и манипуляции с одиночными
клетками вместе с мощными генетическими подходами к tк решениям вопросов
развития и функционирования синапсов.
Drosophila имеет значительно меньше двигательных нейронов, чем
позвоночные и каждый м.б. идентифицирован согласно их стереотипическому
положению в сегментных ганглиях, обнаруживаемых вдоль вентральной
срединной линии у личинок мух. Они приводят к стереотипическим путям
внутри ЦНС ещё возбуждения общим латеральным нервом. Ко времени, когда
первые аксоны покидают ЦНС, мышечные волокна уже сформированы.
Эксперименты, в которых мышцы были хирургически или генетически удалены до
иннервации, предоставили прекраcнsе доказательства, что моторные нейроны
могут расти в соответ область даже в отсутствие ткани-мишени. Генетические
подходы и анализ мутантов идентифицировали несколько кандидатов молекул
клеточной поверхности, участвующих в аксональной fasciculation,
defasciculation, нахождении путей или распознавании мишеней. Сюда вошли
fasciclins I, II and III, connectin, neuroglian, semaphorin II, netrins и
late bloomer. Напр., мутации генов netrins или их рецептора,
frazzled, вызывают аберрантное нахождение двигательными нейронами
своих мышц, это указывает на то, что эти белки участвуют в наведении
двигательных нейронов. Интересно, что netrins, также как и
semaphorins м. отталкивать аксональные выросты моторных нейронов
Drosophila, указывая тем самым, что комбинация аттрактивных и
отталкивающих молекул устанавливает точный паттерн проекций двигательных
нейронов на мышцы. гомологи netrins и их рецепторов идентифицированы и у
позвоночных, что отражает раннюю эволюцию этих молекул наведения и
консервацию их структуры и функции. See
also: Drosophila neural
development; Regeneration:
principles; Axon guidance; Evolutionary developmental biology: homologous
regulatory genes and processes
>В отличие от NMJs у позвоночных, у Drosophila каждая
отдельная миофибрилла является отдельной мышцей. Как и у позвоночных не
видны синаптические специализации на миофибрилле до иннервации и рецепторы
для нейротрансмиттера glutamate случайно распределены по всему мышечному
волокну. Однако, эти глютаматные рецепторы являются неактивными и не
отвечают на добавление в раствор глютамата. Чувствительность к глютамату
появляется только после того, как дифференцированные мышечные волокна
начинают сокращаться в результате действия двигательного нейрона. Такие
примитивные синапсы являются неэффективными и быстро устают после
стимуляции, а синтез новых глютаматных рецепторов необходим для
эффективной синаптической передачи. Более того, экспрессия рецепторов
нейротрансмиттеров не затрагивается началом контракции и не ограничивается
ядрами вблизи синапсов. Последнее возможно обусловлено слишком маленькими
размерами миофибрилл у Drosophila, для которых может быть не нужна
значительная амплификация, как это необходимо для крупных миофибрилл
позвоночных. Молекулы, которые управляют агрегацией глютаматовых
рецепторов и синтезом функциональных рецепторов у Drosophila пока
неизвестны. Не описаны у них гомологи agrin, MuSK или neuregulin в этих
NMJ. Кроме того, мало известно о составе и функции базальной мембраны в
NMJ у Drosophila. Однако, мы имеем некоторые сведения о
внутриклеточных игроках, участвующих в агрегации глютаматовых рецепторов.
See also: Glutamate
as a neurotransmitter
Точно также, как rapsyn существенен для локализации ацетилхолиновых
рецепторов в скелетных мышцах, так и аналогичное семейство белков, наз.
for localizing acetylcholine receptors in skeletal muscle, an
analogous MAGUKs (membrane-associated guanylate kinase homologues)
служит для закрепления глютаматовых рецепторов в скелетных мышцах
Drosophila. Эти белки были открыты с помощью мутагенеза, приведшего
к идентификации гена (discs large), который кодирует белок,
способный закреплять как глютаматовые рецепторы, так и калиевые каналы
одновременно. MAGUKs являются модулярными белками, состоящими из коллажа
мотивов, участвующих в связывании белков (напр., PDZ домены, SH3 домены).
Они, как было установлено, обеспечивают связывание ионных каналов и
рецепторов нейротрансмиттеров, также как и внутриклеточных сигнальных
молекул. MAGUKs , следовательно, способны организовывать макромолекулярные
комплексы в синапсах, которые могут вносить вклад в поставку и поддержание
рецепторов нейротрансмиттеров и ионных каналов в постсинаптической
мембране, а также облегчать передачу сигналов после их активации. Члены
семейства MAGUK были обнаружены и у позвоночных в центральных синапсах.
See also: Protein–protein interactions
Central Nervous System Synapses
Мозг человека содержит около 1011 нейронов, каждый с
тысячей или более химических синапсов. В то время как только один тип
нейротрансмиттера высвобождается в NMJ (ацетилхолин у позвоночных и
глютамат у Drosophila), нейроны в нервной системе синтезируют и
высвобождают разнообразные нейротрансмиттеры (acetylcholine, glutamate,
glycine, serotonin, substance P, γ-aminobutyric acid, dopamine, и т.д.).
Точная организация этих соединений и соотв. химического соответствия
постсинаптических и пресинаптических элементов существенно даже для самой
простейшей функции нашего мозга. See
also: Neurotransmitters; Vertebrate central nervous system
Наведение проекций нейронов ЦНС достигается с помощью
привлекающих и отталкивающих молекул очень сходно с тем. что описано для
моторных нейронов у мух. Большая часть наших знаний о формировании ,
поддержании и пластичности синапсов в ЦНС базируется на glutamatergic
синапсах, которые образуют большинство возбуждающих синапсов в голвоном
мозге млекопитающих. Непосредственный контакт между нейроном и его мишенью
вызывает реорганизацию мембраны и цитоскелетных элементов
постсинаптической клетки, в результате чего возникает утолщение
постсинаптической мембраны, известное как postsynaptic density (PSD).
Такое уплотнение является областью, где необходимы трансмембранные,
связанные с мембраной, цитоскелетные и цитоплазматические элементы для
каждого аспекта формирования, поддержания, пластичности синапсов и для
функции конвергенции. See also: Chemical synapses
MAGUKs млекопитающих, такие как PSD95, ответственны за организацию
PSD белков. включая глютаматовые рецепторы, регуляторные молекулы и
структурные белки. Два главных типа глютаматовых рецепторов присутствуют в
головном мозге: NMDA рецепторы (активируемые N-methyl-d-aspartate) и AMPA рецепторы
(активируемые α-amino-3-hydroxy-5-methyl-isoxazole-4-proprionic acid).
NMDA рецепторы важны для зависимой от активности синаптической
пластичности, тогда как AMPA рецепторы обеспечивают быструю передачу
сигналов через синапсы. В головном мозге взрослых, glutamatergic синапсы
обычно содержат смесь этих двух рецепторов и их эффективность в передаче
пресинаптических сигналов зависит от количества присутствующих рецепторов,
а также от соотношения AMPA и NMDA рецепторов. Специфические MAGUKs
ассоциируют посредством специфических областей, называемых PDZ доменами,
или с AMPA рецепторами (glutamate receptor interacting protein (GRIP),
AMPA receptor binding protein (ABP) и PICK1) или с NMDA рецепторами (PSD95
and SAP102 (synapse associated protein)) (Figure 3). Нарушение связи между
AMPA рецепторами и GRIP, ABP и PICK1 (protein interacting with C kinase 1)
предупреждает образование кластеров этих рецепторов в синапсах. Вместо
этого, мыши, лишенные PSD95, обнаруживают нормальное образование кластеров
NMDA рецепторов в синапсах, но нижестоящие сигнальные события, которые
обычно сопровождают активацию этих рецепторов серьезно нарушены. Это
подчеркивает функцию MAGUKs как мест пришвартовки (docking) для рецепторов
нейротрансмиттеров, внутриклеточных сигнальных молекул (таких как
calmodulin kinase), цитоскелетных акцессорных белков (таких как CRIPT
(cysteine-rich interactor of PDZ 3)) и молекул клеточной адгезии (таких
как neuroligin). Пути передачи внутриклеточных сигналов, зависимые от
MAGUKs, могут регулировать количество рецепторов для
нейротрансмиттера, чувствительность и форму дендритных шипов (spine), все
они могут менять эффективность синаптической передачи. See also: NMDA
receptors; AMPA receptors; Glutamatergic synapses: molecular organization
Др. белки, участвующие в постсинаптической дифференцировке в NMJ
присутствуют также и некоторых синапсах ЦНС. Dystroglycan, dystrophin и
utrophin были выявлены в субнаборах центральных синапсов, а
отсутствие dystrophin при мышечной дистрофии Дюшена может
приводить к интеллекутальным нарушениям и нарушениями синаптической
передачи в сетчатке. Syntrophins присутствуют в некоторых glutamatergic
синапсах, где они могут взаимодействовать с NMDA рецепторами и ионными
каналами. See also: Duchenne muscular dystrophy
Однако, имеется множество отличий между нейромышечными и
межнейронными синапсами. Напр., пресинаптические молекулы, которые
запускают образование PSD ЦНС, неизвестны и нет доказательств вовлечения
agrin или MuSK в образование этих синапсов. Базальные мембраны, которые
управляют формированием постсинаптической области в NMJ, отсутствуют в
центральных синапсах. Синаптическая шель гораздо уже в ЦНС, возможно
благодаря трансмембранным белкам, экспрессируемым на пресинаптических и
постсинаптических элементах, чтобы взаимодействовать непосредственно др. с
др., и тем самым устраняется необходимость в хорошо организованной
базальной мембране. В самом деле, молекулы межклеточной адгезии, такие как
cadherins, ephrins/ephrin рецепторы и neurexin/neuroligan комплексы,
концентрируются в наиболее центральных синапсах, а некоторые (neurexins и
neuroligans) участвуют в группировке пресинаптических и постсинаптических
субмембранных структур. Кроме того, некоторые белки, которые секретируются
в NMJ, такие как neuregulin, присутствуют своими связанными с
мембранами или трансмембранными изоформами в межнейрональных синапсах
(Figure 3). В частности, neuregulin регулирует экспрессию NMDA
рецепторов в ЦНС. Экспрессия рецепторов AMPA, как было установлено,
регулируется с помощью neurotrophins, таких как brain-derived neurotrophic
factor. Т.о., многие из существенных образований синапсов ЦНС отражаются в
структуре и функции NMJ, но многие из молекулярных игроков в корне не
сопоставимы и их регуляция более утонченная, отражающая более высокий
потенциал изменений в центральных синапсах. See
also: Ephrins; Trophic support
Нейроны являются поляризованными клетками, а тела клеток, которые
содержат ядро и большую часть кухни по синтезу белков, обычно
располагается очень далеко от поступающих синаптических импульсов.
Образование и элиминация синапсов, также как и модуляция синаптической
активности происходят посредством локальных изменений слишком быстро,
чтобы соответствовать синтезу и транспорту белков из ядра в синапсы, тогда
как долговременные изменения в синапсах нуждаются в синтезе РНК и белка.
Хотя ученые всё ещё бьются над этим вопросом, появляется некоторая
ясность. See also: Neurons
Изучение некоторых дендритных синапсов с помощью ЭМ показало
присутствие упрощенного аппарата для синтеза белков с их мРНК. мРНК для
некоторых синаптических белков, включая некоторые рецепторы
нейротрансмиттеров, в самом деле, были найдены, концентрирующимися под
PSD. Локальный синтез синаптических белков делает возможным увеличение или
понижение количества специфических белков с очень короткой задержкой.
Альтернативно, в некоторых синапсах, по-видимому, имеются резервные пулы
пресинтезированных рецепторов нейротрансмиттеров и ионных каналов,
ожидающих соотв. сигнала, чтобы вставиться в мембрану. В др. случаях
рецепторы нейротрансмиттеров, по-видимому, ‘перемещаются’ в и из периферии
синаптического сайта, тем самым затрагивается их способность отвечать
эффективно на высвобождение нейротрансмиттеров. Эти перестройки зависят от
модуляции закрепления рецепторов нейротрансмиттеров на синаптическом
цитоскелете. Перестройки цитоскелета коррелируют также с изменениями в
форме или количестве постсинаптических элементов, снижая или увеличивая
поверхность контакта с пресинаптическими окончаниями. Синаптическая
активность может также модулироваться за счет изменения количества
высвобождаемого нейротрансмиттера нервными окоанчаниями. Наконец, недавние
эксперименты продемонстрировали существование ‘молчащих’ glutamatergic
синапсов во время развития, когда постсинаптический аппарат не отвечает на
высвобождение нейротрансмиттера даже тогда, когда присутствуют glutamate
рецепторы. Эти синапсы, по-видимому, имеют только NMDA рецепторы, которые
может быть активированы с помощью glutamate только после деполяризации
мембраны, после выброса ионов магния, которые засоряют поры каналов.
Трансформация этих молчащих синапсов в активные синапсы требует включения
AMPA рецепторов в мембрану, чтобы деполяризовать клетку. See also: Dendrites; Axonal
transport and the neuronal cytoskeleton; Nitric oxide as a neuronal messenger
Следовательно, формирование, ремоделирование и активность центральных
синапсов может регулироваться локально за счёт изменчивости механизмов,
включая локальный синтез белков, перераспределение предсуществующих
белков, изменения поверхности синаптического контакта, модуляция
высвобождения нейротрансмиттеров и активация или десенсибилизация
рецепторов нейротрансмиттеров. See
also: Heterosynaptic
modulation
Synapse Elimination
Во время развития имеется избыточная продукция синапсов, а с
созреванием несоответсвующие синаптические контакты элиминируются. Этот
процесс упрощения происходит в некоторых NMJs у позвоночных и во всей
нервной системе у млекопитающих. Элиминация синапсов опирается на
локальную конкуренцию между нервными окончаниями за определенные мишени и
её конечный результат - упрощение нейрональных дуг (circuitry), чтобы
достичь максимальной эффективности и сегрегации импульсов (inputs) в
функционально соотв. домены (see below). See
also: Vertebrate central nervous system:
pattern formation; Neural activity and the
development of brain circuits
Synapse elimination at the vertebrate neuromuscular
junction
Как только двигательный нейроны вступают в развивающуюся мышечную
массу, они ветвятся и образуют одиночный синаптический контакт на каждом
быстро сокращающемся мышечном волокне. После этого первого контакта
поверхность мышечного волокна становится рефрактерной к последующей
иннервации, но последующие двигательные нейроны способны образовывать
синапсы в месте первого контакта (input). Все кроме одного последовательно
исчезают. Т.о., двигательные нейроны конкурируют не только за одно и то же
мышечное волокно, но и также за одну и ту же область на данном мышечном
волокне. Конкуренция, как было показано, зависит от электрической
активности. Если один двигательный нейрон ‘молчит’, что освобождает его от
высвобождения ацетилхолина, то его контакт элиминируется. Сходным образом,
если один двигательный нейрон искусственно стимулируется, так что он
высвобождает ацетилхолин более часто, то его контакт будет сохранен, а др.
двигательные нейроны уберут свои окончания. Этот процесс не затрагивает
жизнеспособности двигательных нейронов, а влияет только на количество
мышечных волокон, которое каждый нейрон д. обязательно иннервировать.
Анатомически это характеризуется атрофией, отсоединением и обязательно
отходом отростков неудачного (‘defeated’) двигательного нейрона (Figure
1d).
Клеточные и молекулярные механизмы, которые лежат в основе элиминации
синапсов изучены плохо. Двигательные нейроны могут конкурировать за
субстрат, секретируемый в ограниченном количестве мышечными волокнами и
необходимый для поддержания отростков нейрона. Эффективное потребление
этой субстанции нервом или его высвобождение мышцей может быть зависимым
от активности. Альтернативно, мышца может высвобождать субстанции,
такие как proteases, которые дестабилизируют нервные окончания.
Электрическая активность может влиять на высвобождени е ингибиторов
протеаз, способствуя тем самым более активному нейрону. Эти две гипотезы
постулируют присутствие субстанций, которые взаимодействуют с
конкурирующими моторными нейронами, а успех базируется на способности
одного нейрона или увеличивать потребление предпочтительной субстанации,
или защищать себя самого от дестабилизирующей субстанции. Исследования,
базирующиеся на непосредсвенном наблюдении окончаний живых нервов
подтвердили, что благоприятная или наказывающая субстанция высвобождаются
мышцей только внутри микродоменов синаптического контакта и затрагивают
только этот домен и покрывающие его нервные окончания. Эта модель
предсказывает, что некоторые локальные изменения в постсинаптическом
аппарате д. противодействовать ретракции нервных отростков. В самом деле
уровни ацетилхолиновых рецепторов, utrophin и rapsyn, снижаются
локально перед любыми изменениями, выявляемыми в нервных окончаниях,
которые действительно д. б. удалены.
Synapse elimination in the central nervous
system
Как и в мышцах синаптическая активность, как было установлено, играет
роль в уменьшении синаптических соединений в ЦНС и в некоторых случаях
сходные нейроны, как было установлено, конкурируют за одну и ту же мишень.
В др. случаях разные популяции нейронов, которые иннервируют одну и ту же
мишень но не конкурируют за один и тот же синаптический сайт, оказывают,
как было установлено, влияние др. на др. даже на значительном расстоянии.
Одна из хорошо известных гипотез ставит условие, что время синаптической
активности предопределяет, какие синапсы будут элиминированы. See also: Dendritic
spines
Важность совпадающей активации двух отдельных синаптических вводов
(inputs) впервые продемонстрирована в 1949 Hebb, который предположил, что
ко-активация пресинаптических и постсинаптических нейронов ведет к
усилению их синаптической связи. Отсутствие ко-активации должно в свою
очередь приводить к ослаблению синаптических соединений. ‘Hebbian’ правило
очень хорошо согласуется с элиминацией синапсов в ЦНС и находит её
идеального молекулярного игрока в NMDA рецепторах, активация которых
обладает двойной потребностью в связывании glutamate и в
постсинптической деполяризации. Совпадающая синаптическая активация от
двух разных вводов в одну и ту же постсинаптическую клетку ведет к
открытию NMDA рецепторов и поступлению ионов кальция. Локальное, быстрое
увеличение концентрации внутриклеточного кальция ведет к активации
разнообразных сигнальных путей, чьи эффекты могут варьировать от
локальных изменений в морфологии синапсов до активации генов, до этого
молчавших, затрагивая тем самым клетку целиком. Лекарства, которые влияют
на активацию NMDA рецепторов, как было установлено, мешают элиминации
синапсов во многих областях развивающегося головного мозга, включая
зрительный кортекс и мозжечок. See
also: Long-term potentiation;
NMDA receptors; Drugs
and the synapse
Первый и лучше всего известный пример элиминации синапсов в ЦНС
получен в исследованиях зрительной системы позвоночных. Ганглиолярные
клетки сетчатки из каждого глаза проецируются в два боковых geniculate
ядра в каждом полушарии головного мозга. Аксоны от двух глаз расходятся в
боковые geniculate ядра и заканчиваются в разных слоях, которые являются
исключительно монокулярными (каждый слой получает входные импульсы
исключительно от одного из глаз). Латеральные geniculate нейроны в свою
очередь проецируются в первичный зрительный кортекс, где их аксоны опять
разделяются в соответствии с происхождением глаза, формируя ocular
dominance столбы внутри слоя 4 зрительного кортекса. Др. словами, пучок
(band) нейронов в слое 4 получает входящие импульсы преимущественно от
левого глаза, тогда как соседний пучок нейронов воспринимает в основном
синаптические импульсы от правого глаза. Нейроны в др. слоях зрительного
кортекса получают входящие сигналы от клеток слоя 4. В этом случае
входящие импульсы, представляющие два глаза, конвергируют. Это первая
стадия бинокулярного зрения. See also: Visual system development in vertebrates
На самых ранних стадиях развития столбы ocular dominance были описаны
первоначально туманно из-за перекрывающихся проекций от двух глаз.
Сортировка аксонов и генерация столбов в кортексе, как полагали некоторые
исследователи, является результатом конкуренции среди аксонов за два
глаза, управляемые с помощью волн спонтанной активности, которые
распространяются поперек сетчатки. Зрительное восприятие вносит вклад в
дальнейшую сегрегацию и ведет к зрелости столбов. Недавние данные
показали, что от начала аксоны ведутся от боковых geniculate, чтобы
сформировать столбы внутри зрительного комплекса. Все согласны, однако,
что зрительное ощущение регулирует расхождение аксонов независимо от того,
устанавливается ли оно первоначально независимой активностью или за счет
спонтанной активности сетчатки.
Важность зрительной стимуляции для элиминации синапсов элегантно
продемонстрирована в пионерских исследованиях Hubel и Wiesel, которые
использовали модель селективной зрительной утраты (deprivation). Они
показали, что закрытие одного глаза ведет к увеличению области мишени
открытого глаза в зрительном кортексе, так что почти все клетки отвечают
на стимуляцию в открытом глазу. Закрытый глаз становится функционально
слепым, даже если сетчатка функционирует нормально, состояние названное
amblyopia. Эти эксперименты иллюстрируют, как использование зрительной
системы придает форму её проводящим путям во время критического
онтогенетического окна и подтверждает, что взаимодействия с нашей внешней
средой может менять развитие нашего мозга. See also: Wiesel, Torsten
Nils
Др. хорошо изученным примером элиминации синапсов в ЦНС является
мозжечок. Два больших класса нейронов присутствуют в мозжечке: крупные
клетки Пуркинье и значительно более многочисленные гранулярные клетки.
Каждая клетка Пуркинье получает синаптический входящие импульсы вблизи
своего клеточного тела от одиночного аксона (climbing fibre), исходящего
от нижнего olivary ядра, а также большое количество входящих
импульсов на уровне своего разросшегося дендритного древа от аксонов
(parallel fibres) гранулярных клеток. Во время развития аксоны от более
чем одного нейрона из нижних олив иннервируют каждую клетку Пуркинье.
Иннервация от параллельных волокон происходит в то же самое время, когда
происходит инициальная элиминация синапсов от системы climbing волокон, и
входящие сигналы от параллельных волокон необходимы для элиминации
множественной иннервации с помощью climbing волокон. У мутантных мышей
weaver и reeler или у облученных мышей, у которых
отсутствуют гранулярные клетки, клетки Пуркинье остаются множественно
иннервированными. В мозжечке NMDA рецепторы присутствуют в
гранулярных клетках, а также временно на клетках Пуркинье.
Хроническое воздействие на мозжечок лекарств, которые ингибируют активацию
NMDA рецепторов во время периода элиминации синапсов даёт в результате
сохранение синапсов от множественных climbing волокон на индивидуальных
клетках Пуркинье, подтверждая, что NMDA рецепторы и скоординированная
синаптическая активация параллельных и climbing волокон необходима для
элиминации синапсов в этой системе. Гранулярные клетки , следовательно,
могут влиять на количество синаптических вводов от climbing волокон на
клетки Пуркинье, однако, для этого необходима кооперация частично и самих
клеток Пуркинье. Клетки Пуркинье мутантов lurcher формируют
функциональные синапсы с параллельными волокнами, но они неспособны
инициировать элиминацию избыточных синапсов climbing волокон,
указывая тем самым, что деполяризация сама по себе клеток Пуркинье
недостаточна для элиминации синапсов и что необходимы др. факторы,
присущие клеткам Пуркинье. See
also: Cerebellar plasticity; Cerebellum: anatomy and organization
Каковы же эффекты неспособности элиминации лишних синапсов в
мозжечке? В зрелом мозжечке паттерн соединений climbing волокон
организован в сагитальные пучки (bands) и в дальнейшем подразделяется на
микро-зоны. Climbing волокна активируются с помощью разнообразных внешних
стимулов, включая движения усов. Сенсорная информация от усов позволяет
животным определять положение объектов в окружающей их среде, когда они их
не видят. Электрофизиологические исследования мутантных животных, у
которых не произошла элиминация синапсов, обнаруживается, что общая
топографическая организация синаптических вводов от olivary нейронов в
мозжечок не изменена. Однако, стимуляция усов показывает, что отсутствует
функциональная сегрегация вводов у этих животных. Следовательно, с помощью
сегрегации вводов к соответствующим областям мишеням мозжечка элиминация
синапсов предопределяет нормальную поведенческую реакцию на внешние
стимулы . See also: Cortical barrels: maps and plasticity
Summary
Synapse formation stems from a complex set of interactions between
two cells that results in the creation of a subcellular region specialized
for the efficient transfer of information between a neuron and its target.
Studies at the NMJ indicate that molecules released by the nerve initiate
a signalling cascade in the target cell that leads to the aggregation of
neurotransmitter receptors, specific basement membrane proteins and ion
channels, as well as a variety of intracellular cytoskeletal elements.
Contact with the presynaptic cells therefore induces a radical
rearrangement of extracellular, transmembrane and cytoskeletal proteins in
the postsynaptic cell. Gene expression in the postsynaptic cell is also
altered, increasing synthesis of the appropriate neurotransmitter receptor
and affecting its targeting at the synapse. The postsynaptic cell
participates in this process by releasing molecules that arrest the growth
of the axon and promote the differentiation of a synaptic terminal via
mechanisms that are still unknown. A similar sequence of events is likely
to take place during synapse formation in the CNS, where some proteins
found at the NMJ are also expressed. However, neurons receive thousands of
synapses and change transmission characteristics and shape more rapidly
than NMJs, indicating that additional mechanisms must be used by neurons
to regulate synaptic efficacy. See
also: Synapse formation
The developmental period of synapse formation is often followed by
synapse elimination, whereby ‘inappropriate’ synaptic inputs are
dismantled and axonal branches retracted. The disassembly of clusters of
extracellular, transmembrane and cytoskeletal elements, as well as a
decrease in adhesion, accompanies synapse elimination between the
presynaptic and postsynaptic cells, leading to a detachment and subsequent
dedifferentiation of the synaptic terminal. While cellular interactions
play a dominant role in axonal guidance to the appropriate target field
and in synapse formation, synchronous activation of synaptic contacts
appears to be the main trigger of synapse elimination. See also: Vertebrate
central nervous system: pattern formation
Studies on synapse elimination have revealed its central role in the
refinement of connections based on their functional significance. They
have also highlighted the importance of our environment in shaping the
wiring of our brain. We have focused here on the importance of visual and
mechanical (vibrissae) stimulation in the refinement of connections in the
CNS; however, there is evidence for a similar role of other sensory
stimuli such as smell, as well as of sex-related hormones. Critical
windows for remodelling of connections vary from one structure of the
brain to another, and some of them appear to remain open for our entire
life. Indeed, many parallels exist between synapse elimination and synapse
remodelling during learning and memory. Both seem to follow the hebbian
rule and are in part dependent on the activation of the NMDA receptor. A
better knowledge of the molecular mechanisms that govern both synapse
formation and elimination might therefore open a window on the mechanisms
underlying the remodelling of synaptic connections that occurs in the
adult brain as a response to changing external stimuli and that ultimately
underlies our behaviour and our ability to adapt to a changing
environment. See also: Oestrogens, mood and cognition; Bird song: steroid hormones and plasticity; Learning and memory
Originally published: March 2001
Further Reading
Bennett MR (1999) Synapse formation molecules in muscle
and autonomic ganglia: the dual constraint hypothesis. Progress in
Neurobiology 57: 225–287.
Burden SJ (1998) The formation of neuromuscular synapses. Genes and Development 12: 133–148.
Keshishian H, Chiba A and Bate M (1996) The Drosophila neuromuscular junction: a model system for studying synaptic development. Annual Review of Neuroscience 19: 545–575.
Kim JH and Huganir RL (1999) Organization and regulation of proteins at synapses. Current Opinion in Cell Biology 11: 248–254.
Klintsova AY and Greenough WT (1999) Synaptic plasticity in cortical systems. Current Opinion in Neurobiology 9: 203–208.
Lohof AM, Delhaye-Bouchaud N and Mariani J (1996) Synapse elimination in the central nervous system: functional significance and cellular mechanisms. Reviews in the Neurosciences 7: 85–101.
Sanes JR and Lichtman JW (1999) Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience 22: 389–442.
Shatz CJ (1990) Impulse connectivity and patterning of connections during CNS development. Neuron 5: 745–756.
Burden SJ (1998) The formation of neuromuscular synapses. Genes and Development 12: 133–148.
Keshishian H, Chiba A and Bate M (1996) The Drosophila neuromuscular junction: a model system for studying synaptic development. Annual Review of Neuroscience 19: 545–575.
Kim JH and Huganir RL (1999) Organization and regulation of proteins at synapses. Current Opinion in Cell Biology 11: 248–254.
Klintsova AY and Greenough WT (1999) Synaptic plasticity in cortical systems. Current Opinion in Neurobiology 9: 203–208.
Lohof AM, Delhaye-Bouchaud N and Mariani J (1996) Synapse elimination in the central nervous system: functional significance and cellular mechanisms. Reviews in the Neurosciences 7: 85–101.
Sanes JR and Lichtman JW (1999) Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience 22: 389–442.
Shatz CJ (1990) Impulse connectivity and patterning of connections during CNS development. Neuron 5: 745–756.
