"...Ещё важнее осознание того, что в природе не существует фагов с (одноцепочечной) РНК, геном которых был бы больше, чем примерно 10000 нуклеотидов. Это заставляет полагать, что ферментативный механизм репликации РНК... достиг своего оптимума и не может быть далее улучшен. Никакая одноцепочечная РНК не способна поддерживать правильное воспроизведение информации, превышающей то количество, которое по порядку величины эквивалентно 1000-10000 нуклеотида.
Конечно, с химической точки зрения могут существовать молекулы большей длины, но они не имеют эволюционной ценности".
М. Эйген, П. Шустер (1982).
В классической и широко распространённой модели мира РНК предполагается, что РНК не просто предшествовала ДНК, но и также, что молекулы РНК per se были способны осуществлять катализ собственного воспроизведения и биосинтеза компонентов. В пользу этого предположения в настоящее время накоплено немало фактов: способность молекул РНК к копированию (однако очень неточному - см. Рибозимы могут размножать друг друга), способность молекул РНК катализировать широчайший пул реакций, который существенно расширяется благодаря многочисленным РНК-кофакторам (см. интересный обзор Коферменты и эволюция мира РНК), которые, как оказалось, способны не только катализировать окислительно-восстановительные реакции, переносить ацильную и метильную группы, но даже репарировать нуклеиновые кислоты, что, как увидим ниже, было крайне важным для мира РНК (см. Что было кофактором ферментов в мире РНК? и [Nguyen K.V., Burrows C.J. 2011]).
Для того, чтобы попробовать оценить размеры РНКовых геномов в РНК-организмах и их мутационный фон, проанализируем эти свойства в современных РНКовых вирусах.
По сравнению с ДНКовыми вирусами РНКовые характеризуются исключительно высокой скоростью мутаций и малыми размерами генома. Полимеразы, катализирующие репликацию РНК, и обратная транскриптаза имеют минимальные возможности для исправления ошибок синтеза. В результате, частота возникновения ошибок при синтезе РНК приблизительно в 100 тысяч раз выше, чем при репликации ДНК.
Это означает, что геном любой индивидуальной частицы РНК-содержащего вируса будет содержать одну или несколько мутаций, отличающих его от последовательности дикого типа данной вирусной разновидности. Этот простой факт имеет далеко идущие последствия для биологии и эволюции как РНК-содержащих вирусов, так и предковых рибоорганизмов, потому что потомство РНК-вируса (природное или лабораторное) представляет собой не совокупность однородных двойников, а скорее молекулярный рой родственных нуклеотидных последовательностей, сгруппированных в месте синтеза последовательностей. Этот молекулярный рой или “квази-разновидность” обеспечивает источник фенотипических вариантов, которые могут быстро ответить на изменяющееся давление естественного отбора. Как следствие, РНК-содержащие вирусы могут эволюционировать в миллион раз быстрее чем, ДНК-организмы.
Средняя длина такого РНК-вирусного генома составляет 9 kb, а максимальная у Coronaviridae 30 kb [Atkins J.F. 1993; Marra M.A. et al.2003; Rota P.A. et al.2003; Belshaw R. et al. 2007].
Вирусные полимеразы (РНК-зависимые РНК-репликазы и обратные транскриптазы) характеризуются высокой частотой введения неправильных оснований в растущую цепь. Репликация РНКовых вирусов приводит к высокой скорости точечных мутаций порядка одной на 10000 в процессе репликации [Drake J.W. et al. 1998]. Такая скорость мутаций на несколько порядков выше скорости возникновения точечных мутаций в ДНКовых вирусах.
Долгое время считалось, что в РНК-полимеразе отсутствует корректирующий 3’-5’-экзонуклеазный домен [Steinhauer D.A. et al. 1992]. Однако в уже во второй половине 80-х годов была обнаружена 3'-5'-экзонуклеазная активность у РНК-полимеразы вируса гриппа, что стало первым доводом в пользу такой корректирующей активности [(Ishihama A. et al. 1986]. Впоследствии это предположение было подтверждено для многих РНК-полимераз и кроме того доказана возможность репарации различных видов повреждений РНК см. в качестве обзора [].
Этот факт позволяет всё-таки поднять планку для рамеров РНК-генома, однако в связи с накапливающимися данным о такого рода активностями оценки максимально значимой части генома РНК должны быть выше, чем те, которые были оценены М. Эйгеном (см. цитату в начале статьи).Тем не менее размеры геномов современных РНК-вирусов хорошо показывают, что очень трудно представить, чтобы значащая часть РНК-генома всё-таки превышала бы 30 kb.
Другим возможным фактором неточности воспроизведения молекул РНК является возможность образования "качающихся" (wobble) пар, особенно GU-пар, которые активно образуются при формировании пространственной структуры РНК, а также при трансляции (см. Молекулярные механизмы обеспечения вырожденности кода). Показано образование пар между G и U при репликации РНК-вирусов [Weissmann Ch. et al. 1968].
Учитывая размер одной из групп РНК-вирусов - пикорновирусов (7-8 kb), можно говорить, что практически после каждого акта репликации возникает мутантная форма вируса.
Могут ли эти факты что-нибудь сказать о мире РНК? До сих пор не обраружено в РНК-вирусах РНК-репликазы рибозимной природы. Этот факт можно объяснить и чаще объясняют тем, что рибозимные РНК-репликазы могли быть смещены в РНКовом мире белковыми аналогами вследствие их более высокой эффективности. Высокая эффективность РНК-репликаз по-видимому означает в первую по важности очередь меньшую частоту ошибок, и только во вторую очередь – скорость репликации. Если такое замещение имело место быть, то это означает, что рибозимные РНК-репликазы были менее эффективны и должны были допускать ещё большую частоту образования точечных мутаций, а значит, и существенно меньший размер геномов по сравнению с современными РНКовыми вирусами.
Тем не менее, с точки зрения рассматриваемого объяснения этот факт всё равно остаётся удивительным с другой точки зрения: наряду с небольшими самими по себе РНК-вирусами существуют ещё и так называемые вироиды, которые имеют совсем небольшой размер - менее тысячи нуклеотидов. А, значит, уж для них-то рибозимные репликазы вполне могли бы быть. Однако мы их до сих пор не обнаружили. Этот дополнительный факт говорит, что рибозимных РНК-репликаз могло и не быть вовсе.
Ещё один факт, характерный для пикорновирусов, и могущий быть перенесённым на рибоорганизмы – смена матрицы при репликации. Синтез комплементарной цепи может преждевременно останавливаться, и эта цепь, или её 3’-конец отделяется от матрицы и перемещается на другую молекулу РНК. В результате обеспечивающая выскокий уровень рекомбинции, а следовательно позволяющая уменьшать генгруз мутаций.
Поэтому второй вывод, который можно допустить исходя из приведённых выше фактов заключается в том, что до возникновения мира ДНК, на ранних статиях формирования аппарата трансляции, когда кодируемый белковый синтез ещё не был окончательно оформлен и канонический генетический код не был сформирован, но уже существовали древние аналоги мРНК, на которых мог происходить примитивный, в том числе и неоднозначный синтез белков, в качестве матриц могли участвовать перекрывающиеся последовательности РНК, а также комплементарные цепи РНК.
Важно, что место контакта отделившегося 3’-конца растущей комплементарной цепи должно быть точно предопределено. Такой процесс смены матрицы при синтезе комплементарной цепи можно допустить и в рибоорганизмах.
Факт смены матрицы, как оказалось типичен не только для вирусов, но даже для эубактерий, в которых была найдена так называемая транспортная матричная РНК (тмРНК) [Withey J.H., Friedman D.I. 2002; Valle M. et al. 2003]. Часть молекулы, в первую очередь акцепторный стебель, имеет сходство с аланиновой тРНК и внутреннюю рамку считывания, кодирующую короткий пептид – пептидную метку (peptide tag).Она необходима для принципиально иного типа трансляции – так называемой транстрансляции, осуществляемой на двух разных мРНК (рис. 1). тмРНК действует и как тРНК, и как мРНК. Если на усечённой мРНК отсутствует стоп-кодон, то на действующей рибосоме останавливается трансляция. С А-сайтом рибосомы связывается тмРНК, на которую переносится пептидильная группа. Затем при транслокации из рибосомы вытесняется мРНК и в качестве новой мРНК действует кодирующая последовательность тмРНК, которая способна связывать антикодоны уже следующей тРНК, связывающееся с А-сайтом рибосомы (рис. 1).
Сама тмРНК аминоацилируется аланиновой АРСазой. Не ясным остаётся вопрос, являются тмРНК реликтом, оставшимся у последнего универсального предшественника, которые были утеряны двумя другими доменами жизни (археями и эвкариотами), или же эти системы возникли de novo? В пользу того, что тмРНК могла быть унаследована от последнего универсального предшественника как раз и говорит тот факт, что существуют РНКовые вирусные геномы, которые могут также одновременно функционировать и как тРНК (инициирующая), и как матрица для трансляции.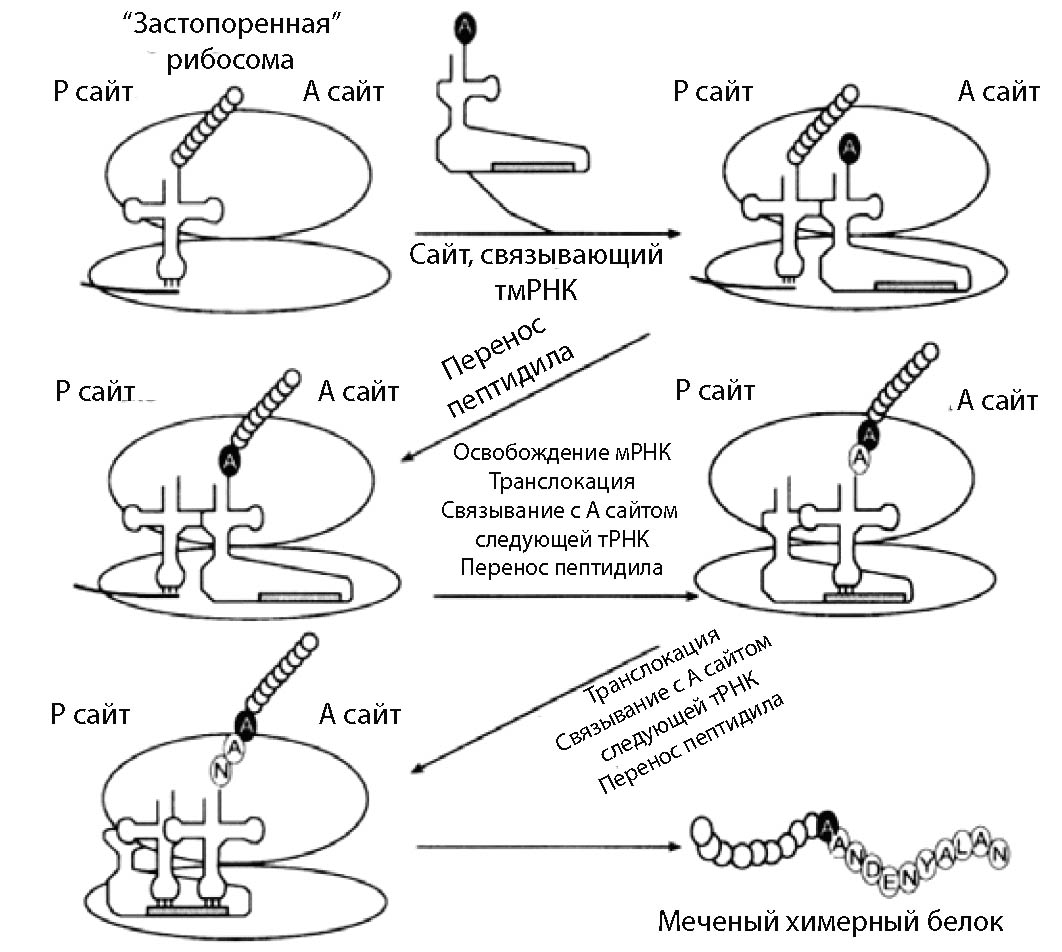
Рис. 1. Транстрансляция.
Как рибоорганизмы при минимальном размере генома могли усложнять свою организацию? Частичный ответ на этот вопрос дают стратегии РНК-вирусов.
1. Увеличение кодирующей ёмкости РНК. Поскольку верхний предел размера вирусного генома ограничен выской скоростью мутаций, то скорее правилом, чем исключением, является тот факт, что многие вирусные геномы имеют перекрывающиеся гены, кодирующие информацию на комплементарных цепях РНК, или на одной и той же цепи, как со сдвигом рамки трансляции, так и без сдвига, в том числе с использованием неканонических стартовых кодонов, а также с помощью РНК-сплайсинга и РНК-редактирования [Belshaw R. et al. 2007]. Этому факту, в частности, хорошо соответствует модель попарного происхождения транспортных РНК на комплементарных цепях РНК (см. Древние тРНК с комплементарными антикодонами кодировались комплементарными РНК-парами).
2. Многофункциональность молекул РНК и кодируемых РНК белковых молекул. В пользу вероятной многофункциональности белковых молекул молекул говорят, в частности многочисленные факты использования вирусами белков, осуществляющих универсальный белковый синтез: рибосомных белков, факторов элонгации трансляции.
Очень интересным случаем многофункциональности является использование белков рибосомы в качестве компонента РНК-репликазы у некоторых вирусов. На основе этого факта была даже предложена модель согласованного появления трансляционного аппарата (так называется аппарат синтеза белка) и матричной репликации полимерной РНК [Maizels N., Weiner A.M. 1994].
Известна также многофункциональность АРСаз, также являющейся непременным атрибутом РНП (рибонуклеопротеиновго)-мира. Напомню, что АРСазы (аминоацил-тРНК-синтетазы) - это ферменты, которые высокоспецифично присоединяют аминокислоту к тРНК (см. Аминоацил-тРНК-синтетазы - два класса ферментов)
Поражает удивительная многофункциональность или самих АРСаз, или же ферментов, которые им высокогомологичны (то есть имеют с ними родственное происхождение).
В этой связи весьма впечатляющим является факт гомологии АРСаз второго класса дополнительной субъединице митохондриальнй ДНК полимеразы дрозофилы [Fan et al. 1999].
АРСазы участвуют в трансдукции, контроле трансляции, сплайсинге, транскрипции рибосомной РНК, деградации белков, синтезе аминокислот и др. (см. для обзора [Francklyn C. et al. 2002; Lee S.W. et al. 2004; Park S.G. et al. 2005]).
В настоящее время хорошо обоснована модель образования двух классов АРСаз (первого и второго типа) на комплементарных цепях РНК. Совсем недавно был найден ключ к разгадке происхождения этих двух классов тРНК был найден в геноме эвкариоты Achylia klebsiana, в которой на одной нити ДНК кодируется шаперон Hsp70, который гомологичен АРСазе класса II (белки-шапероны участвуют в фолдинге - сворачивании вновь синтезированных белков и о шапероне Hsp70 чуть более подробно сказано в статье Первые варианты генетического кода). И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие). Здесь мы видим один пример потенциальной многофункциональности АРСазы, причём шапероны являются возможно одними из ключевых молекул, уже принимавших участие в метаболизме мира РНК. На комплементарной же цепи кодируется другой гомолог АРСазы, но уже класса I - так называемый NAD-зависимый GDH-подобный фермент (глутамат-дегидрогеназа - ещё один пример поразительной многофункциональности АРСаз) [Williams T.A. et al. 2009].
Эта находка стала настоящим ключём - неким розетским камнем, позволившая пролить свет на происхождение АРСаз - АРСазы разных классов, когда они только появились, кодировались просто на комплементарных цепях РНК, после чего произошла их дивергенция.
Ну и конечно многофункциональность тРНК-подобных молекул, которые были способны не только служить адапторами в синтезе белка, но и структурами, на которых происходил синтез аминокислот (см. Древний дублетный генетический код был предопределён путями биосинтеза аминокислот) подобно тому, как на некотрых современных тРНК происходит биосинтез аминокислот глутамина и аспарагина. В англоязычной литературе такие опорные структуры обозначают словом scaffold.
Один из возможных вариантов компактизации геномов, благодаря многофункциональности, которую можно подсмотреть у РНК-вирусов - это возможность совмещения роли тРНК и как адапторов, и как матриц для синтеза белка, и как весьма специфичного комплекса для инициации трансляции. В вирусе жёлтой мозаики репы (Turnip yellow mosaic virus, TYMV), геном которого представлен одноцепочечной РНК, имеется структура, выполняющую сходную роль с тмРНК эубактерий [Barends S. et al. 2003]. На 3’-конце вирусноо генома находится тРНК-подобная структура, которая аминоацилирована валином (рис. 2). Трансляция гена полипротеина инициируется внедрением в P-сайт рибосомы тРНК-подобной структуры вирусной одноцепочечной РНК и кэпированного 5’-конца этой же молекулы в качестве мРНК. Таким образом, синтез белка полипротеина начинается с остатка валина.
В данном случае мы опять видим пример бифункциональности РНК, функционирующей как мРНК, так и как тРНК.
Не исключено, что сходный механизм инициации трансляции может наблюдаться и у других РНКовых вирусов, несущих на 3’-конце аминоацилированную тРНК-подобную структуру (см. подробный обзор в [Fechter P. et al. 2001]).
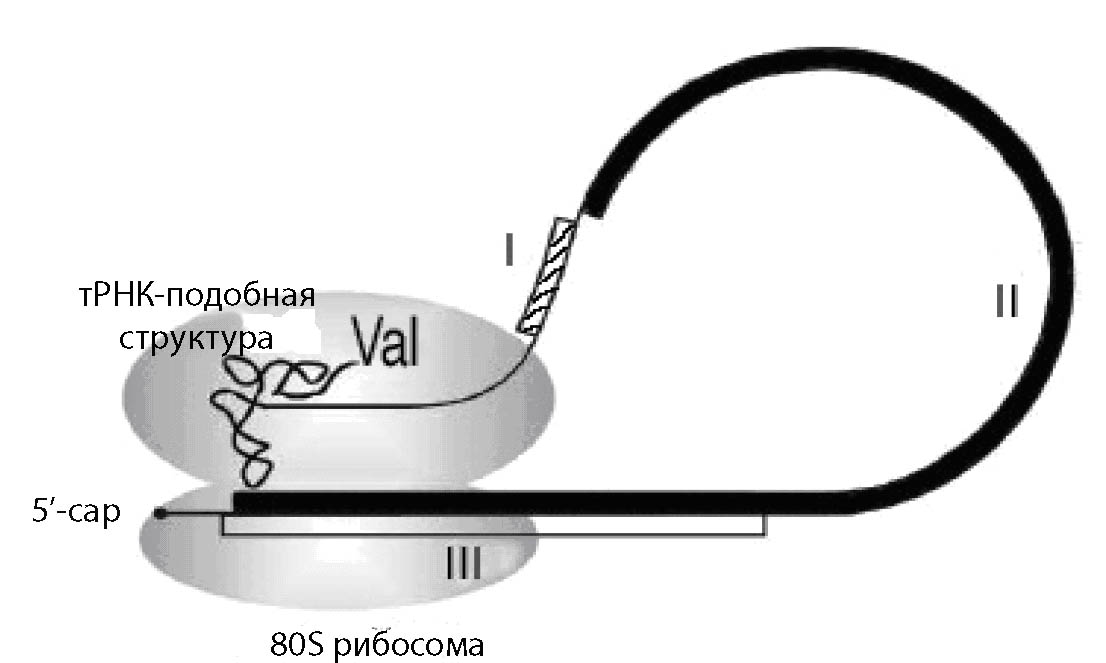
Рис. 2. Механизм инициации трансляции гена полипротеина вируса жёлтой мозаики репы с помощью аминоацилированной валином тРНК-подобной структуры. I- ген белка оболочки, II – ген полипротеина, III – ген белка движения. Рисунок взят из [Barends S. et al. 2003] с небольшими изменениями.
3. Не вызывает сомнения также то, что для избавления от груза вредных мутаций в РНК-мире большую роль играл процесс рекомбинации. Учитывая, что предположение от смене матрицы при транскрипции и трансляции могло быть обычным явлением, можно предположить, что этот процесс играл также существенную роль и в рекомбинации. Более подробно возможная роль рекомбинаций и фактов последовательного сшивания коротких фрагментов РНК в более длинные и роль этого процесса рассмотрена в статье Первые варианты генетического кода.
4. Один из факторов, позволяющих несколько уменьшить скорость возникновения мутаций - высокий уровень содержания нуклеотидов G и С. Это положение обусловлено тем, что нуклеотиды G и C воспроизводятся со значительно большей точностью, чем нуклелотиды A и U [Эйген М., Шустер П. 1982]. Таким образом, РНК-организмы были GC-богатыми. Возможно именно поэтому и кодоны с GC-нуклеотидами предположительно образовались первыми (см. Первые варианты генетического кода).
Таким образом, в мире РНК верхний порог значащей части генома вряд ли превышал 10 тысяч нуклеотидов. Хотя такой геном безусловно характеризовался крайней степенью компактизации: белки и тРНК кодировались комплементарными цепями, некоторые цепи кодировали не один а два или даже 3 белка благодаря сдвигу рамки считывания (ведь генетический код триплетен), как это реально происходит и в современных РНК-вирусах.
Однако такого размера генома вряд ли могло хватить для обеспечения всей наследственной информации. Ведь даже тРНК и АРСаз нужно было КАК МИНИМУМ по 20 типов. А ведь для кодирования современных АРСаз нужно, как правило, больше одной тысячи нуклеотидов! Кроме того, нужны были гены, кодирующие древний аналог рибосомы, каким бы примитивным он не выглядел. Даже в этом случае все эти гены могли занимать значащую часть генома уже очень близкую к предельной.
Этот факт означает, что существенная часть метаболических реакций вряд ли непосредственно катализировалась рибозимами или белками. Существенная часть наследственной информации по прежнему должна была оставаться в так называемом конформационном геноме, то есть предопределяться структурой полуавтономных сетей протометаболических реакций (см. подробнее Что было первым: метаболизм или ген. Могла ли жизнь начаться как циклическая химическая реакция неполимерных молекул?). Значительная часть ферментов, катализирующих реакции, связанные с биосинтезом аминокислот и специфическим аминоацилированием тРНК, по прежнему могли предопределяться не полимерным РНК-геномом, а памятью в метаболических сетях (см. Древний дублетный генетический код был предопределён путями биосинтеза аминокислот).
Однако в свете сказанного выше относительно особенностей репликации ВСЕХ РНК-вирусов, мало сомнений вызывает предположение о том, что сама древняя РНК-полимераза кодировалась именно как белковая молекула.
Литература.
Эйген М., Шустер П. Гиперцикл. Принципы самоорганизации макромолекул. Москва, "Мир", 1982.
Atkins J.F. Contemporary RNA genomes. P.535–556 in R. F. Gesteland and J. F. Atkins, eds. The RNA
world. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.1993.
Barends S., Bink H.H.J., van den Worm S.H.E., Pleij C.W.A., Kraal B. Entrapping ribosomes for viral translation: tRNA mimicry as a molecular trojan horse. // Cell. 2003. V.112. P.123-129.
Belshaw R., Pybus O.G., Rambaut A. The evolution of genome compression and genomic novelty in RNA viruses. // Genome Res. 2007. V.17. P.1496-1504.
Fan L., Sanschagrin P.C., Kaguni L.S., Kuhn L.A. The accessory subunit of mtDNA polymerase shares structural homology with aminoacyl-tRNA synthetases: Implications for a dual role as a primer recognition factor and processivity clamp. // PNAS. 1999. V.96. P.9527 - 9532.
Fechter P, Rudinger-Thirion J, Florentz C, Giegé R. Novel features in the tRNA-like world of plant viral RNAs. // Cell Mol Life Sci. 2001. V.58. P.1547-1561.
Francklyn C., Perona J.J., Puetz J., Hou Y.M. Aminoacyl-tRNA synthetases: Versatile players in the changing theater of translation.// RNA. 2002. V.8. P.1363-1372
Ishihama A., Mizumoto K., Kawakami K., Kato A.,Honda A. Proofreading function associated with the
RNA-dependent RNA polymerase from influenza virus. // J. Biol. Chem. - 1986. - V.261. - P.10417–10421.
Lee S.W., Cho B.H., Park S.G., Kim S. Aminoacyl-tRNA synthetase complexes: beyond translation. // J. Cell Science. 2004. V.117. P.3725-3734.
Maizels N., Weiner A.M. Phylogeny from function: Evidence from the molecular fossil record that tRNA originated in replication, not translation. // Proc.Nat.Acad.Sci.USA. 1994. P.6729-6734.
Marra, M.A., Jones S.J., Astell C.R. et al. (59 co-authors). The genome sequence of the SARS-associated coronavirus. // Science. - 2003. - V.300. P.1399–1404.
Nguyen K.V., Burrows C.J. A Prebiotic Role for 8-Oxoguanosine as a Flavin Mimic in Pyrimidine Dimer Photorepair. // J. Am. Chem. Soc. 2011. V.133. P.14586–14589.
Park S.G., Ewalt K.L., Kim S. Functional expansion of aminoacyl-tRNA synthetases and their interacting factors: new perspectives on housekeepers. // Trends in Biochemical Sciences. 2005. V.569-74. Review.
Poole A.M., Logan D.T. Modern mRNA proofreading and repair: clues that the last universal common ancestor possessed an RNA genome? // Molecular Biology and Evolution. 2005.
Rota P.A., Oberste M.S., . Monroe S.S et al. (35 co-authors). Characterization of a novel coronavirus associated with
severe acute respiratory syndrome. // Science - 2003. - V.300. P.1394–1399.
Steinhauer D.A., Domingo E. Holland J.J. Lack of evidence for proofreading mechanisms associated with an RNA virus polymerase. // Gene. 1992. V.122 P.281–288.
Valle M., Gillet R., Kaur S., Henne A., Ramakrishnan V., Frank J. Visualizing tmRNA entry into a stalled ribosome. // Science. 2003. V.300. P.127-130.
Weissmann Ch., Feix G., Slor H. Cold Spring Harbor Symp. Quant. Biol. 1968. V.33. P.83.
Williams T.A., Wolfe K.H, Fares M.A. No rosetta stone for a sense-antisense origin of aminoacyl tRNA synthetase classes. Mol Biol Evol. // 2009 V.26. P.445-450.
Withey J.H., Friedman D.I. The biological roles of trans-translation. // Curr. Opinion Microbiol. 2002. V.5. P.154-159.
Статьи, связанные с темой.
