Про химию
Про химию
 Любой,
не потерявший способность удивляться, если его привести в химическую
лабораторию и показать несколько эффектных химических трюков, будет поражен:
природное изумление новым и необычным, с красивыми эффектами, надолго завладеет
воображением. С понимаем, что это - не фокусы, а взаправду, приходит желание
разобраться: "а как это получается??" или, по самой наименьшей мере,
хотя бы желание заполучить возможность вот так же удивлять других.
Любой,
не потерявший способность удивляться, если его привести в химическую
лабораторию и показать несколько эффектных химических трюков, будет поражен:
природное изумление новым и необычным, с красивыми эффектами, надолго завладеет
воображением. С понимаем, что это - не фокусы, а взаправду, приходит желание
разобраться: "а как это получается??" или, по самой наименьшей мере,
хотя бы желание заполучить возможность вот так же удивлять других.
Такое проделал со мной отец в моем далеком щенячестве, после чего желание разобраться самому во всем этом понемногу развило нарастающий интерес, так что на химфаке оказался не случайно. Самое главное, что этот интерес мотивировал понимание и сделал его возможным, - как игрушки самым естественным образом делают более понимаемым то, что без этого оказывается непреодолимо сложным: так увлеченный салажка в компьютерных делах оказывается далеко впереди своей мамочки.
Конечно, удивляться - не самоцель :) Понимание химии дает возможность предвидеть свойства веществ и материалов, не гадать, а знать, почему так происходит, выбрать верный путь и получить желаемое. Понимание химии открывает глаза на окружающий мир, ведь он состоит из веществ.
Химия описывает все то, что придает веществу его наблюдаемые и используемые свойства. Химию боятся и не понимают многие люди еще со школы просто из-за отсутствия привычных аналогий и необычности сути атомов, электронов и молекул. Вот волшебная палочка в сказках - четко понятна: нужно махнуть ей и сказать желание, а молекула - нет и неясно: как и почему буквально все зависит от ее свойств. К сожалению, захватывающие сказки про молекулы в детстве не рассказывают, а заставляют учить нудные уроки про то, что толком даже не объясняют зримо и понятно.
Эта статья призвана устранить неприятие к атомам-молекулам :) Конечно же, дело не в самом его преодолении, а в том, что такое понимание позволит смотреть на мир совершенно другими глазами, видя то, что раньше даже не предполагалось, и не путаясь в том, что раньше вызывало непреодолимые сомнения. Чтобы получить возможность самому ясно представлять то, что раньше воспринималось как отрывочные сведения, верить или не верить в которые - было делом почти случайного выбора, а не определенности.
Короче, эта статья имеет задачу расширить мировоззрение в основы понимания свойств вещества. А это означает, что, несмотря на краткость статьи, возможно получить такие представления, которые позволят более глубоко разобраться в актуальных вопросах, когда станет нужно, например, с помощью инета при более суровом изложении.
Можно упрощенно, но достоверно представлять, что такое электрон, атом, молекула - это основа понимания всей химии потому, что все свойства веществу, кроме его массы (и всего, что зависит от массы), придает состояние электронов атома и разница между их общим отрицательным зарядом и положительным зарядом ядра. Поэтому несколько следующих абзацев - самое важное, после чего все остальное станет восприниматься легко и естественно. Так что достаточно освоить в режиме почти игрового любопытства несколько необычные, с точки зрения отсутствия привычных аналогов, проявления микро-реальности.
Для начала используем узнаваемые аналогии.
Атомы, для целей описаний химии, можно рассматривать как упругие или слипающиеся (в зависимости от условий) шарики разной массы, похожие на круглые матрешки потому, что электроны окружают их облаками, все большими по размеру (как и у матрешки два одинаковых не могут поместиться в одном месте). Электронные облака (что это такое станет понятнее потом), как и оболочки матрешки, не могут занимать место, уже занятое таким же точно облаком, поэтому вокруг атома образуются облачные слои, по очереди занимающие все доступные места, но два совершенно одинаковых по размерам облака могут еще отличаться ориентацией (направлением магнитных полюсов) своего электрического заряда (в грозовых облаках это - общий такой заряд), т.е. в одном месте могут быть два противоположно направленных электрона, условно говорят о разных "спинах" (раньше предполагалось, что электрон - это вращающаяся по орбите точка, отсюда такое название). Спин определяет, как направлен магнитный полюс электрона. Каждый электрон - это самый маленький из возможных магнитиков. Магнитные свойства вещества дает средне-общая ориентация всех электронов.
Положительный заряд ядра атома, при полном комплекте вложенных электронных оболочек, равен числу этих оболочек (каждая оболочка = 1 отрицательный заряд) и поэтому в целом заряд у такого атома отсутствует (все отрицательные заряды точно скомпенсированы положительными). Если сорвать одну оболочку, то атом станет более положительным, а если добавить еще электрон - то более отрицательным.
Атомы между собой отличаются по количеству элементарных положительных зарядов ядра, которому соответствует такое же количество компенсирующих их отрицательных зарядов электронов. В таблице Менделеева каждый следующий атом отличается от предыдущего на единицу таких зарядов. Но эта таблица показывается не в виде одной линии, а столбцами, в которых периодически, от строки к строке, меняется число электронов на последнем слое электронов от одного - до максимально возможного на этом слое, что определяет характер проявляемых им свойств. С такой таблицей становится очень наглядно и удобно видеть и предсказывать основные физические и химические свойства элементов, о чем будет написано ниже.
Все явления связей атомов в молекулы - это проявления взаимодействий атомных ядер и электронов, и для их образного понимания нужно лишь привыкнуть представлять, как взаимно влияют друг на друга электрические заряды ядер и электронов и ориентации их магнитов в каждом конкретном случае.
Все знают, что разноименные электрические (как и магнитные) заряды притягиваются (для химии не важно почему, природа - в электромагнитном взаимодействии, которое описывается на квантово-механическом уровне взаимовлиянием при распространении поляризации двух электромагнитных стоячих волн (см. Вакуум, кванты, вещество) и поэтому если встретятся два атома, один более положительный по электрическому заряду, другой более отрицательный, то они стянутся в одну молекулу. Но как можно тогда добавить еще электрон? Чем он будет притягиваться, если заряд ядра уже полностью скомпенсирован полным набором электронов?
Это - случай, когда у двух атомов окажутся связанными (спаренными) между собой электроны - не силами разных полюсов электрических зарядов. Похоже на то, как если взять два снежка и прижать один к другому, то, если снег липкий, они слипнутся, чуть вмявшись один в другой. Примерно так выглядят два атома со связавшимися электронами, оказавшимися достаточно "липкими" (для химии неважна природа этой липучести, но известно, что при этом возникает одна общая электронная оболочка из двух ранее отдельных электронов). Так получится молекула, по форме похожая на двойной снежок: два атома окажутся с одной общей двух-электронной оболочкой. Чтобы ее порвать, нужно затратить энергию (точно так же как нужно затратить энергию, чтобы растащить разноименные заряды: любой вид связи, чтобы его порвать требует энергии), а пока такая энергия не затрачена - атомы оказываются связаны спаренными электронами.
Попробуем понять, за счет чего же образовался такой вид
связи. Обычно такие связи образуются между атомами, у которых есть
неспаренные электроны. И тогда один из магнитиков электрона одного атома оказывается
скомпенсированным обратно повернутым магнитиком электрона другого атома. Два
таких атома образуют общую спаренную конфигурацию магнитиков ставших общими электронов. Кроме того, общая часть электронной плотности этих электронов оказывается между двумя атомными ядрами и
притягивается к ним обоим. Оба этих эффекта и дают общую картину связи.
Такой способ связи в химии условно
называют "ковалентной".
"Лишний" электрон может быть добавлен и в
случае, если образуется межэлектронная связь без участия еще одного атома, а
просто к атому с не спаренным электроном добавиться новый электрон (например, оторвавшийся от другого атома, с которым он был слабо связан) методом
примагничивания разнонаправленных спинов. Обычно электрон захватывается атомом
с почти полностью заполненным внешним слоем от атома с малым числом электронов
последнего слоя. Образуется два "иона", которые притягиваются в одну молекулу.
Cвязь - только за счет разноименных
зарядов двух атомов - "ионной" (потому, что атомы лишенные электронов
или, наоборот, имеющие лишние электроны, называются ионами).
Можно заметить, что принципиальной разницы между ковалентной и ионной связью
нет: вторая - просто предельный случай первой. Но проявляются они очень разными
наблюдаемыми эффектами. Поэтому очень стоит сделать усилие и ясно воспринять
сказанное, - это будет важно для понимания остального.
В конечном итоге, два (или любое большее число) атома, оказавшиеся притянутыми разными зарядами или спаренными электронами теперь существует как одно целое и это называют уже молекулой. Между отдельными молекулами, точно так же, могут возникать связи, образуя не разрозненные, сами по себе молекулы, а связанные в твердую форму - вещество.
Добавим чуть больше понимания в том, что такое электрон. Электрон и частица света - фотон - два проявления одной сущности. Сегодня все уже знают, что фотон - волна (для химии не важна природа этой волны, о первосути которой никто пока толком не знает, а важны ее проявляемые свойства) и, в то же время, - частица. Т.е. это - неделимый кусок волны, который условно назвали "квантом" (кусок волны обладает свойствами волны, но он ограничен как частица). Когда этот кусок волны распространяется прямолинейно - это - фотон, а когда он оказывается так закручен, что волна начинает накладываться сама на себя, т.е. "распространяется" по кольцу и "догоняет" хвост себя, образуя облако (которое и может стать одной из оболочек атома), то это уже - электрон (у которого электрическая составляющая волны оказывается уже постоянно ориентированной в пространстве и проявляется как отрицательный электрический заряд). Уже образовавшийся электрон может поглотить еще один фотон, став более высокоэнергичным, а затем снова отпустить этот фотон.
Аналогия с догонянием, вроде как движением по орбите - неверная настолько, насколько неверно говорить о чем-то, распространяющемся с предельной быстротой распространения - в механическом понимании. Распространение волны кванта, с накладыванием самой на себя, идет предельно быстро (со "скоростью света" - относительно внешнего наблюдателя и бесконечно быстро - для самого себя), т.е. для него не может быть никаких процессов быстрее, и это значит, что для такой волны нет времени и нет пространства. Время и пространство это - наши условные, абстрактные (а не реально существующие в виде чего-то) понятия соразмерности процессов.
В таких случаях должно вступать в силу понимание не механическое, а релятивистское, описывающее свойства процессов с пределом быстроты распространения. Времени и пространства для "куска волны" - кванта нет: квант в виде электрона не движется (нет времени) по орбите, а существует сразу везде (нет пространства) на этой орбите, он везде есть "одновременно", но с разной вероятностью нахождения, если вдруг ему "в колесо сунуть палку" и заставить остановиться, с чем-то провзаимодействовав . Пространство и время проявляется во внешнем сопоставлении с другими такими же квантами - как впечатление внешнего наблюдателя, самого состоящего из таких же квантов. Поэтому и говорят об электроне - как об "облаке" вероятного его нахождения, таким образом занимающим определенное место вокруг атома (куда если "сунуть палку", то можно наткнуться на его действие).
Электрон может стать частицей волны (квантом), если его принудить к этому определенным образом, и, наоборот, квант (кусок волны) может опять обернуться электроном. Еще электрон может стать менее энергичным, испустив часть себя в виде кванта (если электронное "облако" составлялось из нескольких неделимых квантов). Именно так атомы вещества испускают и поглощают свет - освободившиеся от самонакладывания кванты.
Электронную оболчку, в некоторых случаях, можно сорвать у атома, преодолев их взаимное электро-притяжение, и тогда электрон становится свободным электричеством. Именно это происходит, когда мы расчесываемся, заряжая сорванными нашими усилиями электронами пластмассовую расческу.
У металлов электроны внешнего слоя относительно слабо связаны с атомом, легко срываются (ударами квантов или действием других атомов с более прочными связями) и поэтому под воздействием электрополя, они могут проявляться как ток электронов (электроток).
Срывается - значит есть что-то ударяющее, придающее дополнительную энергию, как летящий камень передает свою энергию в место удара. Отсюда еще одно важное понятие - температура вещества. Это - усредненная оценка энергии взаимных передач ударов атомов и молекул - как скопища упруго сцепленных электромагнитными взаимодействиями элементарных единиц вещества. Если извне квантами или непосредственным контактом с другим веществом передается энергия ударов, то она распределяется в упругой ее передаче вглубь. Понятно, что некоторые элементы вещества получают более сильные удары, другие слабые, так что существует диапазон сил ударов для каждого среднего значения общей привнесенной энергии. Про энергию взаимных ударов говорят, что это - тепловая энергия.
Вещество, состоящее из различных молекул, имеет разную форму и свойства. Оказывает влияние как прочность связей, на которую влияет температура, так и геометрическая конфигурация атомов, связанных в молекулу.
Температура может разрывать связи, если сила ударов превышает силу связи. Тогда устанавливается равновесие: какая-то часть связей постоянно разрывается, а какая-то снова восстанавливается. Вещество теряет постоянную связь между молекулами и становится текучим. Некоторые молекулы, оторвавшиеся от других молекул, могут улетать из вещества. В этом случае говорят о паре. Чем выше температура, тем больше становится таких молекул. Если температура настолько высока, что почти все связи оказываются разорванными, то вещество все превращается в пар.
Еще на форму вещества оказывает влияние конфигурация взаимных связей в его молекулах. Так, если связываются два атома, то образуются гантелеобразные пары. Если три, то все атомные ядра располагаются как можно дальше друг от друга, т.е. образуют треугольник (молекулярная структура бора). Если одно из ядер атомов оказывается более положительно заряженным, чем другие, то два других будут располагаться более отстраненно от двух других. Еще большее влияние на форму молекулы (ориентацию связей) играет спаривание электронов в общую конфигурацию, которая выступает как единое целое по отношению к ядрам атомов молекулы (для гиков - детальная теория квантовой сути электрона: fornit.ru/216). Даже в такой относительно простой молекуле как вода очень не просто вычислить ориентацию атомов из-за множества влияющих факторов. Так, молекула воды выглядит вот так:
 Красный атом - кислород, с большим числом вложенных
электронных оболочек, а белые - водород - с единственным электроном.
Красный атом - кислород, с большим числом вложенных
электронных оболочек, а белые - водород - с единственным электроном.
Каждый электрон водорода связан с одним из не спаренных электронов кислорода.
Общая конфигурация - неравносторонний треугольник, при установлении связей уже между другими треугольниками молекул воды, сохраняются, по тем же причинам, те же направления вдоль ранее установленных связей, что определяет шестинаправленную (гексагональную) форму кристаллов воды (см. Гексагональная тирания, Современная модель воды и Снежинки).
Связи между атомами в молекуле химики условно на схемах обозначают линиями (см. внизу рисунок - верхнюю левую часть) между буквенными обозначениями атомов элементов, - сколько связей, столько линий между ними. В соединениях углерода бывают двойные (и тройные) связи между атомами углерода: в этом случае спариваются два электрона каждого атома, образуя две связи. В схемах органических молекул (т.е. основу которых составляют связанные между собой атомы углерода) атомы углерода обычно не обозначают. Вот как, для примера, это выглядит на схеме и на объемной модели молекулы ЛСД:
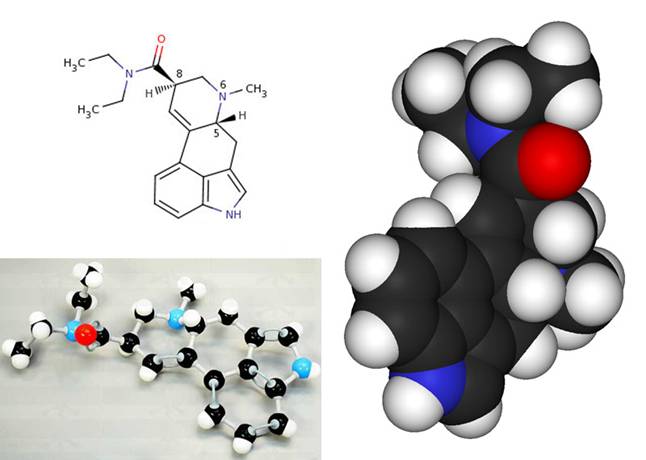
H - атом водорода, N - азота, О - кислорода, атомы углерода (черные на модели) на схеме не обозначены, они образуют костяк соединений молекулы. NH и СН3 - изображены без связей-линий азот-водород и углерод-3-водорода (так химикам кажется нагляднее показывать некоторые очень часто встречающиеся группы атомов). В схеме вверху явно не хватает у двух левых групп Н3С еще по парочке промежуточных Н2С групп, которые показаны на модельке ниже :) Такие "упрощения" тоже не редки у химиков, которым кажется, что итак все очевидно :)
Молекула воды H-O-H имеет определенную ориентацию электрических зарядов (молекулы, с противоположными зарядами на концах, называют "полярными") и таким образом влияет на другие неравномерно заряженные молекулы рядом с собой. Т.е. вода - имеет полярные молекулы, в отличие от электросимметричных, неполярных молекул (парафины, бензол и др.). Полярность молекул жидкости придает ей специфические свойства - как растворителей таких же полярных веществ: солей, кислот, органических веществ с полярными (разнозаряженными) группами атомов (которые называют "функциональные группы" проявляющие сами по себе характерные особенности во взаимодействиях - функции). Полярные жидкости растворяют лучше полярные вещества, а неполярные - растворяют вещества с электронейтральными молекулами.
Растворение - это подмена связей между однородными молекулами связями с молекулами других веществ. Растворы могут быть как жидкими, так и затвердевшими при понижении температуры, что в природе - очень характерное явление. Скорость растворения напрямую зависит от температуры: она обрывает какую-то связь, а взамен на этом месте оказывается уже другая молекула.
Если растворяющая жидкость имеет полярные молекулы, то она легко подменяет собой, примагничивает разноименным зарядом, так же полярные связи молекул растворяемого вещества, а если вещество не полярное, то и примагничивать становится нечего. И наоборот: если жидкость неполярная, то она имеет большее сродство к подмене собой неполярных связей. Поэтому в воде хорошо растворяется сахар и соль и очень плохо - парафин. Зато парафин легко растворяется в бензине, в котором соль так и остается почти не растворенной. Хотя у соли достаточно высокая температура отрывает отдельные молекулы, которые как бы парят (от слова пар) в растворителе, но устанавливается равновесие: сколько молекул отрывается, столько же и опять прикрепляется к полярной соли, возвращаясь из раствора. И это равновесие таково, что в бензине парит очень мало молекул соли (концентрация мала).
Растворение всегда предполагает такую температуру растворителя, при которой его молекулы оказываются достаточно часто разрываемыми между собой, что позволяет вместо них прикрепляться молекулам растворяемого вещества. Жидкое или газообразное состояние - лучшие условия, хотя и в контакте твердых веществ диапазон энергии температурных ударов молекул может приводить к разрывам связей и подменой связями с другим веществом.
Если молекулы твердого вещества имели между собой более слабую связь, чем новые связи с растворителем, то разница в энергии связи выделяется в виде дополнительной тепловой энергии и при растворении раствор нагревается. И наоборот. Поэтому при растворении соли в воде температура понижается, а при растворении веществ, образующих с водой сильные связи - повышается (вот почему при высыпании вещества для очистки сточных труб в раковину, там начинается бурное кипение, а при смешивании соли со снегом или просто при растворении ее в воде - понижение температуры).
При растворении в конечном счете устанавливается баланс, равновесие: сколько твердого вещества перешло в раствор, столько же возвращается назад (глобально: сколько на Земле воды испарилось, столько ее и пролилось дождями-снегом). Растворяется часть твердого вещества, если устанавливается равновесие или растворяется все вещество, если равновесие не установилось. Поэтому если температура понизилась, то баланс смещается в сторону большего возврата молекул в твердое вещество, и они, выстраиваясь в порядке ориентации связей, образуют кристаллы, форма которых соответствует ориентациям связей. То же происходит при переходе вещества из жидкого или газообразного состояния в твердое - так же формируются кристаллы. При этом так же устанавливается равновесие.
В этом смысле нет принципиальной разницы между растворами разных веществ или однородным веществом, - все происходит по одному и тому же принципу стремлению к равновесию состояний с влиянием температуры, которая из-за большого диапазона возможных энергий соударений, разрывает даже очень сильные связи. Этот принцип называется "термодинамическим равновесием", которое всегда обратимо настолько, насколько температура способна рвать образующиеся связи.
Этот принцип настолько всеобъемлющ, что касается не только растворения с подменой связей между молекулами, но возможна подмена связей между атомами при взаимодействии разных молекул, когда вместо связи с одной группой атомов или отдельным атомом возникает связь с другой группой или другим атомом. Все происходит точно так же как при растворении, только это, как бы, более глубокое, внутримолекулярное растворение. В химии, все же, часто отличают такое взаимодействие от "просто" растворения или изменением агрегатного состояния вещества, условно называя это "химической реакцией", хотя нет никакой принципиальной разницы между этими процессами настолько, что невозможно провести качественную границу.
Если температура и фазовое состояние вещества позволяет рваться молекулам и подменять связи на другие, то происходит установление нового равновесия с поглощением или выделением тепла (вплоть до горения, взрыва) - как разницы между энергиями связи прежней и новой. Возникает новое качество вещества, обладающее новыми свойствами.
Горение - внешне кажется разительно своеобразной реакцией. Это такая подмена связей на связи с другими атомами или группами атомов, при которых разница энергии связи настолько велика, что вызывает разогревание зоны действия до температур, при которых некоторые электроны атомов начинают отдавать излишек полученного ими тепла от соударений в виде квантов света. Там, где температура достигает величины достаточной для излучения видимого света, мы наблюдаем пламя с границей там, где такая температура вызывает излучение квантов невидимого диапазона: теплового излучения или, даже ультрафиолетового (при очень высокой температуре).
Если смесь веществ, которая способна к образованию связей с очень большим тепловым эффектом, поджечь, т.е. приложить температуру, обеспечивающюю диапазон энергии соударений, разрывающей старые связи, то начнется самоподдерживающийся выделением нового тепла процесс, который называют горением. Этого тепла достаточно, чтобы вызвать испарение исходных веществ и их взаимодействие (подмены связей между собой) в парообразном состоянии. Этот пар, раскаленный выделяемым теплом, мы наблюдаем как пламя.
В природе, на Земле повсеместно и постоянно устанавливаются и колеблются в ту или иную сторону равновесные состояния веществ. Неживое и живое - результат этих равновесий и между ними нет принципиальной разницы в их термодинамике. Изменение условий смещают равновесия, изменяя формы и качества веществ. Если изменения слишком велики, то живое переходит в состояние неживого потому, что живое требует поддержания очень тонкого баланса составляющих очень сложных, белковых веществ, их равновесных взаимодействий с другими веществами в узких границах условий. Поэтому многие системы живого имеют механизмы поддержания нужной границы условий - "гомеостат". Чем более сложны равновесные системы живого - тем - в более узких границах. Если ящерицу можно заморозить, а потом оживить, то человека уже нет.
В каждый данный момент истории остается существовать неизменно то, что способно оставаться самим собой в данных условиях. Стало теплее - снег уже не может существовать. А живые системы с гомеостазом - могут потому, что локально обеспечивают себя нужными условиями. Земные породы сформировались при кристаллизации, отложениях из растворов и газов. В стабильных условиях они остаются неизменными, если равновесие установилось. Но могут быть разрушены живыми существами, которые способны не только внутренним гомеостатом обеспечивать себе диапазон условий жизни, но и навыками выживания. Все это - лишь разные системы равновесий, из которых остаются неизменными те, что способны существовать в данных условиях, другие видоизменяются в более устойчивые формы - равновесные при данных условиях.
При этом остается самое общее у живых и неживых форм: образование или замена связей определяется направлением этих связей, что определяет форму молекул как неорганических так и самых сложных белковых, что, в конечном счете, определяет и наблюдаемую форму всего выделяемого нашим внимание образования. И законы "выживания", отбора форм и качеств при развитии у живого и неживого, в самом общем плане - одинаковы. В неживом при этом мы, чаще всего наблюдаем выражение формирования в виде кристаллов (даже во внешне однородных формах не отменяются направления связей), а в живом мы не замечаем этого.
В статье Наследование признаков показывалась такая преемственность и общность законов эволюционного развития:
Все это происходит только потому, что начальное
состояние вещества в данных условиях с неизбежностью приводят к развитию такого
результата.
Эволюция пауков насчитывает сотни миллионов лет. Среди них есть мастера паутин
самой разной формы и есть такие, которые плетут паутину бесформенную, просто беспорядочно
заплетая все между ветками паутиной. Сами пауки имеют очень экзотические формы,
которые так же не являются полностью закодированными в геноме, а лишь являются
результатом развития этого начального кода в определенных условиях, так же как
вода, разлитая на рельефном полу вынуждена следовать узорами струй его
условиям. Стоит что-то поменять в исходном генетическом коде, тот участок, что
отвечает вообще за паутину и в результате получим скачок качества или вообще
отсутствие способности плести паутину. Стоит только в этом месте дуть ветру
чуть сильнее и прежнего узора не получится. Все то, что оказалось выгодным и
эффективным в смысле преимуществ выживания осталось. Это могла бы быть любая
другая форма паутины, но если бы она вообще бы была некоей сложной формы мы бы
точно так же задавались удивительным вопросом: а как же это паук может ее
плести по столь сложному плану, если этот план нигде не закодирован?? И план в
самом деле нигде не закодирован, если только не принимать во внимание
совершенно определенное влияние условий развития, которые из данного
незначительного по информационной емкости кода приводит к развитию изощренных
по сложности нейронных сетей, обеспечивающих нужное поведение паука. А те
пауки, у которых не обеспечивает, просто не выживают. Сотни миллионов лет
эволюции, помноженные на неисчислимое количество особей пауков сделали то, что
удивляет нас теперь так же как удивляют и неорганические сложнейшие образования
кристаллических форм, как удивляют сложнейшие и удивительные формы животных и растений.
Кристаллы льда следуют такой же предопределенности своего роста условиями как и организмы, только в случае кристаллов их "генетической информацией" является строение и свойства молекулы и механизмы взаимодействия с окружающей средой иные (и вовсе не "сложнее", а, пожалуй, разнообразнее).
И это начальное свойство в зависимости от условий может приводить к образованию совершенно разных кристаллических форм и узоров, что особенно хорошо наблюдается в случае льда или кальцитов, образующих перещерные узоры.
Почему нас удивляют некоторые природные
формы тем "насколько они необычны и невероятны"?


Удивляют, несмотря на то,что все другие формы имеют
совершенно ту же неповторимость, уникальность? Просто потому, что некоторые
признаки увиденного вызывают значимые для нас ассоциации. Мы привыкли выделять
из окружающего то, что имеет для нас не нулевую значимость и новизну, в том
числе и некоторые наследуемые признаки, которые мы выделяем среди всех других
результатов развития живых существ.
Поэтому познавательно проследить процесс эволюции форм, а, в конечном счете, лучше понимать и условия возникновения жизни с помощью наиболее зримой аналогии - процессов образования кристаллических форм (см. Возникновение жизни на Земле).
Каждый может понаблюдать для ростом кристаллов и понять условия, которые на это влияют, купив набор на выращивания кристаллов дома (так и искать в поисковиках). Вот какой радостью поделилась мама ребенка, заполучившего такой набор:

В промышленности выращивают кристаллы сапфиров, рубинов с помощью уже куда как более серьезной технологией, но и это возможно проделывать в домашних условиях: Выращивание кристаллов рубина в домашних условиях.
Разработаны технологии выращивания других драгоценных и полезных камней-кристаллов, например, фианитов (название фианит получил в честь Физического института Академии наук СССР (ФИАН), где впервые был синтезирован, но название практически не используется за пределами экс СССР и стран соцлагеря. За рубежом этот материал чаще называют — джевалитом, даймонскваем и цирконитом.), мало отличимого от алмазов: Технология производства кубических цирконов (фианитов).
Кристаллические структуры - это не только то, что имеет обычно ассоциированные с этим словом грани и формы, а то, что имеет упорядоченную ориентацией межмолекулярных связей структуру. Оконное стекло - это быстро застывшая жидкость, сохранившая во многом состояние беспорядоченности связей, характерное для жидкости, когда температурные удары постоянно рвут и дезориентируют связи, но, как бы быстро стекло не застывало, оно, все же, успевает образовать мелкие кристаллические упорядоченности из температурного хаоса. Даже вода при не слишком высокой температуре (примерно до 15 градусов) сохраняет выраженную кристаллическую упорядоченность (что описывало по ссылке, приведенной выше).
Монокристалл - это как раз то, что имеет выраженные природные грани, определяемые особенностью связей молекулы (или атомов в случае моноатомных кристаллов), но, чаще всего, вещество находится в поликристаллической форме застывших кристаллов, часто разного состава.
 Изменчивость
формы одного и того же минерала наиболее наглядно выражена на примере воды: не
бывает двух одинаковых снежинок, в зависимости от температуры, влажности,
свойств центров кристаллообразования (неоднородностей, с повышенной действенности
энергии связей на острых выступах) образуют очень различные формы кристаллов: Снежинки, Ледяные узоры, Кристаллы воды.
Мистические легенды об этом: Живая вода Масару Эмото - здесь, в противовес мистике, размещена
подборка фотографий снежинок, выполненных физиком Кеннетом Либрехтом (Kenneth
Libbrecht) из Калифорнийского технологического института и его наблюдения за
условиями их образования.
Изменчивость
формы одного и того же минерала наиболее наглядно выражена на примере воды: не
бывает двух одинаковых снежинок, в зависимости от температуры, влажности,
свойств центров кристаллообразования (неоднородностей, с повышенной действенности
энергии связей на острых выступах) образуют очень различные формы кристаллов: Снежинки, Ледяные узоры, Кристаллы воды.
Мистические легенды об этом: Живая вода Масару Эмото - здесь, в противовес мистике, размещена
подборка фотографий снежинок, выполненных физиком Кеннетом Либрехтом (Kenneth
Libbrecht) из Калифорнийского технологического института и его наблюдения за
условиями их образования.
Завораживающие кристаллические формы и условия их образования представлены из коллекции минералогического музея им. Ферсмана (фото сделаны с любезного согласия главного хранителя музея): Фотографии кристаллических форм.
Все формы вещества состоят из однородных (очень редко) и разнородных (практически всегда) атомов, соединяемых между собой, в основном, с помощью главного свойства электронов - спаривания (слипания противоположно повернутых магнитиков-спинов, а точнее, образования общей устойчивой конфигурации стоячей волны, на разрыв связи которой требуется определенная энергия), а так же из-за взаимного "электростатического" притягивания атомов, у которых один или несколько электронов, спариваясь, оказываются у одного из атомов и при этом потерявший электроны становится заряженным положительно, а захвативший - отрицательно.
Если посмотреть на таблицу Менделеева, то элементы слева на право увеличивают количество электронов на единичку и в крайнем левом ряду малое число электронов значительно слабее связано с атомом (чисто электростатически), чем в правом ряду, где электронов больше, что говорит о большем заряде ядра на меньшим относительном расстоянии от него.
В первых группах (металлах) электроны настолько слабо связаны с ядрами, что легко срываются такими факторами как тепло (поэтому теплопроводность металлов высока), светом (фотоэффект), приложенным электронапряжением (электрический ток).
Поэтому при смешивании атомов первых групп с атомами последних, электроны первых переносятся на оболочки атомов последних, делая первые положительно заряженными ионами (катионами), а вторые - отрицательно заряженными ионами (анионами). Ионы - слово для обозначения нескомпенсированных зарядов атомов: ядер и их электронов. При достаточно высокой температуре тепловая энергия хаотических ударов становится такой, что электроны срываются и образуется газ из оголенных ядер с остатками более прочно держащихся электронов и сорванных электронов - ионизированный газ или "плазма". Ионизировать атомы может не только температура, но и любое другое достаточно энергичное воздействие. В пламени находится газ именно в ионизированном состоянии и поэтому он способен проводить электрический ток.
Смотря на таблицу Менделеева, слева мы видим металлы, которые, чем правее, тем становится все более не металлическими. И можно четко видеть возможности взаимодействий между элементами.
Но самым первым стоит водород, который мы никак не привыкли считать металлом. Просто потому, что он почти всегда - газ, который очень непросто заставить затвердеть в металл, да еще в сверхпроводящем состоянии. У водорода в ядре есть только один протон, но есть "изотопы", в которых с протоном связаны один или два электронейтральных, но массивных нейтрона (изотопами назвали атомы, различающиеся только числом нейтронов). Что за сущность, природа у протона и нейтрона для химии не существенно. Важны только электрозаряженность и масса.
У водорода сорвать его единственный электрон очень просто, и он легко соединяется со всеми элементами правой части таблицы Менделеева, кроме последней, у которой все места для электронов уже заполнены и поэтому они инертны. Так, с кислородом образуется вода, с хлором - хлористый водород, который при растворении в воде известен как "соляная кислота".
Соединение водорода с другими элементами или целыми группами элементов по типу перехвата его единственного электрона, приводит к образованию "ионных" соединений, которые в водном растворе все проявляют свойства кислот - за счет того, что в воде эти соединения, растворяясь, образуют смесь отдельных ионов, равновесно конкурируя в связях между собой, как это рассматривалось выше.
Ион водорода (фактически - голый протон) и придает кислотные свойства, а ионы связанного с ним атома (или группы атомов) определяют специфические свойства кислоты, в частности ее "агрессивность", растворяющие свойства. Так, группа атомов NO3 т.е. атом азота, связанный с тремя атомами кислорода - это отрицательно заряженная группа - анион, которая способствует растворению очень многих веществ, особенно металлов, придавая азотной кислоте H- NO3 свойства, растворяющие в водной среде (которая способствует разделению ионов и их самостоятельному активному действию) многие металлы.
Соединения катионов металлов (или групп атомов в виде катиона) и анионов кислот называют солями. Так, поваренная соль - это соединение иона натрия Na+ и иона хлора Cl- (H-Cl - соляная кислота). NH3-CH3COOH - соль аммония и уксусной кислоты.
Водные растворы - частный случай других видов растворов, и явления в них происходящие - бесконечная тема, и ее важность такова, что определяет возможность как существования жизни на Земле, так и многие неживые формы, не имея в этом принципиального различия.
Не меньшая по значимости именно для форм жизни тема, не менее безгранична, - соединения углерода. Углерод (и еще только кремний, но он более инертен), находясь в середине таблицы Менделеева, способен к связям с очень многими элементами и слева и справа, и сам с собой, образуя сколь угодно длинные костяки "органических" (чистая условность названия) молекул, на которые могут крепиться другие атомы и группы атомов (функциональные группы), что и придает в целом такой молекуле самые разные специфические свойства.
Эти и множество других тем - целые разделы химии, в которые можно погружаться почти не зависимо, становясь специалистами. Но любой из этих разделов основывается на тех самых общих представлениях, что были приоткрыты в этой статье.
Дополнительно:
· Журнал Химия и Химики
· Химия для любознательных - основы химии и занимательные опыты.
· Мир химии - научные и научно-популярные статьи по химии.
· XuMuK.ru - Классические учебники по органической, неорганической, физической, коллоидной и биохимии. Химическая энциклопедия и форум химиков.
· Пример использования химии промышленными мошенниками
· Химия - учебный курс и ссылки: Химия в интернете.
