Аннотация
Система кислородного фотосинтеза появилась у фотосинтезирующих цианобактерий (оксифотобактерия) на основе метаболических цепочек, ответственных за окислительно-восстановительные реакции с оксидами азота, при активном участии вирусов. Об этом говорит наличие в геномах не обладающих способностью к фотосинтезу членов этого семейства бактерий (мелаинабактерия и серицитохроматия) генов, характерных для системы фотосинтеза цианобактерий, что можно рассматривать как преадаптацию к появлению системы хлорофилльного фотосинтеза (далее - схф). При окислении нитрита до нитрата в процессе фотосинтеза у некоторых групп бактерий молекула воды расщепляется на атом кислорода, два протона и два электрона, что могло способствовать облегчению появления у цианобактерий "классического" кислородного фотосинтеза. Нитратное дыхание и обратный ему процесс - окисление нитрита до нитрата с использованием энергии фотонов, вероятно, стали тем "испытательным полигоном", на котором закладывались и оттачивались системы аэробного дыхания и кислородного фотосинтеза со всеми сопутствующими необходимыми подсистемами (защита от окислительного стресса, переключение между различными режимами работы энергетических подсистем днём и ночью и т.д.). Дальнейшее распространение схф и их диверсификация шли, в основном, за счёт горизонтального переноса генов, вовлечённых в данный процесс от цианобактерий (в том числе, архаичных, ныне вымерших) к другим группам бактерий. Первый примитивный реакционный центр фотосинтеза мог развиться из комплекса окисления нитрита, являющегося предшественником современных комплексов bc1 и b6f, присутствующих у большинства нынешних фотосинтезирующих организмов (бактерий и растений). Разделение двух основных функций этого комплекса (собственно окисление нитрита и запасение энергии в виде протонного потенциала мембраны) могло привести к появлению двух тесно связанных систем - современных комплексов b6f/bc1 и реакционных центров фотосинтеза первого и второго типов, а в конечном итоге, и к появлению возможности использования для получения доступа к свободным электронам и запасания свободной энергии лишь таких практически неограниченных источников, как вода и солнечные лучи. Недавнее открытие обширных залежей нитратов в древних породах Марса демонстрирует возможность практической реализуемости описанного сценария.
Как известно, появление хлорофилльного фотосинтеза стало одним из величайших прорывов в эволюции жизни, предопределившим возможность появления эукариот, и, в конечном итоге, всего человечества. Поэтому, неудивительно, что вот уже более полувека эта одна из величайших загадок, заданных нам эволюцией, будоражит умы учёных, однако, общепринятого ответа на этот вопрос в научной среде по-прежнему нет. Что же, воспользуемся этим обстоятельством, что бы ещё раз помедитировать на данную тему. Как справедливо отметил М.Никитин ("Происхождение жизни. От туманности до клетки.", стр. 425), типичная дыхательная цепь денитрификации похожа на цепь, работающую в аэробном дыхании. С другой стороны, известно, что сама цепочка кислородного дыхания, в свою очередь, имеет общие черты с цепочкой хлорофилльного фотосинтеза (см., например, Рис. 3 в статье А.Маркова на "Элементах" и соответствующие комментарии к нему автора). Может быть, как говорил Винни-Пух, и правда, "это ж-ж-ж — неспроста!"? Итак, попробуем поискать более весомые аргументы в поддержку существования возможной связи между метаболическим цепочками окислительно-восстановительных реакций с участием простых соединений азота и схф. Вот что у меня в итоге получилось.
1. Среди генов, кодирующих протеины, задействованные в схф, многие имеют гомологи среди генов, использующихся при окислении и восстановлении различных соединений азота. В частности, у семейства гелиобактерий, обладающих самой примитивной и всех известных на настоящее время схф, гены входящего в оперон схф комплекса bc1 по последовательности аминокислотных остатков ближе всего к генам аналогичного комплекса у нефотосинтезирующих бактерий, принадлежащих к семействам Carboxydocella и Desulfitobacterium. При этом, у семейства Carboxydocella с ними соседствуют гены, ответственные за восстановление нитрата до нитрита и, далее, нитрита до аммония, а у бактерий семейства Desulfitobacterium они расположены в одном опероне с генами восстановления закиси азота N2O (так называемый веселящий газ) до молекулярного азота N2. Кроме того, известно, что гены, кодирующие белки, участвующие в восстановлении молекул протохлорофилла и хлорофилла, имеют ощутимую степень гомологии с генами, кодирующими белки, ответственные за сборку каталитического центра нитрогеназы. Учитывая, что нитрогеназа кроме основной катализируемой ею реакции восстановления молекулярного азота, так же способна восстанавливать веселящий газ, можно предположить, что это её свойство могло быть востребовано ещё в эпоху до кислородной атмосферы, когда в мировом океане не было используемой ныне соответствующими ферментами меди в легкоусвояемой живыми организмами форме. Наконец, у единственной гелиобактерии с полностью секвенированным геномом Heliobacterium modesticaldum Ice1 в участке ДНК, содержащем гены для фотосинтеза, так же присутствует ген, который кодирует содержащий аж целых семь гемов c протеин WP_148207096.1. Данный протеин имеет высокую степень гомологии со специфическим цитохром с, часто входящим в состав комплекса "Cytochrome bd oxidase", который служит для защиты анаэробных бактерий как от отравления молекулярным кислородом O2, так и оксидом азота NO. При этом, у других бактерий, ген, кодирующий упомянутый протеин, как правило, либо объединён с геном, кодирующим каталитическую субъединицу cydA указанного комплекса, либо расположен по соседству с ним. Примечательно, что в таких случаях субъединица cydB, доставляющая электроны к каталитическому центру, обычно отсутствует. Данное обстоятельство наводит на мысль, что по аналогии с альтернативным комплексом III данный ген может кодировать протеин, посредством которого за счёт цепочки гемов c может осуществляться нестандартный способ доставки электронов от хинонов к каталитическому центру цитохром bd оксидазы.
2. Около десяти лет назад в журнале Science вышла статья, авторы которой утверждали, что им удалось экспериментально зафиксировать процесс окисления нитрита до нитрата в качестве источника электронов для реакционного центра второго типа у пурпурной фотосинтезирующей бактерии Thiocapsa roseopersicina (обычно она использует для этого сероводород). Позже подобный эффект для бактерий этого семейства, а так же семейства альфа-протеобактерий Rhodopseudomonas подтвердила и другая группа исследователей. Более того, известно, что при недостатке электронов в фотосистеме I (в дальнейшем - ФСI) у хлоропластов некоторых растений, у них активируется нитрат редуктаза, что приводит в итоге к повышению уровня нитритов в цитозоле и их последующему импорту в цитоплазму хлоропластов. Можно предположить, что таким образом создаётся дополнительный источник электронов для ФСI за счёт окисления внутри хлоропластов нитрита либо молекулярным кислородом, либо, возможно, даже самой ФСI хлоропластов подобно тому, как цианобактерии в определённых условиях могут переключаться на окисление сероводорода. В любом случае, тот факт, что даже после перемещения генов, связанных с восстановлением нитрата до нитрита в ядро, связь между функционированием системы фотосинтеза в хлоропластах и системой восстановления нитрата сохранилась, является намёком на их тесную взаимозависимость, появившуюся, возможно, ещё до попадания цианобактериальной клетки внутрь эукариотной.
3. Превращение NO2- в NO3- за счёт окисления воды в реакции NO2- + H2O => NO3- + 2H+ + 2e-, осуществляемое некоторыми фотосинтезирующими бактериями, можно рассматривать как один из этапов преадаптации к практикуемому ныне цианобактериями использованию воды в качестве основного источника электронов и наработке опыта относительно безопасной работы с очень сильным окислителем, каковым является выделяемый ими в процессе фотосинтеза кислород. Ведь при окислительно-восстановительных реакциях с молекулами, содержащими окисленные формы азота, в некоторых ограниченных количествах практически неизбежно выделяется очень токсичная молекула NO. Она не менее, а, скорее, даже более агрессивна, чем O2, а ферменты работы с оксидом азота и молекулярным кислородом в микроаэробных условиях, как правило, родственны. В качестве примеров можно назвать оксидазы HCO-C - NOR и уже упомянутую выше cytochrome bd оксидазу.
4. Начальные этапы цепочек синтеза (бактерио)хлорофиллов и гемов, широко используемых в ферментах, катализирующих реакции фиксации азота и нитратного дыхания, практически идентичны. По существу, различия начинаются лишь с этапа работы с протопорфирином IX. Причём если для получения гема b в протопорфирин IX достаточно лишь вставить атом железа, то для того, что бы из него получился, например, используемый цианобактериями хлорофилл a, необходимо произвести ещё несколько дополнительных операций: вставку в центр протопорфирина атома магния, добавление метильной группы к концу боковой цепи 13-го атома углерода порфиринового кольца, зацикливание этой цепи на 15-й атом углерода, восстановление боковой цепи 8-го атома углерода, восстановление двойной связи между 17-м и 18-м атомами углерода, пришивание к хлорофиллиду фитольного хвоста. Следует отметить, что практически все протеины, осуществляющие соответствующие реакции, имеют своих "родственников" среди белков, выполняющих иные функции (участие в синтезе хинонов, сборка кофермента B12 и т.д.). Таким образом, получение цепочки синтеза хлорофилла на основе уже существующей цепочки синтеза гема b и адаптации под новые задачи ряда уже существующих белков отнюдь не выглядит для эволюции неразрешимой проблемой.
5. Цитохром b в цитохромных комплексах bc1 (так называемый комплекс III) и b6f, состоящий из двух субъединиц, который, по-видимому, характерен для наиболее древних фотосинтетиков (цианобактерии, гелиобактерии), встречается преимущественно ещё лишь у бактерий, имеющих цепочку денитрификации. Если, например, опираться на данные из этой статьи, то около 80% нефотосинтезирующих бактерий, имеющих расщеплённый на две субъединицы цитохром b, имеют так же нитрат редуктазу.
6. Маленький, заякоренный на мембране одногемовый цитохром c553 используется как в схф у гелиобактерий и некоторых примитивных цианобактерий в качестве переносчика электронов, так и у некоторых бактерий нитрат редукторов в цепочке восстановления нитрита до аммиака. Родственный ему цитохром c550, кодируемый геном PsbV, функционирует как в качестве восстановителя для реакционных центров пурпурных бактерий, так и в цепочке нитратного дыхания. Кроме того, он является составной частью фотосистемы II, причём, осевое лигирование гема c осуществляется с помощью двух гистидинов. Это очень нестандартное решение. В протеинах, содержащих только один гем с, в настоящее время оно обнаружено ещё лишь в восстанавливающем нитрит и кислород цитохроме cd1. При этом, гелиобактерии, по-видимому, имеют все гены, необходимые не только для синтеза гема c, но и для синтеза гема d1. Кроме того, у некоторых цианобактерий присутствует растворимая форма цитохрома c550, кодируемая геном PsbV2. Как показали исследования, она активно синтезируется в условиях, когда в среде мало аммония и много нитрата, а при достаточном количестве доступного клетке аммония экспрессия гена PsbV2 практически прекращается. Таким образом, у ряда цианобактерий растворимый цитохром c550, вероятно, участвует в процессе восстановления нитрата до аммония.
7. Реакционный центр гелиобактерий и реакционный центр фотосистемы II (в дальнейшем - ФСII) цианобактерий, а так же, вероятно, семейства фотосинтетиков Chlorobi и Acidobacteria содержат атом кальция. В свою очередь, каталитические центры восстановления нитрита до аммония, и оксида азота до закиси азота тоже содержат атом кальция.
Таким образом, намёки на связь между схф и метаболическими цепочками окисления и восстановления соединений азота действительно прослеживается по многим направлениям, и этот факт вряд ли случаен. Как уже отмечалось выше, по-видимому, самой архаичной из всех существующих схф является фотосистема гелиобактерий. При этом, в последние годы появляется всё больше свидетельств (см., например, тут и далее по ссылкам в посте), что её реакционный центр сочетает в себе признаки обоих распространённых в настоящее время типов - первого и второго, типичными представителями которых являются реакционные центры, соответственно, ФСI и ФСII цианобактерий. Для простоты, вслед за рядом авторов, мы будем дальше называть все фотосистемы с реакционным центром первого типа ФСI, а второго типа, соответственно, ФСII, хотя, строго говоря, это и не совсем корректно. Оба типа современных фотосистем произошли, вероятно, если и не непосредственно от фотосистемы, которая в настоящее время работает у гелиобактерий, то, по крайней мере, от какой-то примитивной фотосистемы, имеющей с ней гораздо больше общих черт, чем с другими современными фотосистемами. Недавно, некоторые авторы даже предложили назвать фотосистему гелиобактерий ФС 1.5, тем самым, подчёркивая, что она причудливо сочетает в себе признаки обоих "классических" типов, одним из главных различий которых считается тип переносчика свободных электронов, генерируемых в реакционном центре. У ФСI это, как правило, находящиеся в цитоплазме ферредоксины и (на последующем этапе) молекулы NADPH, а у ФСII - способные перемещаться лишь в пределах клеточной мембраны хиноны. Так вот, как показали недавние исследования, гелиобактерии, похоже, способны использовать оба указанных типа, переключаясь с одного на другой в зависимости от условий освещённости. В вышедшей в конце 2018-го года статье авторы приводят достаточно веские, на мой взгляд, аргументы в пользу того, что предковый по отношению к современному реакционный центр гелиобактерий мог восстанавливать лишь хиноны. Кроме всего прочего, как они справедливо замечают, ген PshB, необходимый для передачи электронов на ферредоксин, в геноме гелиобактерий находится вне основного фотосинтетического оперона генов, что косвенно намекает на то, что он был рекрутирован для фотосинтетической "кухни" уже позже, лишь в процессе "доводки" исходного варианта реакционного центра. То, что "прадедушка" схф работал именно с хинонами очень важный вывод, который понадобится нам в дальнейших рассуждениях.
Пойдём "по следу" дальше. Нитрат редуктазы в зависимости от того, в какие метаболические цепочки они встроены, делятся на три большие группы - респираторные, ассимиляторные и диссимиляторные. Ассимиляторные нитрат редуктазы в два этапа восстанавливают в цитоплазме нитрат до потребляемого впоследствии клеткой для своих нужд аммония с помощью ферментов, не использующих широко применяемый в дыхательных цепочках цитохром c, а электроны получают не с хинонов, а с растворённых в цитоплазме ферредоксинов или молекул NADH. По-видимому, это самое древнее семейство нитрат редуктаз, появившееся ещё до возникновения нитратного и кислородного дыхания, и здесь мы их далее рассматривать не будем. Гораздо более интересны в контексте данной статьи для нас диссимиляторные и респираторные нитрат редуктазы, так как обе они связаны с нитратным дыханием, которое, на взгляд автора статьи, могло предшествовать кислородному. Диссимиляторные редуктазы, как и ассимиляторные, тоже восстанавливают нитрат до нитрита, а потом (опционно), до аммония, но, в отличие от ассимиляторных редуктаз, обе ключевые реакции в них происходят в периплазме. Электроны для восстановительной цепочки, как правило, поставляются формат дегидрогеназой посредством хинонов, причём, протоны при этом попутно перекачиваются из цитоплазмы в периплазму. Снимаются электроны с хинонов обычно либо с помощью специфического заякоренного в мембране протеина, содержащего четыре гема с (это гомологи NapC в случае нитрат редуктазы, и NrfH в случае, соответственно, нитрит редуктазы), либо, при восстановлении нитрата, с помощью мембранного комплекса, состоящего из двух содержащих железосерные кластеры субъединиц NapG и NapH (кстати, при воcстановлении закиси азота используются их гомологи NosG и NosH). Однако, для нитрат редуктазы недавно был обнаружен ещё один вариант, в котором для этого используется комплекс bc1, его мы немного более подробно рассмотрим ниже. В случае восстановления нитрита содержащая пять гемов c каталитическая субъединица NrfA непосредственно примыкает к мембранной субъединице, а при восстановлении нитрата до каталитической единицы NapA электроны доставляются с помощью растворимого цитохрома c (субъединица NapB, которая содержит два гема c и принадлежит к тому же семейству цитохромов c, что и использующийся в схф цитохром c550). Наконец, больший интерес в контексте рассматриваемой проблемы для нас представляют респираторные нитрат редуктазы, так как именно с ними имеет больше всего общих черт цепочка кислородного дыхания. Типичная респираторная нитрат редуктаза восстанавливает нитрат до молекулярного азота N2. При этом, встроенный в мембрану комплекс восстановления нитрата до нитрита, как и в случае диссимиляторной редуктазы, получает электроны с хинонов, но, в отличие от неё, его каталитическая часть чаще находится в цитоплазме, чем в периплазме. Остальные комплексы, осуществляющие последовательное восстановление нитрита до молекулярного азота, локализованы в перипалазме и получают электроны с растворимого цитохрома с, который, в свою очередь, запитывается ими через комплекс III (он же комплекс bc1).
Из трёх перечисленных выше групп нитрат редуктаз две восстанавливают нитрат до аммония, и лишь одна - до молекулярного азота, причём, именно эта цепочка наиболее сложная и требующая тонкой регулировки. С учётом этого факта можно предположить, что именно с простой цепочки реакций NO3- => NO2- => NH4 и начиналась эволюция различных вариантов цепочек нитрат редуктаз. При этом, как для восстановления нитрита до аммония, так и для восстановления нитрата до нитрита, электроны могли поставляться одним и тем же комплексом, родственным формат дегидрогеназе, часто поставляющей электроны и для современных цепочек диссимиляторных и респираторных нитрат редуктаза. Это предположение косвенно подтверждается ещё как минимум тремя фактами:
- Каталитические центры снабжающего нитрит редуктазу электронами фермента (формат гидрогеназы) и нитрат редуктазы работают с одним и тем же, причём, судя по всему, очень древним, кофактором МГД (молибдоптерин гуанин динуклеотид), а кодирующие их гены гомологичны для случая диссимиляторных нитрат редуктаз и имеют гомологичные участки для случая респираторных нитрат редуктаз.
- Структурные единицы нитрат редуктазы и формат дегидрогеназы имеют некоторые общие черты. В частности, в процессе обмена электронами между хинонами и каталитическими субъединицами используются либо содержащие два гема функциональные аналоги цитохрома b6 (гамма-единица респираторной нитрат редуктазы и субъединица FdhC формат дегидрогеназы) и субъединица c железосерными "проводами" (бета субъединица респираторной редуктазы, субъединица FdhB формат дегидрогеназы), либо гомологичные, содержащие 4 гема с мембранные белки (NapC в случае диссимиляторной нитрат редуктазы и NrfH в случае диссимиляторной нитрит редуктазы).
- Растворимый цитохром с553 доставляет электроны от формат дегидрогеназы к каталитическому центру диссимиляторной нитрит редуктазы, родственный ему растворимый цитохром с550 может быть переносчиком электронов в составе диссимиляторной нитрат редуктазы некоторых цианобактерий, а в своей гидрофобной форме, по некоторым предположениям, является резервным восстановителем каталитического центра (см. так же пункт 6 в списке аргументов о наличии связи схф и цепочек работы с оксидами азота).
Теперь, давайте рассмотрим более детально работу комплекса диссимиляторной нитрат редуктазы. В простейшем варианте электроны, необходимые для её функционирования, отбираются у формата (или, говоря более по-русски, муравьиной кислоты) при помощи специального комплекса ферментов - формат дегидрогеназы, каталитическая субъединица которой расположена в периплазме. Далее, через белок-посредник, содержащий состоящие из железосерных кластеров "провода", формат дегидрогеназа передаёт электроны на её встроенную в мембрану гамма-субъединицу, напоминающую цитохром b. В ней электроны вначале попадают на расположенный вблизи периплазмы гем b (аналог гема bp комплекса bc1), потом на другой гем b, расположененный вблизи границы мембраны с цитоплазмой (аналог гема bn комплекса bc1) и далее, наконец, на предназначенные ферментам нитрат редуктазы хиноны. Одновременно из цитоплазмы на хинон экспортируются протоны. Поток электронов от формат дегидрогеназы к аналогу гема bn возможен благодаря тому, что формат является более сильным восстановителем, чем указанный гем (потенциал реакции его окисления до углекислого газа равен -0.2 эВ, в то время как потенциал гема bn равен примерно -0.05 эВ). Но существует и более сложный вариант восстановления нитрита (а, возможно, и нитрата), в котором путь электронов от формат дегидрогеназы до аналога цитохрома b напоминает таковой в примитивной системе хлорофилльного фотосинтеза гелиобактерии Heliobacterium modesticaldum Ice1, с той лишь разницей, что электроны движутся в обратном направлении. Действительно, если в фотосистеме указанной бактерии электроны с цитохрома b через белок Риске, цитохром c1, и, наконец, заякоренный в мембране одногемовый гидрофильный протеин с553 восстанавливают реакционный центр фотосинтеза (см, например, здесь), то в данном случае поток электронов в той же последовательности движется от формат дегидрогеназы в обратном направлении, причём, вместо белка Риске с коферментом 2Fe-2S, здесь, по-видимому, используется обычный ферредоксин с коферментом 4Fe-4S, который работает в цепочке передачи электронов в паре с так называемым нонагемом цитохром с, вместо двухгемового цитохрома с у гелиобактерий. За подробностями отсылаем читателей к разделу 4.2.2 и рис. 5 в этой работе. А какова в этом плане ситуация с восстановлением нитрата в диссимиляторной цепочке? Как мы уже отмечали выше, и здесь тоже имеется маленький, содержащий два гема с гидрофильный протеин NapB, снующий между мембранными сабъюнитами и каталитической единицей NapA. Более того, кроме встроенных в мембрану содержащих четыре гема с субъединиц NapC, и пары архаичных, содержащих железосерные кластеры мембранных протеинов NapG и NapH, здесь могут использоваться и практически полноценные комплексы bc1, способные перекачивать из цитоплазмы в периплазму по три протона на каждые два перенесённых электрона. Что же касается респираторной нитрат редуктазы, то все её последовательные восстановительные комплексы, начиная с нитрита, весьма напоминают комплекс IV классической дыхательной цепочки аэробной бактерии. Особенно это касается NO редуктазы, которая не только структурно и функционально похожа на неё, но и входит с ней в одно семейство протеинов - HCO оскидаз.
Итак, альтернативный вариант передачи электронов от каталитической субъединицы формат дегидрогеназы к её напоминающей цитохром b мембранной единице реализуется посредством небольшого растворимого цитохрома с553, который как челнок снуёт между этими протеинами. Аналогичную функцию выполняет и субъединица нитрат редуктазы, кодируемая геном NapB, но в этом случае она переносит электроны уже в обратном направлении - от цитохрома b к альфа субъединице нитрат редуктазы. При этом, к цитохрому b добавляются белок Риске и одногемовый или двухгемовый цитохром с, образуя практически полноценный комплекс bc1, что за счёт использования бифуркации электронов позволяет на 50% увеличить количество переносимых хинонами из цитоплазмы в периплазму протонов. В таком виде комплекс восстановления нитратов, который мы наблюдаем, например, у эпсилон протеобактерии Campylobacter jejuni (см. эту статью и рис. 6 в ней), cтановится очень похожим на классический комплекс III, использующийся многими фотосинтетиками (включая цианобактерий) и в цепочках кислородного дыхания. В то же время, как известно, в комплексе III цианобактерий цитохром c1 заменён негомологичным ему, но имеющим аналогичное функциональное значение цитохромом f. Как мы выяснили выше, цитохром с1, по-видимому, впервые появился в цепочках восстановления нитрата (см. аргумент номер 1 в списке фактов возможной связи окислительно-восстановительных цепочек работы с оксидами азота и хлорофилльного фотосинтеза). При этом, возникает закономерный вопрос - откуда у предков цианобактерий появился уникальный для них цитохром f ? Что бы ответить на него, имеет смысл "пошерстить" недавно открытую группу бактерий, которая является для фотосинтезирующих цианобактерий сестринской, учёные назвали их мелаинабактериями. Следует отметить, что, вообще говоря, метаболические цепочки окислительно-восстановительных реакций с оксидами азота для мелаинабактерий не характерны. Тем не менее, по крайней мере в геноме одной из них - штамма Candidatus Melainabacteria bacterium RIFCSPLOWO2_12_FULL_35_11, который недавно был обнаружен в подземном водоносном слое, находится оперон генов, проаннотированный как респираторная нитрат редуктаза. Заканчивается указанный оперон, на первый взгляд, геном, кодирующим цитохром b (протеин OGI06506.1), но присмотримся повнимательнее к следующему гену, кодирующему протеин OGI06505.1. Поиск по базе данных NCBI даёт неожиданные результаты - последовательность его аминокислот с первой примерно по 45-ю имеет ощутимую степень гомологии с локализованным в межмембранном пространстве начальным участком цитохрома f (когда данная статья была уже почти закончена, автору попалось на глаза свежее исследование, авторы которого независимо пришли к выводу о наличии у некоторых мелаинабактерий вариантов генов, кодирующих характерные именно для цианобактерий версии протеина b6 и белка Риске). Но и это ещё не всё, остальная часть указанного протеина гомологична белку, используемому некоторыми вирусами при проникновении внутрь клетки-жертвы (так называемый phage tape measure protein). Таким образом, есть веские основания полагать, что весь оперон генов, отвечающий за восстановление нитрата, был перемещён в геном данной мелаинабактерии вирусом.Так же примечателен тот факт, что вплотную примыкающий к предполагаемому оперону нитрат редуктазы в геноме этой бактерии ген OGI06511.1, который, вероятно, кодирует сабъюнит диссимиляторной нитрат редуктазы NapB, имеет так же определённую степень гомологии с цитохромом с553, переносящим электроны в фотосистемах гелиобактерий и некоторых примитивных цианобактерий. Кроме того, данный ген явно является родственным гену, кодирующему третью субъединицу цитохром c оксидазы cbb3. Традиционно считалось, что эта оксидаза в микроаэробных условиях восстанавливает молекулярный кислород до воды, но в последнее время появились данные, что она может так же участвовать и в процессе денитрификации. Функция её третьей субъединицы заключается в том, что бы принять электрон от растворимого цитохрома c и направить его к каталитическому центру. При этом электрон проходит через два гема c. В целом, комплекс оксидазы cbb3 очень похож на комплекс восстановления оксида азота (NO) NOR. В каталитическом центре обоих комплексов гемы b и атом кальция расположены практически одинаково и лигируются одними и теми же аминокислотными остатками (см., например, здесь). Более того, в той же позиции относительно гема b3 расположен и дополнительный атом негемированного металла, только железо заменено на более подходящую в аэробных условиях медь. Достаточно высокая степень гомологии ключевых протеинов обоих белков и практическая идентичность устройства их каталитических центров привела многих исследователей к выводу, что обсуждаемая терминальная оксидаза произошла от комплекса восстановления NO. В современных комплексах NOR вспомогательная субъединица III отсутствует, однако, и у них, и у терминальной оксидазы есть вторая вспомогательная единица, обладающая отдалённой гомологией с третьей. При этом, она принимает электроны либо напрямую у растворимого цитохрома с (это случай NOR), либо от третьей субъединцы (в случае комплекса cbb3). Данное обстоятельство позволяет предположить, что в обоих комплексах система подвода электронов к каталитическому центру произошла от какого-то одного (впоследствии многократно дуплицировавшогося) протеина, возможно, являющегося общим предком сабъюнитов II и III оксидазы cbb3, сабъюнита II NO редуктазы, цитохрома c553 и субъединицы нитрат редуктазы NapB. Так же в рассматриваемом фрагменте генома данной мелаинабактерии содержатся - белок Риске, объединённый с мембранной гамма-субъединицей нитрат редуктазы NarI (ген OGI06507.1), вспомогательная субъединица для вставки кофактора в каталитическую субъединицу (ген OGI06508.1), бета-субъединица респираторной нитрат редуктазы NarH (ген OGI06509.1) и, наконец, собственно каталитическая альфа-субъединица NarG (ген OGI06510.1). Надо сказать, что перечисленный набор генов для респираторной нитрат редуктазы выглядит довольно странно. Такое ощущение, что в данном опероне причудливо перемешаны гены собственно респираторной нитрат редуктазы, некоторые гены из цепочки диссимиляторной нитрат редуктазы, и фрагменты комплекса b6f. А не может ли данный оперон кодировать гены для окисления нитрита до нитрата, то есть, служить для синтеза комплекса, выполняющего обратную, по сравнению с нитрат редуктазой реакцию? Ведь эти комплексы по последовательности аминокислот почти не отличимы, по сути, одни и те же белки в зависимости от внешних условий, могут работать как в ту, так и в другую сторону, и по этой причине автоматические программы аннотирования геномов часто их путают. Обратимся ещё раз к упомянутому выше исследованию геномов мелаинабактерий и их ближайших родственников. Его авторы включили в свою базу данных и обсуждаемую бактерию, она у них фигурирует как LO5A, но из сопроводительных материалов (см. файл Data 1) становится понятно, что речь идёт об одном и том же штамме. Авторы сами проаннотировали геномы исследуемых бактерий интегрируя результаты сразу нескольких методов, включая такие мощные предсказательные инструменты, как скрытые марковские цепи. Так вот, в соответствии с их выводами, указанный оперон кодирует именно нитрит оксидоредуктазу, окисляющую нитрит до нитрата!
Для того, что бы попробовать ещё лучше разобраться с вопросом, какую же функцию всё-таки выполняет привлёкший наше внимание оперон, давайте рассмотрим работу типичного окисляющего нитрит комплекса у нитрифицирующих бактерий. Как раз недавно он был подробно изучен у одной из фотосинтезирующих бактерий, использующих нитрит в качестве источника электронов для восстановления реакционного центра. Результаты изучения соответствующей цепочки у бактерии Thiocapsa KS1, принадлежащей к классу гамма-протеобактерий, были несколько лет назад опубликованы учёными. Как выяснилось в результате исследования, данная бактерия использует для окисления нитрита соответствующую оксидоредуктазу, каталитический центр которой располагается на цитоплазматической стороне мембраны. Отобранный у воды в процессе реакции окисления нитрита электрон c помощью двухгемового цитохрома с, который у данной бактерии слит с гамма-субъединицей оксидоредуктазы, переводится на другую сторону мембраны, то есть, в периплазму, где он передаётся растворимому цитохрому c. Последний, в свою очередь, через содержащий четыре гема цитохром с, являющийся по факту субъединицей реакционного центра PufC, и служащий своеобразными "проводами", передаёт электрон на специальную пару бактериохлорофиллов реакционного центра второго типа. Перевод электрона через мембрану требует энергетических затрат и осуществляется за счёт мембранного протонного потенциала, то есть, в конечном счёте, за счёт окисления молекул NADH. Необходимость переброски электрона на другую сторону мембраны связана с тем, что редокс потенциал реакции окисления нитрита до нитрата (+0.43 эВ) является слишком высоким для того, что бы восстановить последний в цепочке гем субъединицы PufC, c которого электрон непосредственно перепрыгивает на бактериохлорофилл реакционного центра, так как его потенциал равен +0.38 эВ, а поток электронов, как известно, всегда течёт в сторону большего потенциала. Стандартная разность потенциалов между разными сторонами бактериальной цитоплазматической мембраны равна примерно +0.15 эВ, так что, соответствующего уменьшения потенциала как раз вполне хватает для того, что бы электрон взял курс по направлению к реакционному центру. Кстати, непосредственно перед оксидоредуктазой, обеспечивающей систему фотосинтеза электронами, расположены несколько генов, кодирующих систему токсин-антитоксин второго типа, появление которых часто связано с активностью вирусов, что прозрачно намекает на возможность ее появления в геноме данной бактерии в результате горизонтального переноса.
На взгляд автора, в строении комплекса окисления нитрита бактерии Thiocapsa KS1 и строении предполагаемого комплекса нитрит оксидоредуктазы меланинобактерии RIFCSPLOWO2_12_FULL_35_11 прослеживаются некоторые общие черты. В первую очередь, это, конечно, нестандартное удлинение мембранной гамма-субъединицы дополнительным фрагментом, содержащим в первом случае два гема с, а во втором - похожим на белок Риске (анализ соответствующего фрагмента позволяет предполагать так же существование одного гема с, что ещё больше увеличивает сходство). В случае Thiocapsa KS1 данный фрагмент (у некоторых других нитрифицирующих бактерий он офоромлен как отдельный ген) служит для перевода электронов на другую сторону мембраны и последующей передачи их на уже знакомый нам растворимый цитохром c550, локализованный в периплазме. У других бактерий, окисляющих нитрит, например, Nitrobacter winogradski, электроны передаются на уже упомянутую выше гидрофобную версию цитохрома c550. Таким образом, похоже на то, что передача электронов от расположенной в цитоплазме нитрит оксидоредуктазы на терминальный окислитель, как правило, осуществляется именно цитохромом c550, это очень консервативное свойство цепочек нитрификации. Соответственно, наличие в рассматриваемом опероне мелаинабактерии RIFCSPLOWO2_12_FULL_35_11 гена, кодирующего гомолог цитохрома c550 позволяет предположить, что и у этой бактерии электроны впоследствии переводятся в периплазму и передаются данному протеину. Но, насколько можно судить из литературы, во всех известных случаях, цитохром c550 используется только как переносчик электронов к терминальной оксидазе, что является ещё одним дополнительным аргументом в пользу гипотезы, что в данном случае мы имеем дело с нитрит оксидоредуктазой. А какова же, в таком случае, может быть роль белка Риске? В классических bc1/b6f комплексах он забирает электрон у хинона и передаёт его вначале на свой железосерный кластер 2Fe-2S, а потом на гем c, расположенный либо внутри цитохрома с1, либо в цитохроме f, откуда он, в дальнейшем, уже переправляется на растворимый цитохром c и, наконец, уходит к его конечному потребителю. Можно предположить, что и в данном случае его функция выглядит примерно так же, за исключением того, что электрон им принимается не от хинона, а от гамма-субъединцы нитрит оксидоредуктазы. В таком случае, все основные протеины интересующего нас оперона, кроме цитохрома b, имеют свою функцию. Что же здесь делает цитохром b? Что бы попытаться ответить на этот вопрос, напомним, что "длинная" версия цитохрома b, каковую мы, собственно, и наблюдаем в данном случае, по-видимому, образуется путём слияния двух протеинов меньшего размера - b6 и PetD, которые обычно присутствуют в геномах бактерий-фотосинтетиков и предположительно участвуют в регулировании потока электронов в соответствующих цепочках в зависимости от условий освещённости. Таким образом, вполне вероятно, что цитохром b ранее выполнял некие функции, связанные с фотосинтезом (как минимум, регуляторные, но, возможно, что он и непосредственно участвовал в работе ранних версий схф, см. тест ниже). После того, как предки данной бактерии перешли к подземному образу жизни, эти функции стали уже неактуальными, но данный протеин не был вычищен отбором, так как к этому времени уже успел приобрести важную структурную роль, без которой эффективная доставка электронов от нитрита к цитохрому c550 стала уже невозможной. Так как условия обитания обсуждаемой мелаинабактерии микроаэробные, то под землёй она вполне может окислять нитрит и без участия солнечного света, используя для этого цитохром bd оксидазу, которая у неё есть (см. рис. 8 в уже упомянутой выше статье). Кстати, в той же статье упоминается, что у некоторых мелаинабактерий комплекс, напоминающий классический комплекс b6f и bd оксидаза расположены по соседству, что дополнительно указывает на их тесную связь.
Каким же мог быть наиболее естественный сценарий трансформации нитрат редуктазы в систему фотосинтеза? В типичной современной дыхательной цепочке восстановления нитрата молекулы NADH окисляются комплексом I, а полученные при этом электроны передаются на плавающие внутри мембраны хиноны. Одновременно с этим протоны перемещаются из цитоплазмы в периплазму увеличивая, тем самым, протонный мембранный потенциал. Хиноны, в свою очередь, плывут к локализованной в мембране гамма-субъединице нитрат редуктазы и отдают ей свои электроны. Далее эти электроны передаются на локализованный в цитоплазме каталитический центр, который восстанавливает нитрат до нитрита, получая из цитоплазмы два протона и выделяя в неё одну молекулу воды. Так как протоны, полученные от хинона, тоже переносятся в периплазму, а из цитоплазмы при переходе в молекулу воды они исчезают, то процесс восстановления нитрата также сопровождается усилением мембранного потенциала. В конечном итоге, в описанной цепочке расходуются молекулы NADH, являющиеся для клетки практически таким же важным энергетическим ресурсом, что и АТФ. Так как многие молекулярные комплексы клетки могут катализировать реакции, идущие в обе стороны, и нитрат редуктаза здесь не является исключением, то наиболее простой путь возобновления запасов NADH заключается в развороте рассмотренной цепочки в обратную сторону. Следует отметить, что синтез указанных молекул из NAD+ с помощью работающего в обратном направлении комплекса III (он же комплекс bc1) и последующего переноса хинонами электронов (за счёт протонного мембранного потенциала) к аналогу комплекса I, так же работающему в обратном направлении (так называемый комплекс NDH-1) обнаружен уже достаточно давно. В качестве примера можно назвать бактерию Thiobacillus ferrooxidans. Она использует для фиксации CO2 цикл Кальвина, и по этой причине ей необходимо постоянно синтезировать в больших количествах молекулы NADH. В качестве первичного источника энергии при этом используется реакция окисления двухвалентного железа до трёхвалентного. Но окислительно-восстановительный потенциал данной реакции (+0.76 эВ при характерной для данной бактерии кислотности внешней среды) значительно выше, чем аналогичный потенциал реакции восстановления NAD+ до NADH, равный -0.32 эВ. Подобно тому, как река сама собой не потечёт вспять, так и повернуть поток электронов против действия разности электрических потенциалов без расхода свободной энергии невозможно, нужна какая-то сопряжённая реакция, которая бы происходила с повышением потенциала обеспечивая, тем самым, приток энергии для основной реакции. В качестве таковой сопряжённой реакции бактерии вида Thiobacillus ferrooxidans используют восстановление кислорода до воды получая для этого электроны всё от того же Fe2+, подробнее см. здесь.
По аналогии с вышеизложенным можно предположить, что и у некоторых бактерий, метаболизм которых был основан на восстановлении оксидов азота, могла возникнуть обратная цепочка, которая окисляла нитриты, а полученные от них электроны посредством работающего в обратную сторону комплекса bc1 (или b6f) использовала для восстановления молекул NAD+. В таком случае им, как и упомянутой выше бактерии Thiobacillus ferrooxidans, нужно было использовать какую-то сопряжённую с окислением нитрита реакцию, которая, в отличие от неё, идёт с выделением энергии. И в цепочке восстановления нитрата такие реакции есть. Например, окислительно-восстановительный потенциал реакции между закисью азота N2O и оксидом азота NO равен +1.17 эВ, в то время как таковой для реакции между NO2 и NO3 равен +0.43 эВ. В свою очередь, соответствущий потенциал реакции между NO и NO2 равен +0.36 эВ. Таким образом, в принципе, молекулы нитрита могли одновременно служить как источником электронов для восстановления NAD+ , так и поставщиком энергии, необходимой для данной реакции, за счёт его восстановления до закиси азота по схеме NO2- => NO => N2O. Как уже отмечалось выше, некоторые терминальные оксидазы в цепочке аэробного дыхания, восстанавливающие кислород до воды, родственны некоторым восстанавливающим оксид азота ферментам денитрифицирующих бактерий, и, видимо, произошли от последних. Дальнейшим развитием данной схемы могло стать появление комплекса, способного в одиночку окислять нитрит, а потом отдавать отнятые у него электроны для восстановления хинонов. Именно такими свойствами и обладают реакционные центры хлорофилльного фотосинтеза. Поглотив квант света они вначале переходят в возбуждённое состояние с потенциалом менее -0.7 эВ, в котором легко отдают электрон хинону, после чего становятся сильным окислителем с потенциалом, которого вполне достаточно для того, что бы окислить нитрит. Таким образом, для появления простейшей системы хлорофилльного фотосинтеза, которая исходно имела лишь одну специфическую утилитарную задачу, могло быть вполне достаточно встроить в цепочку окисления нитрита лишь один дополнительный белок. Более того, не исключено, что данный белок целенаправленно вставлялся в геном бактерий специфическим вирусом! К такому выводу можно прийти как из факта наличия на обратной стороне гена, кодирующего реакционный центр гелиобактерии Heliobacterium modesticaldum, фрагмента, характерного для цианофагов, так и исходя из того, что протеин, кодируемый указанным геном, имеет очень сильно отличающийся от большинства других генов данной бактерии набор аминокислотных остатков (результат частного исследования автора данной статьи). Дальнейшее развитие аппарата фотосинтеза могло заключаться в зацикливании потока электронов по маршруту: реакционный центр - хиноны - комплекс bc1/b6f - растворимый цитохром c - реакционный центр и далее по кругу. Так как большинство компонентов, необходимых для циклической циркуляции электронов (кроме самого реакционного центра и, возможно, белка Риске) появились ещё в цепочке работы с оксидами азота, подобный переход мог осуществиться сравнительно легко и быстро. По-видимому, относительно небольшой по эволюционным меркам период времени понадобился и для появления у первичного реакционного центра возможности восстановления не только хинонов, но и ферредоксинов, как это происходит уже у гелиобактерий. Данное свойство позволило более гибко регулировать потоки энергии в клетке в зависимости от изменения её нужд, так как появилась возможность выбора среды, в которой будет распространяться ток, создаваемый фотосистемой (либо гидрофобная мембрана, либо цитоплазма). В дальнейшем у предков цианобактерий произошла дупликация реакционного центра с последующей специализацией одного из его клонов на восстановлении только хинонов, а другого - на восстановлении только ферредоксинов, что в будущем, благодаря синхронной работе обоих реакторов, сделало возможным окисление воды. Вследствие событий горизонтального переноса гены, кодирующие реакционные центры обоих типов, вместе с их "навесным оборудованием" были впоследствии перенесены в геномы некоторых других групп бактерий. Параллельно происходила постепенная адаптация реакционных центров для работы с другими потенциальными источниками электронов (сероводород, двухвалентное железо, вода без наличия нитрита в качестве вспомогательного вещества и т.д.).
Итак, мы изложили свои соображения по поводу того, как могли появиться первые реакционные центры хлорофилльного фотосинтеза, использовавшие в качестве источников электронов реакцию окисления нитритов. Тем не менее, есть субъективное ощущение, что сами по себе реакционные центры, даже такие простые, как у гелиобактерий, всё же достаточно сложны для того, что бы появиться, так сказать, на ровном месте, без всякой способствующей этому предыстории. А что, если попробовать заглянуть ещё дальше, что бы попытаться понять, не было ли у реакционных центров, в их сегодняшнем понимании, неких более простых предшественников? В общем-то, уже достаточно давно известно, что в отличие от большинства комплексов bc1 других бактерий, каждая половинка димерного комплекса b6f цианобактерий дополнительно содержит одну молекулу хлорофилла а и одну молекулу каротина. На Рис. 1 показано взаимное расположение всех кофакторов указанного комплекса.
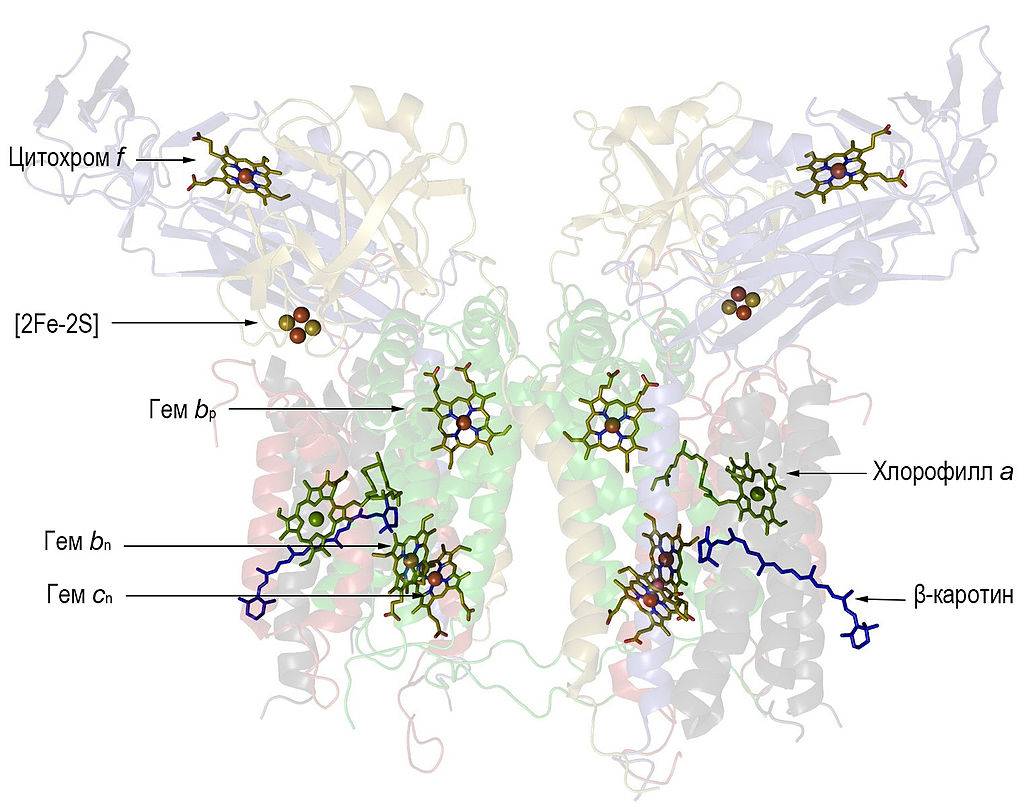
Рис.1. Кофакторы комплекса b6f (взято из соответствующей статьи в Википедии). Обратите внимание на тот факт, что гемы bn и cn расположены параллельно и очень близко друг к другу. Это весьма характерно для кофакторов ферментов, катализирующих реакции цепочки нитратного дыхания.
В настоящее время большинство исследователей склоняются к выводу, что молекула хлорофилла в рассматриваемом комплексе выполняет регуляторные функции, меняя проходящие через него потоки электронов в зависимости от условий освещённости, а бета-каротин выполняет структурную роль, помогая объединению нескольких белков, входящих в комплекс b6f, в единую структурную единицу. С возможной регуляторной функцией молекулы хлорофилла, в принципе, можно согласиться, так как в соответствии с проведёнными исследованиями, его фитольный хвост подходит почти вплотную к сайту связывания хинонов вблизи внешней стороны цитоплазматической мембраны и может ощутимо менять эффективность их удержания в соответствующем кармане. Но эта функция вполне могла появиться не сразу, и до поры, до времени, быть не единственной. Посмотрим, например, на результаты вот этого исследования. Известно, что молекулы гема b в составе обсуждаемого комплекса тоже могут поглощать свет в оптическом диапазоне. При этом, они приходят в состояние возбуждения, в котором, как и хлорофиллы, могут терять один электрон. Судя по всему, этот электрон уходит на аминокислотный остаток одной из координирующих его ароматических аминокислот. Как было выявлено в результате исследования, если b6f комплекс находится в полностью восстановленном состоянии, то практически одновременно с возбуждением гема bn и последующим уходом от него электрона, расположенный относительно недалеко от него (примерно в семи ангстремах) хлорофилл a, присоединяет "лишний" электрон (становясь, тем самым, анионом) и тоже переходит в состояние возбуждения. Кстати, именно на способности порфиринового кольца хлорофиллов принимать дополнительный электрон и основан способ быстрого отвода электронов от избавившейся от него молекулы возбуждённого хлорофилла, который используется в реакционных центрах (в них электрон вначале быстро проходит по цепочке, состоящей из двух хлорофиллов, или феофетина, то есть, хлорофилла без атома магния, прежде чем окончательно уйти на хинон или ферредоксин). Хлорофилл а какое-то время находится в возбуждённом состоянии, сбрасывая полученную им энергию, после чего возвращается в своё основное (невозбуждённое) состояние и избавляется от электрона. Предположительно, данный электрон через какое-то время возвращается обратно к гему bn, тем самым, вновь восстанавливая его. Таким образом, выходит, что при нахождении комплекса b6f в полностью восстановленном состоянии, хлорофилл может служить чем-то вроде "страховочного клапана", защищающего его от разрушения при переходе гема bn в возбуждение, вызванное действием света. А что будет, если гем cn в момент возбуждения гема bn, расположенного гораздо ближе к нему (примерно в трёх ангстремах), чем хлорофилл а, будет окисленным? Скорее всего, именно на него и перепрыгнет электрон с возбуждённого гема bn. Ну а дальше, если в это время в сайте связывания Qin находится хинон, то электрон должен уйти на него, ибо, как показали исследования, именно гем cn расположен ближе всего карману, в котором связываются окисленные хиноны. Выводы, которые можно из этого сделать, мы обсудим позже, а пока вернёмся к другой важной молекуле нашего комплекса - бета-каротину. Его функция в качестве своеобразной нити, "сшивающей" несколько субъединиц комплекса, предложенная рядом исследователей, выглядит несколько странно. Каротин обычно встречается вместе с хлорофиллом и выполняет функции антенны для более эффективного улавливания энергии света и передачи соответствующего возбуждения на хлорофилл. Возникает подозрение, что и в этом комплексе они работают в паре, тем более, что, как было продемонстрировано, поглащённая энергия света действительно очень быстро сбрасывается с каротина на хлорофилл, что говорит об оптимизации эволюцией их взаимного расположения. Структурообразующая функция каротина в данном варианте тоже не исключается, но она может быть лишь дополнительной и вспомогательной. Ещё одной характерной особенностью комплекса b6f является наличие в нём особого гема cn, который можно условно назвать "полугемом с", так как, в отличии от "настоящего" гема c он связан ковалентной связью лишь с одним остатком аминокислоты цистеина, а не с двумя, как это наблюдается у "нормальных" гемов с. Функции данного гема, как и хлорофилла и каротина, пока точно не выяснены, но есть предположение, что он может служить для увеличения эффективности процесса восстановления хинона, так как находится фактически на границе полости, в которой происходит соответствующая реакция.
Итак, с учётом всего вышеизложенного, попробуем восстановить возможную последовательность событий, приведшую в итоге к появлению схф. Исходно всё могло начаться с комплекса формат дегидрогеназы, поставляющей свободные электроны в составе хинонов для различных метаболических цепочек клетки, в том числе, и нитрат редуктаз (см. Рис. 2).
Рис. 2. Формат дегидрогеназа, с которой предположительно началась эволюция системы нитратного дыхания и хлорофилльного фотосинтеза. Фиолетовым цветом показана каталитическая субъединица формат дегидрогеназы. Коричневым цветом - бета-субъединица, служащая "проводами", состоящими из железосерных кластеров. Синим цветом обозначена гамма-субъединица, содержащая два гема типа b (условно обозначены чёрными кружками). Q и QH2 - соответственно окисленный и восстановленный хиноны. Севетло-серыми стрелочками обозначен путь электронов от формата к хинону.
После дупликации генов этого комплекса на его основе появилась нитрат редуктаза в которой сохранилась общая структурная композиция его субъединиц и, в значительной степени, его каталитический центр вместе с ключевым коферментом на основе молибдоптерина. Одним же из ключевых отличий было то, что электроны в новой схеме двигались в обратном направлении - от хинонов к связанному каталитической субъединицей нитрату (см. Рис. 3). Ориентация каталитической субъединицы комплекса относительно мембраны изменилась на противоположную, так как при восстановлении нитрата поглощаются протоны, что, соответственно, приводит к уменьшению их концентрации в цитоплазме и увеличению мембранного протонного потенциала.
Рис. 3. Нитрат редуктаза, предположительно произошедшая от формат дегидрогеназы. Фиолетовым цветом показана выступающая в цитоплазму каталитическая субъединица, имеющая те же коферменты, что и формат дегидрогеназа. Коричневым цветом обозначена бета-субъединица, по сути повторяющая аналогичную субъединицу формат дегидрогеназы. Синим цветом обозначена гамма-субъединица, так же воспроизводящая в общих чертах аналогичную субъединицу формат дегидрогеназы. Светло-серыми стрелками обозначен путь электронов от восстановленной формы хинона к каталитической субъединице.
Следующим важным шагом стало появление нитрит оксидоредуктазы за счёт очередной инверсии потока электронов, но теперь уже в цепочке нитратного дыхания (см. Рис. 4). Этот шаг был очень важен для бактериальной клетки, так как давал ей возможность регулировать, в зависимости от текущих потребностей, необходимый оптимальный баланс между соотношением в ней концентраций нитрита и нитрата. Но, как уже обсуждалось выше, реакция окисления нитрита является эндотермической, то есть, такой, для осуществления которой к реагентам необходимо подводить свободную энергию. Ею обладают, например, испускаемые Солнцем фотоны. До насыщения атмосферы кислородом данный источник энергии был, по-видимому, единственно возможным для окисления нитрита в широких масштабах. К этому моменту эволюция уже "изобрела" гемы типа b, которые работали, в частности, в формат дегидрогеназе и нитрат редуктазе. Как мы уже отмечали выше, в восстановленном состоянии данные гемы, будучи освещены светом, имеют свойство подобно хлорофиллам поглощать фотоны, после чего они становятся сильным восстановителем, и легко отдают один из своих электронов на подходящий окислитель. Соответственно, если между гемом bn и сайтом Qin появится молекула-посредник типа гема cn, он сможет быстро передать электрон через указанный гем непосредственно на хинон или полухинон. Следует ещё раз напомнить, что гем cn очень своеобразен. Он напоминает "классический" гем c, но, в отличие от него, удерживается с помощью ковалентной связи лишь одним остатком цистеина, а не двумя. Возможно, благодаря этому обстоятельству, он имеет гораздо большую подвижность и способен, подобно железосерному кластеру в белке Риске, выполнять роль своеобразного храповика, пропускающего электроны по направлению к хинону, но препятствующего их попыткам вернуться обратно. Отдав электрон, гем становится сильным окислителем с окислительно-восстановительным потенциалом, который вполне достаточен, что бы окислить нитрит.
Рис. 4. Нитрит оксидоредуктаза. Цвета субъединиц сохранены теми же, что и на Рис. 4. Чёрным кружочком с красной буквой "c" внутри символически обозначен гем cn. Иконка молнии зелёного цвета символизирует поглощение гемом bn одного фотона. Жёлтыми стрелочками показан путь электрона от возбуждённого гема bn к хинону. Светло-серыми стрелочками показан путь электрона от молекулы нитрита, завершающийся восстановлением гема bn.
Таким образом, теоретически можно предположить, что, на самом деле, комплексы bc1 и b6f с цитохромом cn могут являться простейшими "прототипами" работающих на солнечной энергии реакторов, исходно "изобретённых" эволюцией для вполне утилитарной задачи - получения дополнительного источника свободных электронов путём окисления нитрита. Такая возможность косвенно подтверждается некоторыми общими признаками, объединяющими рассматриваемые комплексы с реакционными центрами фотосинтеза:
- в обоих случаях "интерфейс" входа-вывода электронов состоит из одних и тех же элементов (хиноны, цитохромы с, ферредоксины);
- путь отобранного у молекулы на основе порфирина (хлорофилла, гема) электрона в обоих случаях имеет общие черты - вначале один-два других порфирина, потом хинон;
Кроме того, если ограничиться только комплексом b6f, то можно найти ещё три объединяющих их фактора:
- оба комплекса представляют из себя димеры;
- оба комплекса могут объединяться в суперкомплекс и работать в паре в режиме циклического потока электронов;
- оба комплекса содержат каротин и хлорофилл;
Кстати говоря, возможность происхождения реакционных центров хлорофилльного фотосинтеза от комплексов bc1/b6f обсуждается уже давно, данной гипотезе уже как минимум четверть века! Например, вот в этой статье приводится достаточно подробное изложение многочисленных фактов в поддержку этой идеи. В частности, фрагмент аминокислотной последовательности, кодирующий вторую, третью и четвёртую трансмембранные спирали цитохрома b, в которых находятся аминокислоты, фиксирующие локализацию гемов bn и bp (в обсуждаемой статье они обозначены, соответственно, как bL и bH) имеет определённую степень гомологии с участком аминокислотной последовательности реакционного центра второго типа, так же кодирующего его вторую, третью и четвёртую трансмембранную спирали, ответственные, в том числе, за фиксацию хлорофиллов (и родственных им кофакторов) и негемированного атома железа. Более того, гемы, хлорофиллы и атом железа фиксируются сохраняющими в большинстве случаев свои консервативные позиции остатками гистидина. Сохраняет свою структурную позицию и являющийся одним из кофакторов реакционного центра хинон, расположенный примерно в том же месте, где у комплексов bc1/b6f находится сайт связывания восстановленного хинона (см. Рис.5, взятый из обсуждаемой статьи, надеюсь, авторы на меня не обидятся).
Рис. 5. Схема, поясняющая соответствия между цитохромом b и реакционными центрами хлорофилльного фотосинтеза второго типа. Буквы B, C, D нумеруют трансмембранные спирали.
Ещё один любопытный факт, который приводят авторы упомянутой выше статьи, заключается в том, что у фотосинтезирующей протеобактерии R. capsulatus в зависимости от внешних условий, один и тот же протеин, входящий в светособирающий комплекс, может одним и тем же остатком гистидина лигировать либо хлорофилл, либо гем. Так же примечательно, что сайты связывания подвижного хинона у комплексов bc1/b6f и реакционных центров второго типа имеют сходные мотивы последовательности аминокислотных остатков и похожую трёхмерную структуру. Со времени написания обсуждаемой статьи прошло уже почти двадцать лет, и некоторые предположения, выдвинутые в ней, сейчас можно оспорить. Это касается, в частности, гипотезы о том, что исходной формой цитохрома b был протеин, содержащий восемь трансмембранных участков, и лишь потом произошло его расщепление на две субъединицы. Тем не менее, многие перечисленные в ней факты, на взгляд автора, не были в своё время оценены по достоинству и требуют переосмысления на новом уровне наших знаний, например, в свете упомянутой выше работы о результатах исследования возбуждения комплекса b6f светом из красного диапазона.
Однако, вернёмся к дальнейшим предполагаемым этапам в появлении современных схф. Как уже отмечалось выше, хлорофилл в составе комплекса b6f цианобактерий, по-видимому, играет роль своеобразного громоотвода, не позволяющего наносить данному комплексу существенные повреждения даже в том случае, когда сброс электрона с возбуждённого гема bn на хинон невозможен. В этом случае электрон уходит на молекулу хлорофилла, которая потом отдаёт энергию окружающим его аминокислотным остатком и, возможно, каротину (см Рис. 6).
Рис. 6. Усовершенствованный вариант нитрат оксидоредуктазы, включающий защитный механизм от возможного саморазрушения комплекса. По сравнению с Рис. 5 добавлена молекула хлорофилла (чёрная окружность с "хвостиком") и обозначенная синим прямоугольником меньшего размера дополнительная малая субъединица цитохрома b (PetD), позволяющая фиксировать хлорофилл в пространстве между ней и субъединицей b6. Красными стрелочками показан путь электрона к хлорофиллу и обратно, позволяющий гему bn в случае необходимости сбросить энергию возбуждения на хлорофилл, уменьшая, тем самым, риск его саморазрушения. Для упрощения восприятия бета-каротин, тоже входящий в состав комплекса, на рисунке не обозначен.
Появление цепочки синтеза хлорофилла (пусть вначале и как вспомогательной молекулы) ещё до появления современных универсальных схф могло быть очень важной преадаптацией, которая впоследствии позволила совершить заключительные шаги на этом пути. По сути, для появления первого "прототипа" современных схф природе оставалось лишь "развязать" функции получения энергии от солнечных лучей и добычи свободных электронов для восстановления реакционного центра. Это стало возможным после появления и распространения среди тесно связанных с нитрит оксидоредуктазой комплексов нитратного дыхания, диссимиляторных нитрат редуктаз и формат дегидрогеназ новых схем организации потока электронов без жёсткой механической связи между окислительным и восстановительным блоком (см. Рис. 7 и пояснительный текст к нему).
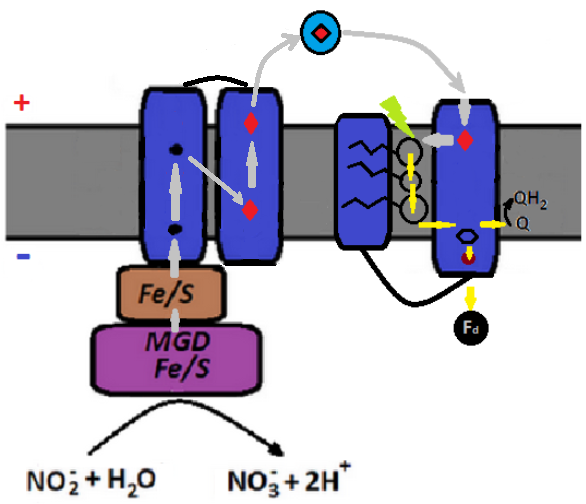
Рис. 7. Разделение единого комплекса нитрит оксидоредуктазы на две относительно независимые части, одна из которых выполняет окислительные функции (отбирает электроны у нитрита), а другая восстанавливает хиноны или ферредоксины за счёт энергии света. Между собой указанные части связаны с помощью растворимого цитохрома с (обозначен голубым кружком с красным ромбиком внутри). Освободившийся от излишних функций предок комплексов b6f(bc1) получил возможность проэволюционировать в полноценный реакционный центр. На рисунке изображён каталитический центр нитрит оксидоредуктазы с субъединицами для проводки электронов к периплазме, включая дополнительный фрагмент гамма-субъединицы, содержащий два гема c (такое решение наблюдается, например, у окисляющей нитрит бактерии Thiocapsa, которая уже упоминалась выше) и предполагаемый предковый реакционный центр. Жёлтыми стрелочками обозначен путь электронов от возбуждённого хлорофилла к хинону или ферредоксину. Шестиугольник чёрного цвета символизирует связанный реакционным центром семихинон. Кружок бордового цвета обозначает железосерный Fe4S4 кластер (у фотосистем II на его месте находится атом негемированного железа). Красными ромбиками обозначены гемы c.
Таким образом, в результате "изобретения" эволюцией гема c он стал очень широко применяться в качестве универсального переносчика электронов, потеснив, тем самым, архаичные решения на основе протеинов с железосерными кластерами. В частности, и в цепочках окислительно-восстановительных реакций с различными оксидами азота для передачи электронов между каталитической единицей и гамма единицей стал часто использоваться небольшой растворимый цитохром с (см. выше). Это, на первый взгляд, не очень значительное изменение привело к очень серьёзным последствиям. Во-первых, стало возможным разделить и специализировать функции прототипа комплексов b6f и bc1 как реакционного центра фотосинтеза и как передаточного звена между ним и каталитическим комплексом, выполняющим роль "добытчика" свободных электронов. Пока эти функции были сосредоточены в одном и том же комплексе, их одновременное улучшение было затруднено. Во-вторых, благодаря универсальному интерфейсу (хиноны на входе комплексов b6f и bc1 - растворимый цитохром с на их выходе) появилась возможность уйти от узкой специализации на окислении нитрита. Теперь в качестве источников электронов могло выступать практически любое вещество, окисление которого не требует слишком большой энергии, лишь бы существовали комплексы, способные перебрасывать изъятые у восстановителя электроны на хиноны. Благодаря этому современные фотоавтотрофы могут с помощью энергии света окислять водород, сероводород, нитрит и другие простые вещества. Более того, одни и те же электроны стало возможным пустить по кругу, организовав циклическую цепочку: восстановленные хиноны, комплекс b6f(bc1), цитохром с, реакционный центр, восстановленные хиноны. Может показаться, что такое бесконечное кружение электронов между комплексом b6f(bc1) и реакционным центром выглядит бессмысленным, но выигрыш для организма при этом заключается в том, что в процессе данного циклического движения электронов протоны попутно переносятся из цитоплазмы в периплазму, увеличивая тем самым, мембранный протонный потенциал, причём, без расхода какого-либо вещества. По сути, можно сказать, что, тем самым, природа изобрела почти вечный двигатель, работающий за счёт не иссякающей миллиарды лет энергии ядерных реакций внутри нашего светила! Наконец, в третьих, во-многом благодаря возможности диверсификации реакционных центров, которая появилась после разделения предкового, по отношению к современным b6f(bc1) комплекса, природа "научилась" окислять воду без посредника в лице нитрита. Кстати говоря, фотосистема II цианобактерий, по-видимому, обладает единственным на сегодняшний день реакционным центром, в котором окисление субстрата осуществляется прямо в нём, так как электроны от воды через остаток аминокислоты тирозина передаются непосредственно на окисленный хлорофилл. На то, что раньше каталитический центр окислителя, мог находиться в одном и том же комплексе с реакционным центром, косвенно намекает то обстоятельство, что кальций, присутствующий в водоокисляющем комплексе цианобактерий, у других комплексов первого типа, по-видимому, находится в той же самой консервативной позиции (см. ссылку на статью T. Cardona выше). В качестве одной из возможных причин наличия кальция в древнем реакционном центре можно предположить его известную способность связывать молекулы нитритов. Благодаря этому обстоятельству он изначально мог служить в качестве своеобразной удочки для концентрации в районе реакционного центра молекул нитрита, которые от него потом поступали непосредственно к кофактору.
Итак, разделение функций нитрит оксидоредуктазы и основанного на энергии света комплекса восстановления хинонов и ферредоксинов позволило на следующем шаге эволюции резко расширить области применения схф, уйдя от узкой специализации их лишь на одном сорте "горючего" в виде нитрита. Этому могло поспособствовать наличие в геноме некоторых вирусов вставляющегося в геном бактерии-жертвы участка, кодирующего белок Риске и упрощённую версию цитохрома f, так как появилась возможность получать электроны с хинонов на входном сайте цитохрома b и передавать их дальше на реакционный центр через белок Риске, цитохром f и растворимый цитохром c. После того, как схф предков цианобактерий избавились от функций нитрит оксидоредуктазы, схема их функционирования в общих чертах приобрела современный вид (см. Рис. 8).
Рис. 8. Прототип первой универсальной схф. Обозначения её элементов, уже присутствующих на Рис. 7, аналогичны. Новые элементы: коричневый прямоугольник с надписью 2Fe-2S символизирует белок Риске, голубой прямоугольник над ним - цитохром c1 для аноксигенных фотосинтетиков или цитохром f для цианобактерий и пластид, голубой кружок - растворимый цитохром c или аналогичный ему по функциям пластоцианин, оранжевые стрелочки символизируют переход протонов из цитоплазмы к хинону или пластохинону, реализуемому при работе реакционного центра и, соответственно, от (пласто)хинона в периплазму, осуществляемому цитохромом b. В фотосистемах с реакционными центрами второго типа возможен циклический поток электронов при котором хиноны от реакционного центра движутся напрямую к комплексу bc1. Так же циклический поток электронов при определённых условиях предположительно возможен в фотосистеме I цианобактерий за счёт передачи электронов от ферредоксинов к пластохинонам. Фотосистема II цианобактерий является единственным исключением, не укладывающимся в изображённую схему, так как в ней электроны отбираются у воды непосредственно самим фотосинтетическим комплексом. Возможно, это некий своеобразный атавизм, оставшийся в наследство от раннего варианта нитритного фотосинтеза, в котором электроны тоже отбираются у воды в пределах самого комплекса (см. Рис. 7). Если это действительно так, то получается, что реакционный центр II цианобактерий, который пока считается самым сложным и "продвинутым", на самом деле является наиболее архаичным. Впрочем, такая странная, на первый взгляд, ситуация в природе встречается не так уж редко. Можно, например, упомянуть тот факт, что широко распространённые сейчас протонные АТФ-зы являются, по-сути, деградировавшими натриевыми АТФ-ми.
Подведём краткий промежуточный итог. Большое количество гомологичных протеинов в схф и цепочках окисления и восстановления соединений азота позволяет выдвинуть гипотезу о том, что эти цепочки в процессе эволюции долгое время были тесно связаны. При этом, наличие в геноме некоторых мелаинабактерий, являющихся сёстринской, по отношению к цианобактериям группой, оперона генов, ответственных за нитрификацию (или нитратное дыхание), в котором уже присутствуют гомологи некоторых генов, типичных для схф цианобактерий, позволяет предположить, что ещё до появления у последних первых реакционных центров фотосинтеза, у них уже имелись некоторые преадаптации для движения эволюции в данном направлении. Непосредственным предшественником классических на сегодняшний день реакционных центров мог быть объединённый комплекс, сочетающий в себе функции современных нитрит оксидоредуктаз и комплекса b6f, использующий энергию возбуждённых светом гемов для окисления нитрита и последующего восстановления хинонов. Тот факт, что электроны при этом отбирались у воды, говорит о возможности очень раннего появления оксигенного фотосинтеза, что подтверждается последними данными молекулярных исследований, оценкой времени появления цианобактерий с помощью молекулярных часов, а так же свидетельствами локальной оксигенизации среды в прибрежных районах океана уже в архее.
Следует особо отметить, что все рассуждения о возможном происхождении хлорофилльного фотосинтеза от цепочки восстановления нитратов были бы пустой абстракцией, если бы на древней Земле не было самих нитратов. Действительно, до последнего времени считалось более или менее общепринятым, что нитраты в ощутимом количестве могли на ней появиться лишь после оксигенизации атмосферы за счёт деятельности выделяющих кислород цианобактерий, то есть, в любом случае, восстанавливающие нитрат бактерии не могли появиться ранее цианобактерий. Однако, недавнее открытие аппаратом Куриосити в почвах Марса нитратов в поистине огромных концентрациях, на один-два порядка превышающих концентрацию оных в наиболее благоприятных для земледелия земных почвах, заставляет взглянуть на эту проблему с иной точки зрения. Действительно, геологическая история Марса во многом похожа на геологическую историю Земли с той лишь разницей, что из-за меньшей массы планеты она проходила быстрее и к настоящему времени, по крайней мере, на поверхности уже практически закончилась. По поводу источников нитратов на Марсе в настоящее время идут оживлённые дискуссии, см., например, вот эту статью, но, в любом случае, можно достаточно уверенно утверждать, что 3.5-3.8 млрд. лет назад они там уже присутствовали в очень существенной концентрации. Значит, их наличие на Земле в эпоху архея тоже вполне вероятно, что даёт нашей гипотезе право на жизнь.
В заключение, рассмотрим ещё один важный аспект. Некоторые читатели могут задать резонный вопрос - почему автор считает, что система хлорофилльного фотосинтеза произошла от системы восстановления нитрата, а не наоборот? Действительно, в принципе, теоретически возможны оба варианта. И всё же, есть несколько соображений в пользу гипотезы автора.
Во-первых, у некоторых мелаинабактерий в оперное нитрат редуктазы есть гены (или их фрагменты), гомологичные генам системы фотосинтеза цианобактерий (цитохром f, цитохром c550), а в геноме некоторых серицитохроматий, представляющих собой семейство, отделившееся от последнего общего предка мелаинобактерий и цианобактерий ещё до их разделения, присутствует как минимум один ген, гомологичный гену BchG, пришивающему у гелиобактерий фитольный хвост к бактериохлорофиллу.
Во-вторых, при редукции нитрата оптимальной является локализация каталитической субъединицы комплекса на стороне мембраны, ориентированной в сторону цитоплазмы, так как при этом за счёт изъятия из неё протонов повышается протонный потенциал. Именно так и ориентированы относительно мембраны как нитрат редуктаза, так и гомологичная ей нитрит оксидоредуктаза, поставляющая электроны для фотосинтеза. Но для последней подобная ориентация отнюдь не является выгодной в чисто энергетическом плане, так как при её работе концентрация протонов в цитоплазме увеличивается, а электроны с помощью специального протеина приходится перемещать на другую сторону мембраны, ибо именно там находится приёмник электронов, восстанавливающих реакционный центр. Таким образом, априори более вероятно, что вначале появилась нитрат редуктаза, а впоследствии с использованием многих её элементов появились система хлорофилльного фотосинтеза вместе с запитывающей её электронами нитрит оксидоредуктазой. При этом, энергетически невыгодное выделение отобранных у воды протонов в цитоплазму для нитрит оксидоредуктазы и схф было скомпенсировано изъятием из неё протонов, необходимых для восстановления хинона и их последующим переносом в периплазму.
В третьих, цепочка синтеза бактерио(хлорофиллов), по существу, является продолжением цепочки синтеза гемов, добавляя к ней ещё несколько дополнительных операций. Если бы схф предшествовали системам окислительно-восстановительных реакций с оксидами азота, то более вероятной выглядела бы обратная ситуация.
