
Чем важнее ген, тем реже он мутирует
Изучение большого массива данных по мутагенезу у модельного растения Arabidopsis thaliana показало, что в разных участках генома мутации возникают с разной частотой. Темп мутагенеза можно предсказать по эпигенетическим признакам, таким как уровень метилирования ДНК, открытость хроматина и модификации гистонов. Распределение этих эпигенетических меток, в свою очередь, зависит от функциональной нагрузки участков ДНК. В результате получается, что частота возникновения новых мутаций связана обратной зависимостью с функциональной важностью данного участка генома и с силой действующего на него очищающего отбора. Иначе говоря, в наиболее важных участках новые мутации не только активнее вычищаются отбором, но и реже возникают. В частности, темп мутагенеза ниже внутри генов по сравнению с внешними (нетранскрибируемыми) областями и в жизненно важных генах, работающих постоянно, по сравнению с теми, что используются лишь эпизодически (например, включаются в ответ на какие-то внешние стимулы). По-видимому, в ходе эволюции у некоторых организмов под действием отбора развились молекулярные механизмы, снижающие частоту мутаций в наиболее важных частях генома. В основе их работы лежит привлечение ферментов репарации и других факторов, защищающих ДНК от повреждений, к определенным эпигенетическим меткам. Исследование показало, что неслучайный мутагенез играет важную роль в эволюции геномов. Некоторые характерные особенности молекулярной эволюции, которые обычно объясняют действием отбора (например, ускоренное накопление различий в менее важных участках генома), на самом деле во многом объясняются неслучайным мутагенезом. Который, впрочем, сам является результатом эволюции под действием отбора.
1. Эволюция скорости мутирования
Постулат о случайности мутаций входит во все учебники эволюции и вряд ли его когда-нибудь оттуда вычеркнут. Хотя уже давно известно, что он не абсолютен и нуждается во множестве оговорок и уточнений, число которых неуклонно растет по мере развития науки.
Мутации действительно случайны в том смысле, что у живых существ нет механизмов, позволяющих «рассчитать», какая мутация будет для них полезна в данных условиях, и аккуратно внести именно эту мутацию в свой геном. При этом у всех без исключения организмов геномы мутируют, фенотипические эффекты мутаций никем заранее не просчитываются, а точно предсказать, какие именно мутации возникнут в данной хромосоме при следующей репликации, невозможно. В этом отношении мутации случайны, во многих других аспектах — нет. Многие организмы сумели в ходе эволюции выработать механизмы, так или иначе регулирующие и оптимизирующие мутационный процесс (см., например: Мутагенез в лимфоцитах — результат целенаправленного изменения ДНК и последующей «неточной починки», «Элементы», 03.09.2007). Несколько показательных примеров рассмотрено в моей книге «Рождение сложности», где одна из глав целиком посвящена этой теме (она так и называется — «Управляемые мутации»).
Нельзя назвать случайной и такую важнейшую характеристику мутационного процесса, как его скорость. Темп мутагенеза зависит, в частности, от работы ферментов, осуществляющих репликацию и репарацию ДНК, и он эволюционирует под действием отбора. Поскольку большая часть не нейтральных (влияющих на приспособленность) мутаций вредны, отбор, как правило, способствует минимизации темпа мутагенеза. Хотя и тут есть исключения: например, некоторым вирусам высокий темп мутагенеза необходим для повседневного выживания, так что мутации, снижающие его ниже допустимого предела, отбраковываются отбором (см.: Вирусы-мутанты помогают друг другу в борьбе за выживание, «Элементы», 14.12.2005).
Но даже те организмы, которым не нужно постоянно мутировать, чтобы выживать здесь и сейчас, все равно не могут свести темп мутагенеза к нулю, потому что отбору на его снижение противостоят другие эволюционные силы. Главными из них считаются две. Во-первых, сверхточные системы репликации и репарации, скорее всего, будут слишком затратными: громоздкими, потребляющими много энергии и т. д. Поэтому в какой-то момент «стоимость» дальнейшего совершенствования этих систем перестаёт окупаться выигрышем от дальнейшего снижения темпа мутагенеза (иначе говоря, отбор на замедление мутагенеза уравновешивается отбором на упрощение и удешевление молекулярных систем, следящих за сохранностью генетического материала).
Вторая причина связана с генетическим дрейфом. Полезные мутации (в том числе мутации, снижающие темп мутагенеза), могут быть поддержаны отбором, только если их полезность превышает определенный порог, зависящий от эффективной численности популяции (Ne, Effective population size). Чтобы отбор помог мутации распространиться, желательно, чтобы ее полезный эффект (величина, на которую мутация увеличивает эффективность размножения) был больше, чем 4/Ne (и уж никак не меньше, чем 1/Ne). В противном случае мутация будет находиться во власти дрейфа, а не отбора, то есть вести себя не как полезная, а как нейтральная, и шансов зафиксироваться (достичь 100-процентной частоты) у нее будет очень мало. Чем ниже темп мутагенеза, тем меньше причиняемый им вред, и тем слабее полезный эффект от мутаций, замедляющих мутагенез еще сильнее. Поэтому в какой-то момент такие мутации перестают поддерживаться отбором. Предполагается, что именно такой уровень мутагенеза, соответствующий равновесию между отбором и дрейфом, и является конечным итогом эволюции скорости мутагенеза у многих организмов (M. Lynch et al., 2016. Genetic drift, selection and the evolution of the mutation rate).
2. Возможен ли избирательный контроль темпа мутагенеза?
В последние годы стали появляться данные, указывающие на то, что скорость мутирования может сильно различаться в разных участках генома и в разных генах, и что эти различия могут быть связаны, во-первых, с активностью (уровнем экспрессии) гена, во-вторых — с эпигенетическими метками (которые во многом определяют эту активность), такими как метилирование и ацетилирование лизинов в гистоне H3 или, скажем, «открытость хроматина», определяемая частотой расположения нуклеосом (см., например: F. Supek, B. Lehner, 2017. Clustered Mutation Signatures Reveal that Errоr-Prone DNA Repair Targets Mutations to Active Genes; X. Chen et al., 2012. Nucleosomes Suppress Spontaneous Mutations Base-Specifically in Eukaryotes).
В связи с этим возникает вопрос: не могли ли какие-нибудь организмы выработать в ходе эволюции специальные адаптации, позволяющие снизить темп мутирования не во всем геноме сразу, а избирательно — например, только в самых важных генах, случайные мутации в которых наиболее опасны?
Теоретически такое вроде бы возможно при определенных условиях, хоть и не совсем понятно, как часто эти условия выполняются (I. Martincorena, N. M. Luscombe, 2013. Non-random mutation: The evolution of targeted hypermutation and hypomutation). Из двух ограничений, упомянутых выше, в случае избирательного замедления мутагенеза одно слабеет, а другое усиливается. Слабеет ограничение, связанное с затратностью: с особой тщательностью защищать от мутаций отдельные гены, по идее, должно быть проще и дешевле, чем весь геном. Усиливается ограничение, связанное с дрейфом. Ведь в отдельном гене мутации возникают в тысячи раз реже, чем в геноме в целом (просто потому, что ген в тысячи раз короче генома). А значит, от дополнительного снижения темпа мутагенеза только в этом одном гене приспособленность увеличится совсем ненамного, даже если это очень важный ген.
Хорошо бы, конечно, придумать механизм, снижающий темп мутагенеза во всех важных генах сразу. Этому дрейф должен мешать не так сильно, поскольку суммарная длина важных генов достаточно велика. Но возможен ли такой механизм? Существует ли он у каких-нибудь реальных организмов?
3. Сбор данных по мутагенезу у Arabidopsis thaliana
Статья группы исследователей из США, Германии, Франции и Швеции, опубликованная 12 января в журнале Nature, показывает, что как минимум один хорошо изученный организм — модельное растение резуховидка Таля (Arabidopsis thaliana) — обладает искомой способностью. Почти наверняка арабидопсис в этом не уникален, но не будем забегать вперед: строгие доказательства пока получены только для этого вида.
Исследователи собрали большой массив данных по мутагенезу у Arabidopsis. Одна из главных трудностей тут в том, что эффекты мутагенеза нужно тщательно отделять от эффектов отбора. Например, если мы просто отсеквенируем геномы 1000 растений, сравним их между собой и выявим все полиморфизмы (вариации нуклеотидной последовательности), то получим картину, отражающую не мутагенез в чистом виде, а совместное действие мутагенеза и отбора. Например, мы не увидим значительной части вредных мутаций, которые постоянно возникают, но отбор старательно вычищает их из генофонда.
Чтобы свести влияние отбора к минимуму, исследователи использовали несколько подходов. Один из них показан на рис. 1 (слева вверху). От каждого растения брали по одному случайно выбранному семечку, выращивали из него растение-потомка, от него снова брали случайное семечко, и так далее. Спустя 24 поколения геномы потомков секвенировали и сравнивали с геномом исходного растения. При таком подходе отбор хоть и не устраняется вовсе, но радикально ослабляется: в итоговую выборку не попадут (будут отбракованы) только летальные мутации, а также те, что ведут к полному бесплодию. Другой подход связан с выявлением соматических мутаций путем секвенирования разных клеток одного и того же растения. В этом случае можно выловить даже мутации, которые на уровне целого растения были бы несовместимы с жизнью или размножением.
Полученный список мутаций затем проверялся различными статистическими тестами, чтобы убедиться, что он отражает именно процесс мутагенеза (то есть не был сильно искажен отбором). Результаты двух таких тестов показаны на рис. 1 справа вверху. Использовались два показателя: соотношение несинонимичных (значимых) и синонимичных замен и отношение числа замен, ведущих к появлению преждевременного стоп-кодона, к числу синонимичных замен. Идея в том, что синонимичные замены обычно нейтральны, отбор их не выбраковывает. Значимые замены, напротив, часто оказываются вредными, преждевременные стоп-кодоны — тем более. Биологи даже в самых буйных фантазиях не могут вообразить, что возможны механизмы, позволяющие клетке избирательно снизить частоту значимых замен или мутаций, создающих стоп-кодоны. Или вообще хоть как-то отличить такие замены от синонимичных на уровне ДНК. Таких механизмов почти наверняка не существует. Поэтому в ходе мутагенеза должно появляться намного больше значимых замен и преждевременных стоп-кодонов, чем их потом останется в генофонде популяции, находящейся под действием отбора.
Исходя из этой логики, выявленные мутации белок-кодирующих участков генома (на графиках они подписаны «De novo») сравнивали, во-первых, с природным генетическим разнообразием A. thaliana (из проекта «1001 геном», 1001G), во-вторых, с теоретически ожидаемым спектром вновь возникающих мутаций (Null).
Оказалось, что оба показателя значимо выше у выявленных мутаций (De novo), чем в природных популяциях арабидопсиса (1001G), и лишь чуть-чуть (незначимо) ниже, чем у теоретически ожидаемых мутаций. Следовательно, отбор не сильно повлиял на собранные данные, а значит, их можно использовать для изучения закономерностей мутагенеза. К такому же выводу привели и другие проверки.
4. Скорость мутагенеза можно предсказать по эпигенетическим меткам
Убедившись в адекватности исходных данных, авторы приступили к их анализу. Они сопоставили частоту возникновения мутаций в разных участках генома с эпигенетическими характеристиками, такими как открытость хроматина, метилирование ДНК и модификации гистонов. Оказалось, что многие эпигенетические признаки значимо коррелируют с темпом мутагенеза (рис. 1, нижние графики). Например, в участках с высоким уровнем метилирования четвертого лизина в гистоне H3 (H3K4Me1) темп мутагенеза ниже, чем в среднем по геному, а в участках с высоким уровнем ацетилирования девятого лизина того же гистона (H3K9ac) он, наоборот, повышен.
По данным об эпигенетических метках можно, как выяснилось, довольно точно предсказать темп мутагенеза для разных участков генома. Например, на рис. 2a показан предсказанный по эпигеномным данным усредненный темп мутагенеза для участков, прилегающих к точкам начала (TSS) и окончания (TTS) транскрипции (Upstream, Downstream — нетранскрибируемые участки перед геном и после него, Gene body — «тело гена»). Видно, что темп мутагенеза повышен в нетранскрибируемых участках, особенно в непосредственной близости от границ гена (вероятно, потому, что там много участков открытого хроматина, к которым должны прикрепляться всякие регуляторные белки). Причем предсказанная картинка (рис. 2, а) действительно очень похожа на реально наблюдаемую (рис. 2, b).
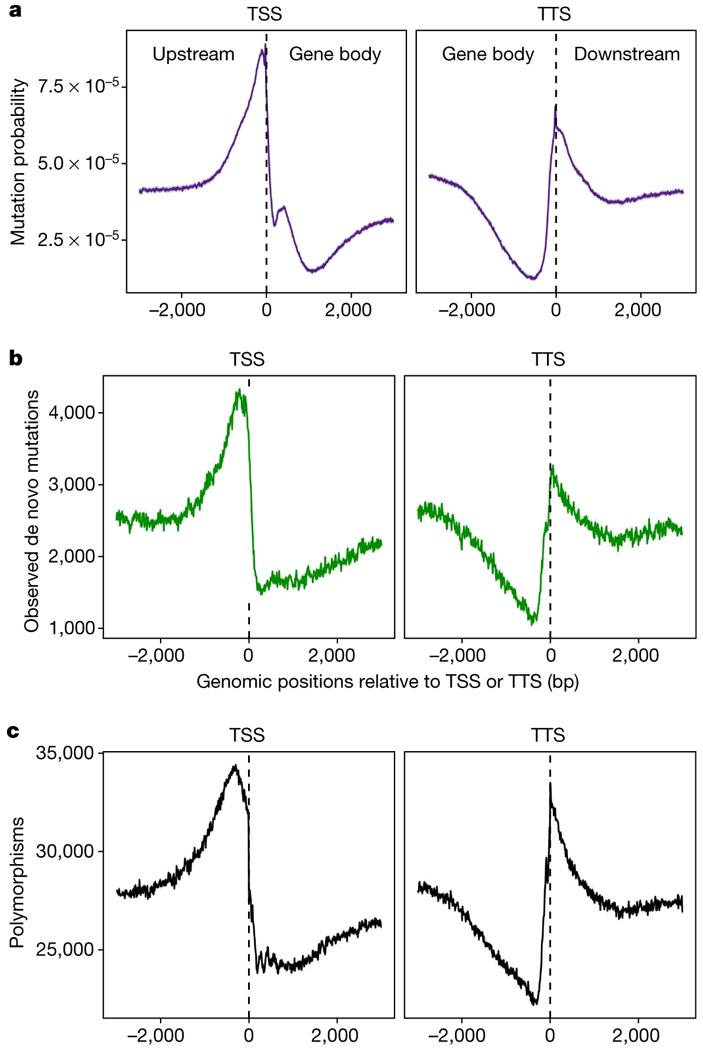
Более того, распределение мутаций по окрестностям TSS и TTS довольно точно совпадает с распределением генетической вариабельности (полиморфизмов) в природных популяциях (рис. 2, c). Из этого (а также из ряда дополнительных проверочных тестов) следует, что наблюдаемое распределение полиморфизмов в большей степени определяется мутагенезом, чем отбором. Вывод довольно-таки сенсационный, ведь до сих пор «по умолчанию» было принято объяснять подобные распределения именно отбором.
Авторы также обнаружили, что разные части генов мутируют с разной скоростью, что эти различия тоже можно предсказать по эпигеному, и что примерно так же распределены и природные полиморфизмы. В частности, из всех экзонов, входящих в состав гена, чаще всего мутируют первый и последний, и в них же чаще всего встречаются полиморфизмы в природе. Скорость мутирования экзонов связана отрицательной зависимостью с длиной нетранслируемых областей гена, а также с числом и длиной интронов. Чем длиннее нетранслируемые области и интроны, тем реже мутируют белок-кодирующие участки гена.
5. Чем слабее очищающий отбор, тем сильнее мутагенез
Означает ли всё это, что очищающий отбор, которым традиционно объясняли распределение генетических различий по геномам (где различий меньше, там предполагали более сильный отбор), в действительности тут вовсе ни при чем? На первый взгляд вроде бы да, на самом деле нет.
С одной стороны, исследование показало, что скорость накопления генетических различий (например, между особями одного вида или между близкими видами) в тех или иных участках генома определяется мутагенезом в большей степени, чем отбором. Мутагенез, в свою очередь, регулируется эпигенетическими метками.
С другой стороны, авторы показали, что самая низкая скорость мутагенеза (и соответствующие ей эпигенетические метки) приурочены как раз к тем участкам генома, которые находятся под наиболее сильным очищающим отбором. И наоборот, в тех участках, где очищающий отбор ослаблен, эпигенетические характеристики способствуют ускоренному мутагенезу.
В частности, выяснилось, что гены с самыми низкими темпами мутагенеза — это в основном гены с самыми консервативными (постоянными, мало меняющимися в ходе эволюции) функциями, такими, например, как трансляция. Подобные гены, как правило, работают постоянно в большинстве клеток и тканей. Они необходимы для повседневного, базового выживания (поэтому их еще называют «генами домашнего хозяйства). Такие гены обычно находятся под сильнейшим очищающим отбором. Иначе говоря, мутации в них чаще всего оказываются вредными и отбраковываются. Эти гены давно оптимизированы, менять их незачем, и они действительно меняются в ходе эволюции очень медленно.
Напротив, у генов, функции которых связаны с реакцией организма на переменчивые условия среды, темп мутагенеза оказался повышенным. Очищающий отбор слабее действует на такие гены, а мутации в них имеют чуть больше шансов оказаться полезными. Поэтому такие гены в ходе эволюции меняются быстрее.
Выяснилось также, что темп мутагенеза понижен в жизненно важных генах (отключение которых несовместимо с жизнью), а также в генах, экспрессирующихся во многих клетках и тканях по сравнению с генами с узкими профилями экспрессии. В обоих случаях различия в темпах мутагенеза коррелируют с эпигенетическими характеристиками.
О силе действия очищающего отбора на тот или иной ген и об имеющихся ограничениях на его эволюционные изменения (evolutionary constraint) можно судить по целому ряду количественных показателей, таких как наследственная и средовая изменчивость уровня экспрессии гена или соотношение значимых и синонимичных различий при сравнении последовательностей данного гена у разных особей одного вида или у близких видов (Dn/Ds). Авторы выполнили много таких тестов и всё сошлось: чем важнее ген, чем фундаментальнее его функция и чем сильнее эволюционные ограничения на его изменения, тем ниже темп мутирования гена — как эмпирически измеренный, так и предсказанный по эпигенетическим признакам.
6. Что всё это значит?
Полученные результаты показывают, что у Arabidopsis (а скорее всего и у многих других организмов, хотя это еще предстоит доказать) в ходе эволюции, по-видимому, выработались специальные механизмы, позволяющие снизить скорость мутирования наиболее важных участков генома — тех участков, мутации в которых чаще всего оказываются вредными. В результате среди вновь возникающих мутаций существенно снижается доля вредных, а общее негативное влияние мутагенеза на приспособленность уменьшается.
Предполагаемый принцип работы этого механизма в самых общих чертах показан на рис. 3. Его детали еще только предстоит расшифровать.
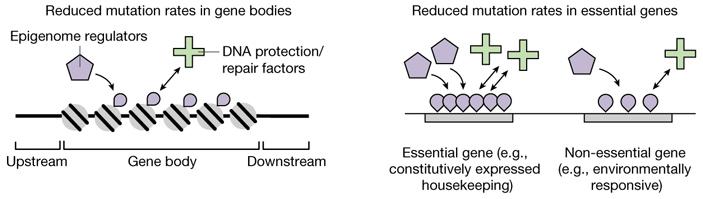
Рис. 3. «Концептуальные диаграммы», отражающие авторскую интерпретацию полученных результатов. Рисунок из обсуждаемой статьи в Nature
Исследование показало, что по своим эпигенетическим характеристикам гены отличаются от межгенных участков, а важные гены — от менее важных. Причем различия эти не абы какие, а закономерные, предсказуемые и похожие в обоих случаях. Например, уровень метилирования четвертого лизина гистона H3 (H3K4Me1) повышен как в «теле гена» (Gene body на рис. 3) по сравнению с прилегающими нетранскрибируемыми участками (Upstream, Downstream), так и в жизненно важных (Essential) генах по сравнению с менее важными (Non-essential). Почему эпигенетический признак H3K4Me1 распределен именно так, а не иначе, и какие молекулярные механизмы (Epigenome regulators на рис. 3) ответственны за такое его распределение — отдельный вопрос, пока еще очень далекий от разрешения. Тем не менее, мы знаем, что по данному признаку важные участки генома можно отличить от менее важных.
Кроме того, известно, что в клетке существуют специализированные молекулярные системы, отвечающие за репарацию и защиту ДНК от повреждений (DNA protection/repair factors на рис. 3).
Авторы предполагают, что в ходе эволюции у «факторов защиты и репарации ДНК» (или у каких-то регуляторных систем, контролирующих их деятельность) выработалось полезное свойство, состоящее в том, что эти факторы активнее, чаще или тщательнее работают с участками ДНК, обладающими определенными эпигенетическими характеристиками — например, повышенным уровнем H3K4Me1. Это свойство — не что иное, как эволюционная адаптация, направленная на оптимизацию мутационного процесса и уменьшение приносимого им вреда.
Важным практическим следствием является необходимость пересмотра механизмов эволюции нуклеотидных последовательностей. Многое из того, что приписывалось действию отбора, на самом деле, по-видимому, является результатом не совсем случайного мутагенеза. Многое, но, разумеется, не всё. Например, пониженные значения Dn/Ds у жизненно важных генов нельзя объяснить мутагенезом: это трудноподделываемая роспись очищающего отбора. Кроме того, не стоит забывать, что сам характер обнаруженной авторами «неслучайности» мутагенеза наверняка является результатом эволюции под действием отбора.
Источник: J. Grey Monroe, Thanvi Srikant, Pablo Carbonell-Bejerano, Claude Becker, Mariele Lensink, Moises Exposito-Alonso, Marie Klein, Julia Hildebrandt, Manuela Neumann, Daniel Kliebenstein, Mao-Lun Weng, Eric Imbert, Jon Ågren, Matthew T. Rutter, Charles B. Fenster & Detlef Weigel. Mutation bias reflects natural selection in Arabidopsis thaliana // Nature. 2022. DOI: 10.1038/s41586-021-04269-6
18.01.2022 • АЛЕКСАНДР МАРКОВ
Комментарии представителей сайтов-участников nan:Если какая-то часть организма формируется на основе предшествующих, то при повреждении предыдущих все предшествующие будут нефункциональны. Естественно, что в ходе оптимизации выработались механизмы, которые защищают предшествующие от мутаций. Зато передний крах новшеств. наоборот, должен обладать повещенными возможностями экспериментирования для последующего прогресса. Это – чистая логика, которую подтверждает исследование в статье.
|
 http://www.scorcher.ru/xml/news.rss
http://www.scorcher.ru/xml/news.rss
Рис. 2. Темп мутагенеза в окрестностях точек начала (TSS) и окончания (TTS) транскрипции (усредненные данные по всем генам). a — темп мутагенеза, предсказанный по эпигеномным данным (с учетом корреляций, показанных на рис. 1); b — реальные данные по мутагенезу; c — генетический полиморфизм в природных популяциях (на основе 1135 геномов). Рисунок из обсуждаемой статьи в Nature