Противораковые препараты (антионкологические средства) применяются для лечения злокачественных опухолей. Они воздействуют на быстро делящиеся клетки, в том числе на раковые. Как пример противоракового препарата - абиратерон имеет цену, приемлемую для больных и доступен во многих аптеках. Это важный и эффективный противораковый препарат, применяемый при лечении гормонозависимых опухолей, в частности — рака предстательной железы. Он относится к ингибиторам синтеза андрогенов.
Абиратерон подавляет фермент CYP17 (17α-гидроксилазу/С17,20-лизазу), который участвует в синтезе андрогенов (в том числе тестостерона) не только в яичниках или яичках, но и в надпочечниках и непосредственно в раковой ткани простаты.
Таким образом, он снижает уровень всех источников андрогенов, что особенно важно при кастрационно-резистентном раке простаты (КРРП) — когда опухоль продолжает расти даже при очень низком уровне тестостерона.
В зависимости от механизма действия выделяют несколько основных видов противораковых препаратов:
Это классические химиотерапевтические средства, которые подавляют рост и деление клеток. Есть несколько подвидов цитостатиков:
Алкилирующие агенты
Примеры: Циклофосфамид, Цисплатин, Карбоплатин
Механизм: Повреждают ДНК, предотвращая деление клеток.
Антиметаболиты
Примеры: Метотрексат, 5-фторурацил, Гемцитабин
Механизм: Имитируют структуры веществ, необходимых для синтеза ДНК, блокируя её производство.
Антрациклины
Примеры: Доксорубицин, Эпирубицин
Механизм: Повреждают ДНК и ингибируют фермент топоизомеразу II.
Митозные ингибиторы (препараты растительного происхождения)
Примеры: Параклитаксел, Доцетаксел, Винкристин, Винбластин
Механизм: Нарушают формирование веретена деления, останавливая митоз.
Топоизомеразные ингибиторы
Примеры: Иринотекан, Топотекан, Эттопозид
Механизм: Блокируют ферменты, участвующие в раскручивании ДНК, что приводит к разрывам цепочек.
Действуют на специфические молекулы или рецепторы, связанные с ростом опухоли.
Примеры:
Ингибиторы тирозинкиназ
Примеры: Иматиниб, Лапатиниб, Эрлотиниб, Гефитиниб
Механизм: Блокируют сигналы, стимулирующие рост опухолевых клеток.
Ангиогенез-ингибиторы
Примеры: Бевацизумаб, Сорафениб, Сунитиниб
Механизм: Останавливают образование новых кровеносных сосудов, питающих опухоль.
АнтиртГФ-β (антирецептор трансформирующего фактора роста бета)
Примеры: Радотрикс (на примере онкологического заболевания — кожный Т-клеточный лимфомы)
Используются при гормонозависимых опухолях (например, рак молочной железы, рак простаты).
Примеры:
Ингибиторы ароматаз: Анastroзол, Летрозол
Антиэстрогены: Тамоксифен
Аналоги ЛГРГ (гонадотропин-рилизинг гормона): Гозерелин, Лейпрорелин
Антиандрогены: Бикалутамид
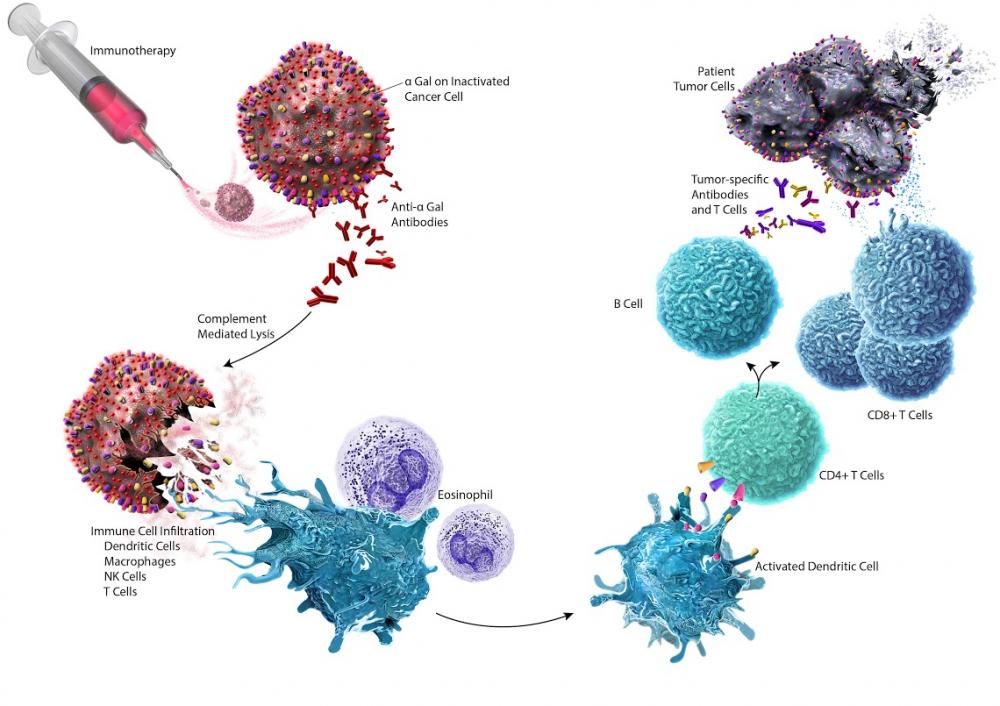
Повышает способность иммунной системы распознавать и уничтожать раковые клетки.
Примеры:
Ингибиторы контрольных точек иммунитета (checkpoint inhibitors)
Примеры: Пембролизумаб, Ниволумаб, Ипилимумаб
Механизм: Убирают "тормоза" иммунного ответа, позволяя Т-лимфоцитам атаковать опухоль.
CAR-T-клеточная терапия
Примеры: Кимриах, Язультта
Механизм: Изменённые иммунные клетки пациента уничтожают определённые виды раковых клеток.
Цитокины
Примеры: Интерфероны, интерлейкины
5. Препараты радионуклидной терапии (радиоиммунотерапия)
Содержат радиоактивные изотопы, направленно поражающие опухоль.
Примеры:
Иод-131 (при раке щитовидной железы)
Лутетий-177 (например, Lutathera при нейроэндокринных опухолях)
6. Противоопухолевые антибиотики
Хотя не все они являются антибиотиками в традиционном понимании, это группа препаратов, полученных из микроорганизмов.
Примеры:
Блеомицин
Даунорубицин
Не убивают раковые клетки напрямую, но помогают при метастазировании в кости.
Примеры:
Золедроновая кислота
Деносумаб
Выбор препарата зависит от типа опухоли, её стадии, наличия молекулярных маркеров, общего состояния пациента и других факторов. Часто используются комбинированные схемы, включающие несколько групп препаратов.
Развитие онкологии в последние десятилетия связано с бурным прогрессом в области фармацевтики и молекулярной биологии. Современные исследования направлены на создание новых, более эффективных и менее токсичных препаратов , способных обеспечить длительный контроль над опухолью и даже излечение при некоторых формах рака.
Таргетная терапия: персонализированный подход
Иммунотерапия: будущее противоопухолевого иммунного ответа
Пролекарства и доставка лекарств
Комбинированное лечение
Фармакогеномика и персонализированная медицина
Натуральные соединения и новые химические структуры
Упрощение терапии и улучшение качества жизни
Благодаря достижениям в области геномики, биотехнологии и цифровых технологий, сфера разработки противораковых препаратов стремительно развивается. Будущее онкологического лечения — за точной, целевой и комбинированной терапией , основанной на индивидуальном профиле опухоли пациента. Это открывает новые горизонты в борьбе с раком, превращая его из неизлечимого заболевания во всё более контролируемое хроническое состояние.