Минеральные корни современных ферментов.
Относится к разделу Молекулярная биология
"Мы привыкли думать, что если бы мы могли понять, какова была роль углерода, водорода, азота, кислорода, фосфора и серы, мы сразу же могли бы понять всю биологию. Но теперь, когда мы обнаруживаем, что эти и другие довольно редкие элементы, переходные металлы, необходимы для биологии, мы спрашвиваем, какова была их роль в происхождении жизни".
Morowitz H. J., Srinivasan V., Smith E. 2010.
Явление катализа – основа существования живой клетки и имело ключевое значение в процессе возникновения жизни. Вспомним, что катализатором (точнее идеальным катализатором) называется химическое соединение или простое вещество, которое ускоряет одну из термодинамически возможных реакций и не входит в стехиометрическое уравнение этой реакции. В самих ЖС и в тех условиях, в которых они возникли термодинамически возможно очень большое количество химических реакций, однако в реальности протекают только небольшая часть из них. Это происходит только потому, что катализаторы направляют эти реакции по строго определённому пути, что, в свою очередь, и позволяет ЖС контролировать избирательное и важное для выживания протекание строго определённых реакций метаболизма.
Биологический катализ осуществляется в современных живых организмах с помощью полимерных макромолекул - белков и РНК. Для синтеза этих макромолекул необходим катализ их синтеза с помощью опять же полимерных макромолекул. Отсюда возникает проблема возникновения первых биологических катализаторов, которая фактически является проблемой "курицы или яйца". Возникает важный вопрос. Если на самых первых стадиях биогенеза полимерные макромолекулы отсутствовали, то что должны представлять собой первые катализаторы? В рассматриваемой статье в качестве первых катализаторов предполагаются металло-серные кластеры, в первую очередь железо-серные. Железо-серные кластеры являются древнейшими простетическими группами
способные связывать различные неполимерные лиганды, которые могли синтезироваться абиогенно (CO2, СО, H2, NH3, H2S и H3PO4) или возникнуть в результате последующей эволюции первых метаболических сетей. Впрочем, одними из первых должно было быть так называемое аквакомплексообразование, где комплексообразователем служат просто молекулы воды, которые обазуют комлпексные соединения как в растворе - K+(H2O)6, Ca2+(H2O)6 Na+(H2O)6, Mg2+(H2O)6 и др., так и в осадочных породах (кристаллогидраты) - MgSO4·2H2O (6H2O; 7H2O), Na2SO3·7H2O, CuSO4 ·H2O (3H2O; 5H2O), BaCl2·H2O (2H2O), NaHPO4·2H2O (7H2O).
Появившаяся в 50-х годах прошлого века и продолжающая развиваться позволила объяснить и предсказать большое разнообразие каталитических активностей координационных соединений и роли различных лигандов в катализе органических реакций.
Комплексные соединения переходных металлов в растворах проявляют большую активность и селективность по сравнению с катализом ионами тех же металлов.
Именно с точки зрения большой потенциальной способности к разнообразой каталитической активности координационных соединений и будет рассмаотрен вопрос эволюции катализаторов в данной статье.
Ключевой компонент эволюции каталитической активности - это замена одних лигандов другими, которые должны были появиться в результате эволюции метаболизма.
Речь пойдёт не просто о стартовой для жизни роли минералов. В данной статье рассматривается и обосновывается модель происхождения активных центров древнейших и многих современных белковых ферментов, как результат последующего "захвата" этих минералов белковыми молекулами.
В современных живых клетках не описано случаев, когда чисто неорганический внутриклеточный минерал мог бы выполнять какие-нибудь каталитические функции. Однако фрагменты неорганических минералов можно найти в активных центрах многих ферментов. Попробуем разобраться, в каких группах ферментах находятся эти фрагменты, насколько древними являются эти группы ферментов и каким неорганическим минералам могут соотвествовать эти минеральные части ферментов.
Наиболее изученной является группа так называемых железо-серных белков (FeS-белков или протеинов).
FeS-протеины - это белковые ферменты, которые в активном центре имеют структуры общей формулой FenSm, в которых с сульфидной группой с пептидоами связаны несколько железных центров, способных находиться в различных окислительных состояниях. Такого рода структуры получили название железо-серных (FeS) центров, или кластеров.
Структура FeS-кластеров в белках.
Для того, чтобы по возможности разобраться в вопросах, связанных с происхождением первых ферментов, имеющих FeS-кластеры, и найти их минеральные аналоги необходимо подробнее ознакомиться с структурой FeS-кластеров в современных белках. В настоящее время описано более чем 120 типов ферментов, содержащих железо-серные кластеры [ Kalyvas C. 2008].
Как увидим ниже, многие FeS-центры имеют кристаллическую структуру, сходную с таковой у некоторых минералов, таких, например, как грейгит, макиавит и др.
Почти во всех FeS-кластерах железные центры являются тетрагональными, связанные нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Кислотолабильной сера называется потому, что при обработке белка кислотой происходит выделение этих атомов серы в составе сероводорода H2S. Сульфидные группы являются двух- или трёхкоординатыми. Многие из них относятся к так называемым электронно-транспортным белкам, осуществляющим окислительно-восстановительные реакции. FeS-белки, осуществляющие окислительно-восстановительные реакции путём переноса электронов, получили особое название ферредоксины (аббревиатура fd). Железо в ферредоксине может быть в окисленной форме и иметь степень окисления +3. При восстановлении оно приобретает степень окисления +2. Каждый кластер может быть выражен определённой формулой, в которую нередко вписываются возможные формальные степени окисления этого кластера. Например, для очень распространённом в современных белках кубанового кластера (описание см. ниже) его формула и два возможных формальных заряда кластера обозначаются как [Fe4S4]2+/+.
Наиболее распространёнными являются так называемые 2Fe-2S-, 4Fe-4S- и 3F-4S-кластеры (см. рис. 1).
2Fe-2S ([Fe2S2])-кластеры имеют наиболее простое строение. Они содержат два иона железа, связанных сульфидными мостиками друг с другом и координированных четырьмя цистениловыми лигандами.
Окисленные белки содержат в таком центре два Fe3+-иона, тогда как восстановленные белки содержать один Fe3+ и один Fe2+-ион (этот заряд в действительности перераспределён между ионами железа в виде средней величины +2,5. Таким образом, типы окисленного состояния можно описать как (FeIII)2 и FeIIIFeII.
4Fe-4S ([Fe4S4])-кластеры (или тиокубановые кластеры) содержат 4 иона железа и 4 сульфид-иона, координированных четырьмя цистениловыми лигандами. Интересно, что окисленные состояния этих кластеров различных в разных типах ферредоксинов и подразделяются на так называемые низко-потенциальные (бактериального типа) и высокопотенциальные (окисленные состояния [2Fe3+, 2Fe2+] (Fe4S42+) и [3Fe3+, Fe2+] (Fe4S43+).
В бактериальных кубановых ферредоксинах, которые мы в дальнейшем будем интерпретировать как более древние, окисленные состояния представляют собой [Fe3+, 3Fe2+] (Fe4S4+) и [2Fe3+, 2Fe2+] (Fe4S42+). Таким образом, эти два семейства 4Fe-4S-кластеров имеют общее формальную степень окисления Fe4S42+.
Не все 4Fe-4S являются ферредоксинами, в некоторых отсутстуют тиолатные лиганды, и 4Fe-4S-центры служат не для переноса электронов, а в качестве
3Fe-4S ([Fe3S4])-кластеры ( или тиокубановые кластеры) содержат 4 сульфидных мостика, связывающих 3 иона железа.
Формальная степень окисления может варьировать от [Fe3S4]+ (все ионы железа находятся в форме Fe3+) до [Fe3S4]2- (все ионы железа находятся в форме Fe2+)
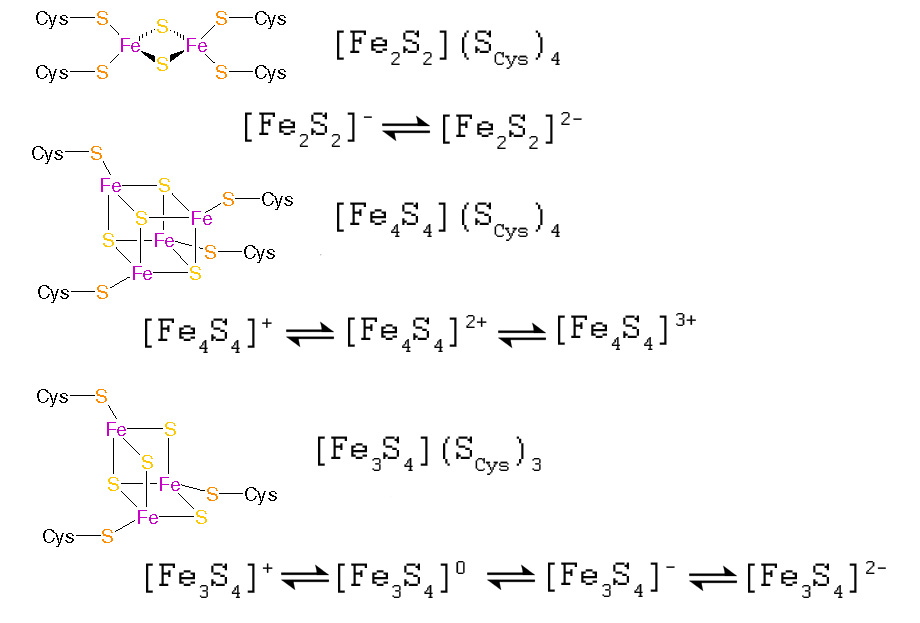
Рис. 1. Структура наиболее распространённых FeS-кластеров и их возможные окисленные состояния.
Другие FeS-кластеры. Кроме описанных выше в современных белках обнаружено довольно большое разнообразие FeS-кластеров, структура которых приведена на рис. 2. Их окисленные состояния можно узнать из
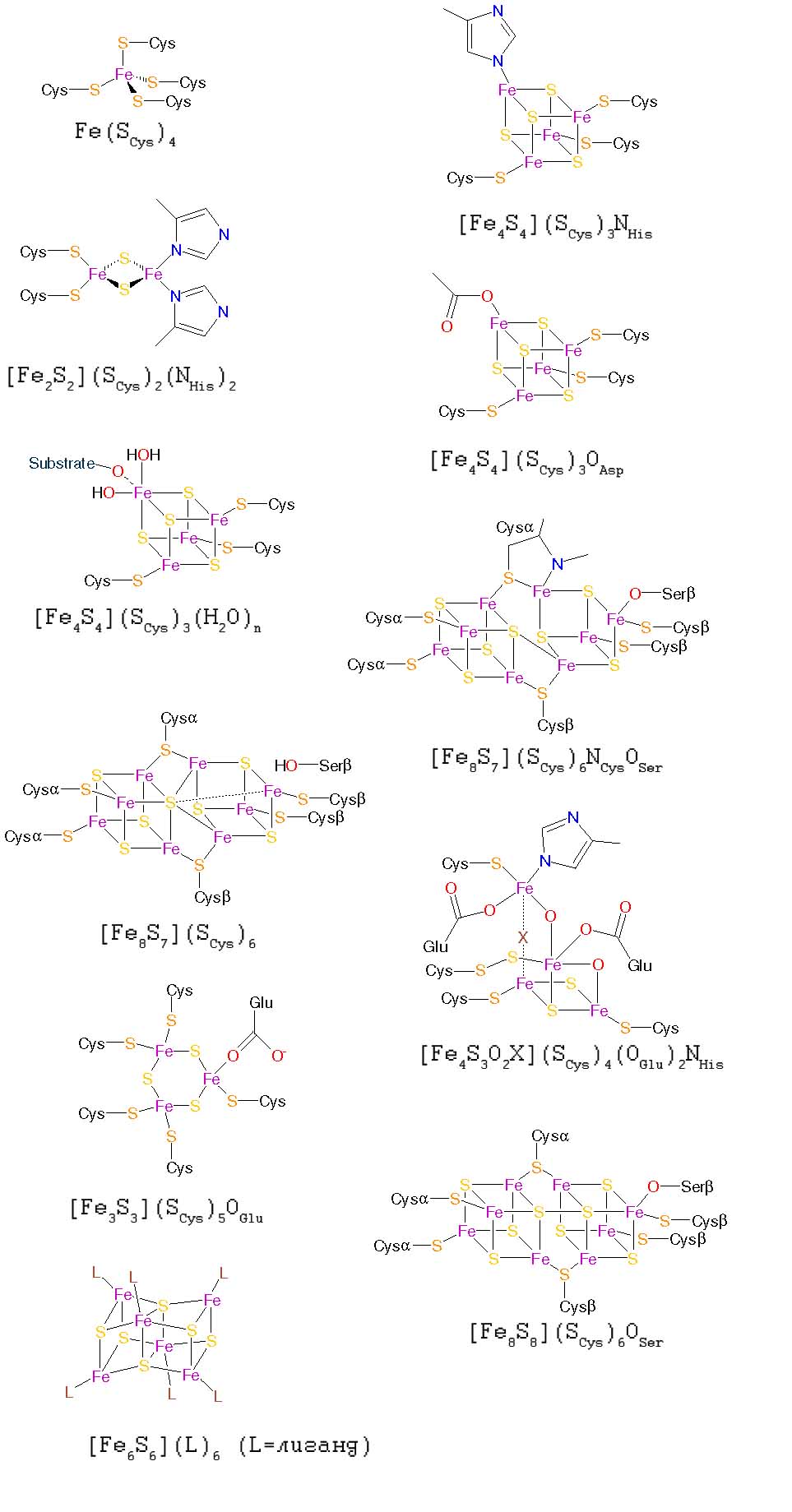
Рис. 2. Другие железо-серные кластеры. Рисунки адаптированы из
Таким образом, выше было продемонстрировано большое разнообразие природных FeS-кластеров, которое, кроме того, может быть дополнено их синтетическими аналогами, получение первого из которых - (Et4N)2Fe4S4(SCH2Ph)4- было описано ещё в 1972 году [Herskovitz T. et al. 1972]. Это разнообразие свидетельствует о большой потенциальной возможности формирования FeS-кластеров с различными структурами и функциями.
Роль FeS-белков в современных организмах и их катализ предположительно древнейших биохимических реакций.
В настоящее время описано FeS- и (Fe,Ni)S-белки присутствуют во всех организмах и катализируют необычайно большой спектр важнейших биохимических реакцй, связанных с переносом электронов, поддержкой структурной целостности молекул белков, биосенсорные функции в отношении окислительного стресса, регуляция экспрессии генов в зависимости от окислительно-восстановительного потенциала в клетках, транспорт кислорода, фотосинтез и фиксация азота [Rounault T.A., Dlausner R.D. 1996; Zheng M., Storz G. 2000]. Примечательно, что железо-серные кластеры обнаруживаются даже в РНК-полимеразе
Особенно важным фактом в связи с рассматриваемой темой является тот факт, что FeS-белки являются катализаторами тех химических реакций метаболизма клеток, которые могут рассматриваться как древнейшие. Это в первую очередь касается реакций связанных с окислительно-восстановительными реакциями в так называемом промежуточном метаболизме (cм. "Реликтовые составляющие современного метаболизма. С чего он мог начаться?"), особенно с теми, которые связаны с реакциями фиксации углерода - ацетил-коэнзимного пути и восстановительного цикла трикарбоновых кислот (ВЦТК).
Рассмотрим подробнее роль FeS-белков в ВЦТК (рис. 3):
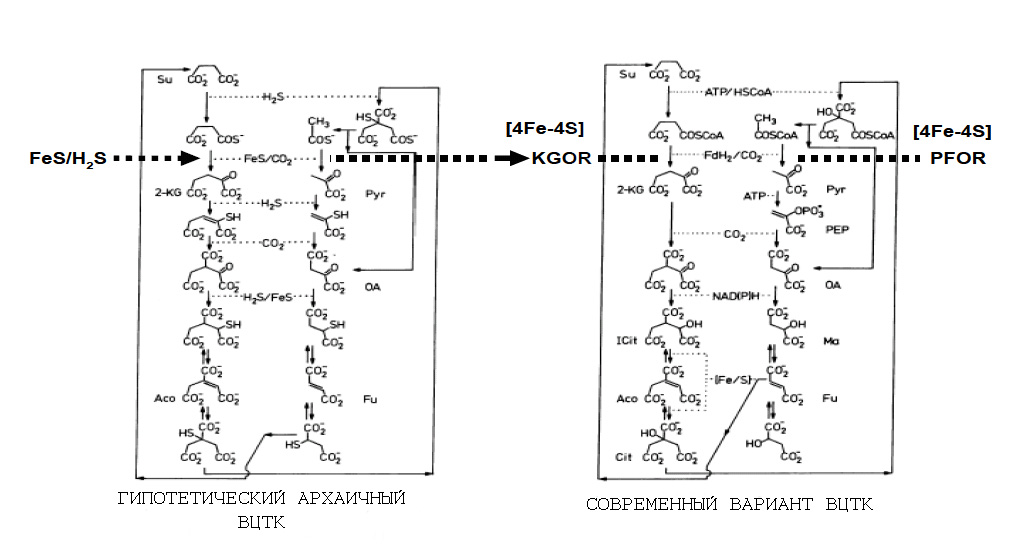
Рис. 3. Роль FeS-белков в современном ВЦТК и гипотетическая роль минеральных аналогов этих белков на начальных стадиях формирования метаболизма.
Обозначения: Su - сукцинат, 2-KG - 2-кетоглутарат, Pyr - пируват, OA - оксалоацетат, Aco - аконитат, Fu - фумарат, Ma - малат, KGOR - 2-кетоглутаратоксидоредуктаза, PFOR - пируватоксидоредуктаза.
Рисунок адаптирован из [Bilder P.V. 2005].
Как уже описывалось в статье Автотрофное термофильное происхождение жизни, критическими биосинтетическими реакциями, которые требуют поглощения свободной энергии в ВЦТК являются две: карбоксилирование 2-кетоглутарата, катализируемое 2-кетоглутатоксидоредуктазой (KGOR) и карбоксилирование пирувата, катализируемое пируватоксидоредуктазой (PFOR).
Примечательно, что обе этих критических реакции катализируются ферментами, активные центры которых представляют собой FeS-домены [Kerscher L. Oesterhelt D. 1981].
Однако роль FeS-белков не ограничивается катализом только этих реакций ВЦТК.
Так, хорошо известно, что три интермедиата цикла Кребса - цитрат, цис-аконитат и изоцитрат - находятся в равновесном состоянии и их обратимое превращение катализируется актинотазой (см. рис. 4).
Ключевую роль в этом катализе опять же выполняют железо-серные кластеры Fe3S4:
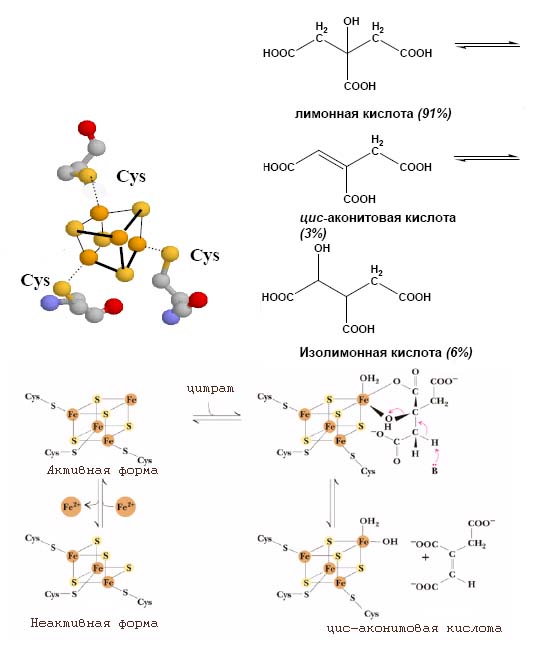
Рис. 4. Роль Fe3S4-кластера в обратимом превращении цитрата в изоцитрат. Данный железо-серный кластер входит в состав фермента аконитазы. Рисунок адаптирован
Наличие в активном центре такого рода неорганических компонентов может быть интерпретировано как реликтовый след, происхождения такого рода ферментов из неорганических аналогов - кристаллов грейгита, макинавита и др. Впервые предположение о древней родословной ферредоксинов было выдвинуто в конце 60-х-начале 70-х годов прошлого века [Eck R.V., Dayhoff M.O. 1966; Hall, D.O. et al. 1971; Wickramasinghe R.H. 1972]. В это же время было выдвинуто предположение о нерганическом источнике пирофосфатных групп современных биомолекул [Baltscheffsky, M. et al. 1966, 1999].
Примечательно, что из элементов переходной группы железо было наиболее доступным металлом для биохимических реакций на ранней Земле. Именно этим фактом можно объяснить почти универсальную роль железа в биохимии клетки всех доменов живого.
Если предполагать, что жизнь возникла в термофильных условиях (см. Автотрофное термофильное происхождение жизни), то с этой точки зрения примечателен тот факт, что известны ферредоксины, устойчивые к длительному нагреванию, как, например, в термофильной архее Pyrococcus furiosus, из которой был выделен исключительно термостабильный ферредоксин, способный сохранять свою активность даже после 12-часовой инкубации при 950С.
На потенциальную древность этого типа редуктазы (редуктазами называют ферменты, участвующие в окислительно-восстановительных реакциях) указывает также тот факт, что сложные FeS-кластеры ферредоксинов участвуют как раз в таких окислительно-восстановительных реакциях, которые связаны с изменением степени окисления в неорганических веществах - углекислого газа, окиси углерода, молекулярного водорода и азота.
Сходство активных центров (FeS) и (Fe,Ni)S-белков с некоторыми минеральными кристаллами.
Сравним структуры известных из геохимии кристаллов, содержащих железо и серы с примесями других металлов со структурой активных центров железо-серных белков.
Для наглядности это сравнение приведено на рис. 5.
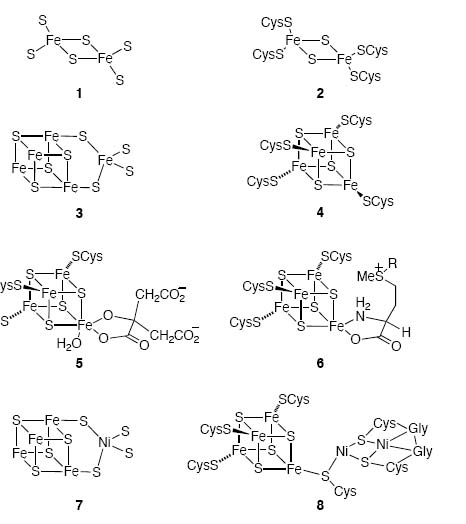
Рис. 5. Железо-серные минералы и каталитические биохимические кластеры. 1. Субструктура макинавита. 2. Электронно-транспортный кластер [2Fe,2S]. 3. Субструктура грейгита. 4. Электронно-транспортный кластер [4Fe,4S]. 5. Кислотно-основной катализатор (аконитаза с цитраной связью). 6. Кластер, генерирующий радикалы с S-аденозил-L-метиониновой связью (R - аденозил). 7. Фиксирующий углерод кластер ACS (см. подробнее об этой реакции ниже в статье).
Из рисунка 4 наглядно видно, во-первых, структурное сходство макинавита с электронно-транспортным кластером [2Fe,2S]. Во-вторых, сходство грейгита со структурой СО-связывающего кластера ацетил-коэнзим А-синтазы - ключевого фермента в предположительно древнейшем и одном из наиболее простых способов фиксации углерода.
Что немаловажно для нашего дальнейшего рассмотрения, на рис. 4 (5) продемонстрирована возможность связывания железо-серного кластера с продуктами промежуточного метаболизма (цитрата) с образованием активного центра фермента, что даёт основание предполагать о возможности функционирования в качестве ферментов такого рода структур ещё на стадии до появления белков с использованием в качестве дополнительных стурктур для железо-серных кластеров только продуктов первых автокаталитических циклов (наподобие архаичных вариантов ВЦТК).
И, наконец, можно увидеть, что металло-серные кластеры способны также взаимодействовать с рибонуклеотидными компонентами, а, значит, принимать непосредственное участие в катализе метаболических реакций предположительно более поздно (по сравнению с первыми циклами промежуточногоо метаболизма) возникших рибонуклеотидных метаболических сетей.
Образование минеральных кристаллов в щелочных гидротермах, которые могли служить прообразами активных центров будущих ферментов.
При выходе двухвалентного железа из гидротерм преимущественно образуются кристаллы макинавита, представляющего собой двумерный полупроводник со слоистой структурой общей формулой Fe1+XS [Rickard D. and Luther III G. W. 2007]:
Fe2+ + HS- + OH- → FeS + H2O
Именно нанокристаллы макинавита (Fe(Ni,Co)1+xS) могли вызвать образование мембранных структур в щелочных гидротермах, которые предотвращали смешивание просачивающихся щелочных и водород-несущих вод из гидротерм и подкисленного океана. Сам маинавит способен окисляться.
Его окисление приводит, в частности к образованию грейгита:
4FeS (макинавит) → Fe3S4 (грейгит) + Fe(II) + 2e-
Другими минорными сульфидными кластерами, которые также абиогенно образуются на железо-серных мембраная являлся грейгит (другое название - мельниковит) - [Fe4S4][SFeS]2 [Vaughan D.J, Craig J.R. 1978] и виоларит ([Fe2Ni2S4][SNiS]2), которые также должны были сыграть ключевую роль в катализе реакций архаичного метаболизма.
Если в макинавите железо имеет тетрагональное окружение, то в других железо-серных минералах у части атомов железа оно меняется. В грейгите часть железных центров имеют уже октаэдрическое окружение.
О возможной роли грейгита в архаичном метаболизме, свидетельствует прежде всего тот факт, что кубическая единица грейгита Fe4S4, характерна для ряда ферредоксинов (рис. 6), имеющих отношение как к ВЦТК, так и к ацетил-коэнзимному пути, то есть гипотетически к наиболее древним метаболическим путям.
Виоларит, который можно получить замещением железа на никель, имеет существенное сходство с Fe-Ni-S-содержащеми так называемыми А и С-кластерами ключевого бифункционального фермента CODH/ACS в ацетил-коэнзимном пути (обсуждение см. ниже).
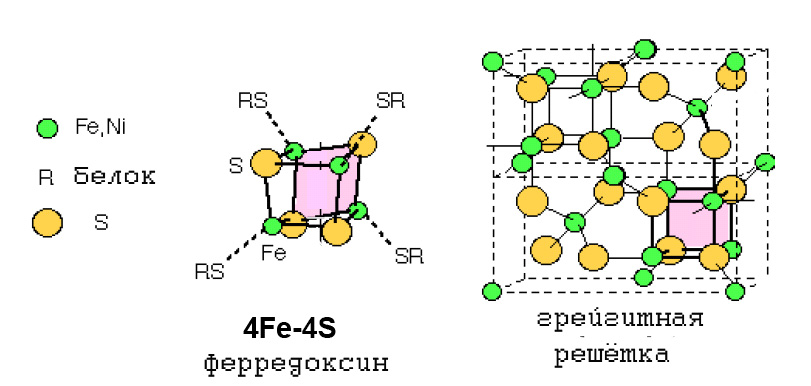
Рис. 6. Сходство тиокубанового кластера 4Fe-4S-ферредоксина с кубановым кластером 4Fe-4S минерала грейгита.
Рассматриваемый исходный гипотетический архаичный катализ следует отнести к гетерогенному катализу, так как он происходит на границе двух фаз - твёрдой и жидкой. Однако с захватом металлокластеров лигандами этот вид катализа уже можно рассматривать как микрогетерогенный, так как фактически он становится присущ коллоидным частицам (катализ белками тоже относится к микрогетерогенному). Его сходство с гетерогенным заключается в том, что имеет место адсорбция как в гетерогенных системах. Однако такой вид катализа сходен и с гомогенным, так как реакции катализируются в растворе.Не исключена также возможность и гомогенного катализа, осуществляемый растворёнными координационными соединениями.
FeS-компартменты как структуры, на которых был сопряжён процесс образования активируемого водорода, протонного градиента и восстановления FeIII.
На наиболее ранних этапах возникновения жизни отсутствовали такие источники активированного водорода, сопряжённые с процессами окисления-восстановления, как NADH, NADPH, FADH2 и другие. Поэтому Рассел с соавторами предположили, что должны были существовать более примитивные минеральные аналоги активированного водорода, образование которого было бы сопряжено с процессами окисления-восстановления железа. С одной стороны образованные FeS-компартменты были непротицаемы для анионов, а с другой - именно на них мог переноситься молекулярный водород в виде протона и атомарного водорода, причём этот процесс должен быть сопряжён с процессом передачи фотолитически окисленного железа Fe(III).
В условиях кислого океана и УФ-облучения поверхности Земли Fe(III) образовывался в результате окисления Fe(II) на поверхности океана:
2Fe2+ + 2H+ + hν → 2FeIII + H2↑.
Образованный в результате этого процесса молекулярный водород постепенно уходил в космос, тогда как Fe(III) в результате рециркуляции Fe(III) оказывался в районе FeS, компартментов, связанных с зарождавшимся архаичным метаболизмом, и мог служить важнейшим акцептором электронов. Другим возможным кандидатом на роль акцепторов электронов мог быть диоксид углерода (угольная кислота).
Процесс сопряжения переноса активированного водорода и протона наружу за пределы FeS-компартмента и передачи электрона фотолитически окисленному Fe(III) изображён на рис. 7. Этот процесс должен был иметь двоякие последствия.
С одной стороны перенос протонов наружу должен был повышать протонный градиент с разностью потенциалов до половины вольта [Russell M.J., Hall A.J.1997, 2002; Filtness M.J. et al. 2003].
С другой стороны активированный водород - это важнейший источинк для синтеза органических соединений и фиксации неорганического углерода, в результате которого могли бы образовываться углеводы с общей формулой (CH2O)n:
2nH. + nCO → (CH2O)n
4nH. + nCO2 → (CH2O)n + nH2O
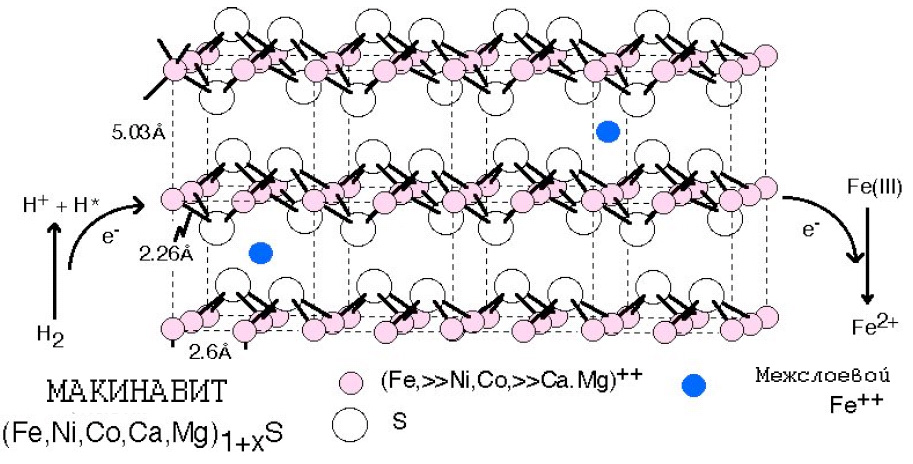
Рис. 7. Макинавит, как изначальный прообраз активного центра протоферредоксинов, как агентов переноса и потребления энергии. Макинавит может действовать как переносчик электронов, обеспечивая хемоосмос. Fe3+ действует как акцептор электронов. Рисунок адаптирован из [Russell M.J. et al. 2003]
Таким образом, суммарное уравнение этого гипотетического процесса сопряжения образования активированного водорода и процесса окисления водорода и окисления железа может быть представлено в следующем виде:
H2 + Fe(III) → H. + H+ + Fe2+
В рассматриваемой модели такого рода железо-серные минеральные плёнки аналогичны по своему действию внутренней мембране митохондрий, в которой макинавитная фаза действует как полупроницаемый барьер, поддерживающий электрохимический градиент между кисой водной фазой океана и щелочной внутри железо-серных минеральных компартментов в щелочных гидротермах.
(Де)гидрогеназная активность металло-серных минераллов как непременный компонент архаичного метаболизма.
Ряд фактов, дают основание предполагать, что металлосерные минералы, обеспечившие перенос электронов, могли быть сопряжены не только с созданием и поддержкой протонного потенциала в древних минеральных компартментах а также гипотетической минеральной фиксацией углерода самой по себе. Но, и что немаловажно, предположительно могли обеспечивать (де)гидрогеназную активность, столь важную для фиксации углерода.
На рис. 6 схематически приведён пример работы (де)гидрогеназ. Гидрогеназы могут рассматриваться как первые ферменты не только потому, что они широко представлены в мире прокариот, но и также потому, что они являются ключевыми ферментами в предположительно древнейшем метаболическом пути Вуда-Люнгдала (см. Реликтовые составляющие современного метаболизма. С чего он мог начаться? ). Хотя в настоящее время не продемонстрирована возможность работы чисто минеральных комплексов в качестве (де)гидрогеназ, однако данное предположение выглядит очень правдоподобным не только потому, что этот способ разложения молекулярного водорода с помощью Fe-Ni-кластеров, но и также то, что аналогичное разложение возможно также чисто синтетическими аналогами этих кластеров, в которых вместо железа присутствует рутений (
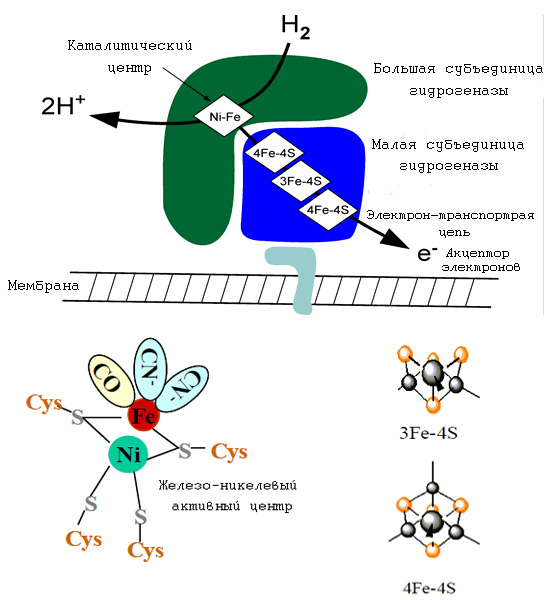
Рис. 8. Схема работы современных FeNi-гидрогеназ.Железо-никелевый кластер в ферредоксине действует как электроннотранспортный агент через переключение двух форм железа Fe(2+/3+). Гидрогеназа катализирует реакцию H2 ↔ 2H+ + 2e-. Наиболее детальные данные были получены на примере гидрогеназы Desulfovibrio gigas. Примечательно, что в железо-никлевом активном центре присутствуют такие лиганды, как моноксид углерода и CN--ионы. Первые ЖС подобно многим современным бактериям могли бы использовать молекулярный водород в качестве источника энергии за счёт разложения молекулы водорода на два протона и два электрона. Рисунок адаптирован из "Hydrogen as a Fuel: Learning from nature".
В одном из кандидатов на древнейший способ фиксации углерода - ацетилкоэнзимном пути - кроме сравнительной простоты самого цикла крайне интересным оказалась неорганическая часть ключевых ферментов, участвующих в данном цикле, структура которых хорошо описана в геологии, но менее известна в биохимии. Она оказалась сходной с таковой для так называемой четверти структуры минерала грейгита, имеющего структуру Fe3+Fe2+2S4, а в активном центре рассматриваемых ферментов один атом трёхвалентного железа замещён никелем - (SNiS)(Fe4S4)(SFeS) (рис. 8, 9).
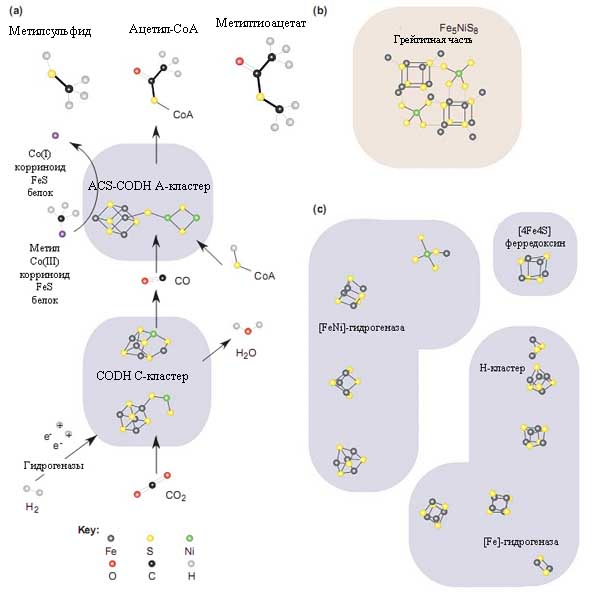
Рис. 9. Структурное сходство между [FeNi]S-центрами и минералами в ферментном комплексе, катализирующем простейший из известных способов фиксации углерода в ацетил-коэнзимном пути.
а) Упрощённое изображение реакций, катализируемых моноксид дегидрогеназой (CODH) и ацетил-коэнзим А-синтазой (ACS). Точный механизм работы ACS неизвестен. Тёмным цветом схематически оттенены контуры белков. Также представлены структуры метилсульфида, образованного из H2S и CO2 через катализ FeS и метилтиоацетата, который синтезируется из СО и метилсульфида через NiS FeS-катализ. Рисунок взят из [Russell M.J., Martin W. 2004] с небольшими изменениями.
Интересным можно также считать присутствие никеля в активном центре фермента. Этот металл обнаруживается в железных метиоритах, и занимает второе место по распространённости металлов на Земле, а в условиях древней Земли его содержание на поверхности Земли могло быть ещё выше. Подобно железо-серным кластерам, никель в составе ферментов катализирует реакции с неорганическими веществами: молекулярным водородом, азотом, окисью углерода и углекислым газом, которые, как уже указывалось выше, составляли значительную часть ранней атмосферы Земли. Высокое содержание Ni в железных метеоритах указывает на первичные условия становления жизни и на древность Ni-ферментов.
Какие реакции могли служить прообразами современного пути Вуда-Люнгдала в фиксации углерода.
Хорошим кандидатом на этот прообраз может служить реакция, экспериментально открытая C. Хубером и Г.Вехтерхойзером [Huber C., Wächtershäuser G. 1997]. Они обнаружили, что в присутствии 1 мМ NiS и 1 мМ FeS при 1000С в широком диапазоне pH п ротекает реакция, очень напоминающая таковую для пути Вуда-Люнгдала:
CH3SH + CO + H2O → CH3CO2H + H2S,
(вспомним, что суммарное уравнение ацетилкоэнзимного пути 4H2 + 2CO2 + HSCoA = CH3COSCoA + 3H2O).
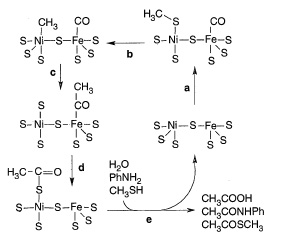
Рис. 10. Гипотетический механизм формирования CO иCH3SH на NiS-FeS, предложенный C. Хубером и Г.Вехтерхойзером [ Huber C., Wächtershäuser G. 1997]. (a) СО связывает Fe-центр, а CH3SH Ni-центр. (b) Формирование метил-Ni-центра. (c) Метильная группа мигрирует на карбонильную группу (d) Ацентильная группа мигрирует на сульфгидридную группу с формированием тиоацетатного лиганда на Ni (или Fe). (e) Гидролиз тиоацетатного лиганда формирует уксусную кислоту.
Таким образом, полученные данные позволяют говорить о сходстве результатов катализа (Fe,Ni)S-кластеров в опытах Хубера и Вехтерхойзера и Fe4NiS5 ‘C-кластера’ СО-дегидрогеназы (CODH) в ацетил-коэнзимном пути.
Эволюция лигаднов для металло-серных катализаторов.
В рассматриваемой модели мы изначально рассматривали только чисто минеральные составляющие FeS-компартментов, тогда как в современных живых организмах эти компартменты связаны с молекулами белка.
Конечно эти чисто неорганические составляющие могли связываться и с простейшими органическими молекулами, которые могли синтезироваться в районах гидротермалей.
Один из таких вариантов сам собой напрашивается из возможности абиогенного синтеза органических сульфидов из абиогенно синтезируемых ацетатов:
CH3COOH + H2S ↔ CH3COSH + H2O .
Чем хороши органические сульфиды по сранению с неорганическими? Они предоставляют более окисленный вариант серы, что обеспечивает лучший катализ в окислительно-восстановительных реакциях. Органические лиганды типа CH3COS- (или в общем случае SR−) дали возможность изолировать из макинавита и грейгита вполне определённые группы кластеров, такие, как [Fe2S2]+/0 или [Fe4S4]2+/+ с образованием иона протоферредоксина [Fe4S4][SR]42−/3− [Bonomi F. et al. 1985]. Вполне возможно, что поскольку в грейгите и виоларите железо является более окисленным по сравнению с железом в макинавите, то тиокубановые формы грейгита и виоларита возникли как раз в результате такого рода изоляции органическими тиолами или же другими малыми органическими молекулами (было экспериментально показана возможность связывания железо-серными соединениями в качестве лигандов меркаптанов и тиофенолов [Bonomi F. et al. 1985]).
Здесь нужно обратить внимание, что малые органические молекулы (тиолы, цитраты, оксалаты, малонаты и др.), изолировавшие металло-серные кластеры или же отдельные ионы переходных металлов сами впоследствии были замещены цистеиновыми группами пептидов. Однако на начальных статдиях образования ЖС цистеин не мог относиться к абиогенно синтезируемым аминокислотам, которые бы присутствовали в заметных количествах [Hennet R.J.C. et al. 1992].
Вновь появлявшиеся лиганды, фактически изменяли ферментативный статус первых ЖС: позволяли его обогащать и благодаря обратной связи с катализируемыми металло-серными кластерами последовательностей реакций их наработка закреплялась во вновь появлявшихся метаболических циклах [Neaman A. et al. 2005; Morowitz H. J. et al. 2010].
Важно отметить ещё одну ключевую роль так называемых низкомолекулярных органических кислот: они способствуют переходу ионов переходных металлов из твёрдой фазы в водный раствор в виде настоящего или коллоидного раствора.
Этот факт означает, что появлявшиеся de novo никзомолекулярные органические кислоты способствовали появлению в минеральных компартментах новых координационных соединений, таких, например, как цитрат железа:
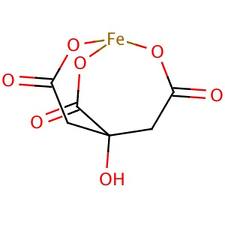
Рис. 11. Цитрат железа. Цитрат-ионы являются лигандами.
Факт растворения переходных металлов в виде ионов под действием низкомолекулярных оранических кислот (ligand controlled dissolution) таких, как лимонная, яблочная, уксусная, щавелевоуксусная и др. показан экспериментально [Neaman A., Chorover J., Brantley S. 2006]. Примечательно, что эти вещества являются интермедиатами промежуточного метаболизма, в первую очередь ВЦТК.
Появление новых продуктов и интермедиатов в метаболических циклах давала возможность расширять спектр синтезируемых веществ (см. рис.10).
Так, сами тиоацетатные лигадны являлись ключевыми не только для формирования протоферердоксинов, но и как реагенты для принципиально новых типов реакций, таких, как простейшей фиксации углерода, сходным с таковым в пути Вуда-Люнгдала.
Другой пример - появление кетокислот создало предпосылки для возникновения биосинтеза аминокислот и пептидов как новых типов лигаднов.
Итак, ключевым базовым утвреждением является постулирование того, что реакции метаболических сетях, которые и представляли собой первые ЖС, катализировались преимущественно минералами, хотя безусловно большую роль должны были играть те органические молекулы, которые с одной стороны синтезировались или абиогенно, или же, что очень важно, синтезировались уже в самих этих автотрофных метаболических сетях. Автокаталитичность реакций архаичного метаболизма таким образом, была обеспечена с одной стороны тем, что продукты в циклах накапливались (так как был процесс связывания, а не выделения СО2), а с другой стороны - тем, что многие органические молекулы, синтезируемые в этих циклах уже сами становились частью катализаторов этих циклов, причём в первую очередь как лиганды для минералов.
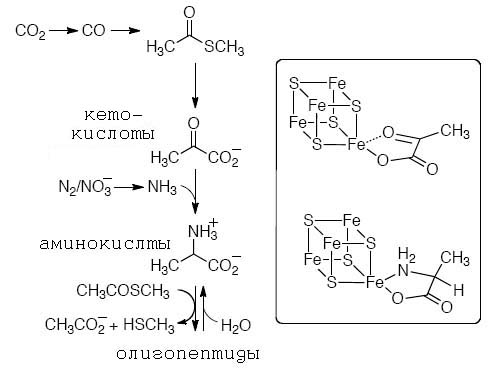
Рис. 12. Последовательная генерация коровых (ключевых) протометаболитов и связанная сней смена лигандов для металлосерных кластеров.
В настоящее время трудно сказать, на каком этапе в метаболизм включились аминокислоты - на стадии их абиогенного синтеза (тогда в первую очередь очень простых - аланина и (или) глицина) или же на стадии, когда их синтез обеспечивался первыми метаболическими циклами.
Однако с появлением аминокислот в метаболизме, они должны были также играть роль новых лигандов (см. рис. 12). Аминокислотные лиганды хорошо описаны в литературе. Когда в роли лигандов выступают отдельные аминокислоты, образуются так называемые «аминокислотные хелаты металлов». Если лигандами становятся аминокислоты и короткие пептиды, говорят о формировании «протеинатов металлов».
Формирование пептидных гнёзд - финальная стадия формирования FeS-белковых ферментов.
Вообще гнёздами называются несколько последовательных аминокислотных остатков в пептиде (3-6), имеющих аминогруппы в радикалах и способных связываться с анионами. В среднем 8% остатков белков являются гнёздами [Milner-White E.J., Russell M.J. 2005]. Гнёзда являются ключевыми частями ряда фосфат-связывающих сайтов. Так называемая P-петля, являющаяся АТP и (или) GТP-связывающим доменом в белке, относится к гнёздам.
Потенциально две структуры вовлечены в процесс универсального применения энергии - фосфаты (как прообраз АТР) и железо-серные кластеры (как прообразы ферментов, обеспечивающих перенос электронов и протонов). Как фосфаты, так и железо-серные комплексы могут присутствовать в виде осадков в гидротермальных источниках при умеренных температурах и являться ключевыми компонентами первых ЖС. Как фосфаты (например, P2O73-, так и тиолированные железо(никелевые)-серные кластеры, например, [Fe4S4][СH3S]42−, являются анионами. Поэтому они способны связываться с положительно заряженными аминогруппами пептидов, образуя комплексы.
Образование такого рода гнёзд могло предотвращать растворение и распад, а также нуклеацию (образование центров кристаллизации) и саму кристаллизацию металло-серных комплексов
Образование конформации гнезда облегчается высокой концентрацией аминокилсот глицина и аланина. Этот факт является нетривиальным, если учитывать, что именно эти две аминокислоты должны быть наиболее распространёнными из абиогенно синтезируемых аминокислот. Гнезда предположительно являлись непременными компонентами пептидов, погружённых в первые мембраны (не обязательно билипидные).
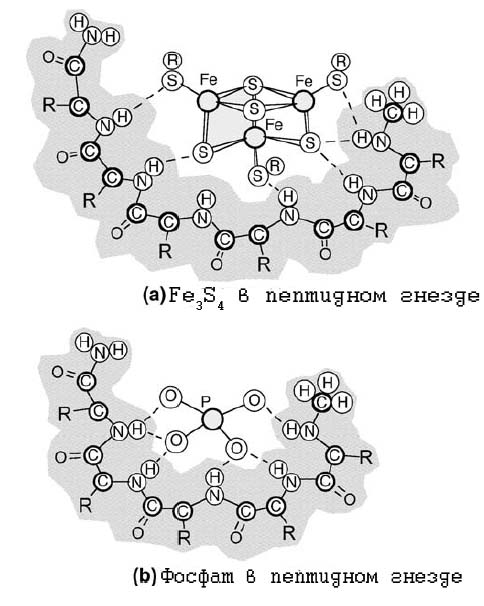
Рис. 13. Пептиные гнёзда для железо-серных комплексов (a) и фосфатов (b).
Таким образом, можно сказать, что в процессе биогенеза в качестве катализаторов в ЖС играли три группы веществ, последовательно возникшие друг за другом: металло-серные катализаторы (в том числе с различными лигандами), рибозимы и белки. Если рибозимы и белки сохранились в современных организмах, то металло-серные катализаторы непосредственно в них не встречаются, но их след сохранился в виде металло-серных (в первую очередь в виде железо-серных) белков.
Резюме.
1. Если рассматоривать первые ЖС как (в первую очередь циклические) химические реакции, протекавшие в изолированных FeS-ячейках, сформированных в гидротермах, то сами различные FeS-минералы с примесями других металлов (Ni, Zn и др.) могли являться ключевыми катализаторами, обеспечивавшими протекание такого рода циклических химических реакций.
2. Первые металло-серные катализаторы могли осуществлять гетерогенный катализ на поверхности раздела фаз - металло-серные (в первую очередь железо-серные) осадки - раствор железо-серных компартментов.
Однако низкомолекулярные органические молекулы, такие, как уксусная, лимонная, яблочная, щавелевоуксусная и др. кислоты, обеспечили частичное растворение твёрдых металло-серных осадков и переход их в виде координационных соединений в настоящий или коллоидных раствор, служивший как принципиально новые типы катализаторов.
3. Особенно важную роль среди этих химических реакций играли прообразы современных ВЦТК и пути Вуда-Люндгала, в которых FeS- и Fe-NiS-кристаллы играли ключевую роль в катализе реакций, ставшими основой универсального предкового метаболического комплекса (universal ancestral metabolic complex, UAMC).
4. Ключевую роль FeS и FeNiS-катализаторы стали играть в поддержании протонного потенциала, который непосредственно стал использоваться как универсальная энергетическая валюта в первых ЖС.
5. Существенное расширение диапазона возможных минеральных катализаторов (протоферментов) произошло благодаря использованию во-первых, новых органических лигандов, синтезируемых абигоненно или ставших одними из продуктов предкового метаболизма, а, во-вторых, "изоляции" этих кристаллов в пептидных "гнёздах", обеспечивших значительное расширение спектра и специфичности катализируемых химических реакций. Синтез этих коротких пептидов мог происходить как абиогенно, так и контролироваться (то есть находится в обратной связи) с протеканием архаичных реакций промежуточного метаболизма.
6. Автокаталитичность реакций архаичного метаболизма таким образом, была обеспечена с одной стороны тем, что продукты в циклах накапливались (так как был процесс связывания, а не выделения СО2), а с другой стороны - тем, что многие органические молекулы, синтезируемые в этих циклах уже сами становились частью катализаторов этих циклов, причём в первую очередь как лиганды для минералов.
Справочные данные.
Гидрогеназа - ключевой фермент метаболизма водорода, катализирующий обратимую активацию молекулярного водорода. По содержанию металлов в активном центре различают три типа гидрогеназ: NiFe-, Fe- и так называемые V-гидрогеназы, не содержащие никель и железосерных кластеров. Все типы гидрогеназ различаются по каталитическим свойствам и специфичности к разным донорам/акцепторам электронов. В нашем рассмотрении как наиболее древний инетересны в первую очеред железо-никелевые гидрогеназы.
Ba((Mn4+), (Mn2+))8O16 Повращать эту пространственную структуру можно здесь Широко известная фаза голландита или BaMn8O16 является одним из наиболее ярких и известных примеров соединений со специфической туннельной структурой, обуславливающей возможность ее использования как твердого электролита «молекулярного сита»
Координационное соединение - соединение, содержащее группу ионов или нейтральных молекул (лигандов), в определённом порядке размещённых (координированных) вокруг центрального атома(комплексообразовалтеля, в основном ионов металлов) по вершинам так называемого координационного полиэдра.
Координационный полиэдр – геометрическая фигура, представляющая собой многогранник и определяющая расположение донорных атомов лиганда вокруг центрального атома. Количество вершин координационного полиэдра равно координационному числу.
Кристаллит - монокристалл, не имеющий характерной кристаллич. огранки. К К. относят дендриты, зёрна кристаллические металлич. слитков, горных пород, минералов и т. д.
Лиганд - в биохимии является вещсвтвом, которое в состоянии связать и сформировать комплекс с биомолекулой и выполнить какую-то биологическую функцию. В химии - молекула, ион или группа атомов, соединённые с помощью координационных химических связе с атомом или ионом металла.
Протоферредоксин - железо-серный кластер в ферредоксине вместе с аминокислотными или другими лигандами. Сингония (от греч. syn - вместе и gonia - угол) - классификационное подразделение кристаллов по признаку симметрии элементарной ячейки кристалла, характеризуется соотношениями между ее ребрами и углами. Существует 7 сингоний: кубическая, гексагональная, тетрагональная, тригональная, ромбическая, моноклинная, триклинная.
Простетическая группа — небелковый (и не производный от аминокислот) компонент, связанный с белком, который выполняет важную роль в биологической активности соответствующего белка.
Простетические группы — это подкласс кофакторов. Они отличаются от коферментов тем, что простетические группы постоянно связаны с ферментами, в то время как коферменты связаны с ферментами непостоянно.
Ферредоксины (Fd) - железо-серные белки, которые обеспечивают перенос электронов в метаболических реакциях.
Элементарная (примитивная) ячейка кристалла - минимальный воображаемый объём кристалла, параллельные переносы (трансляции) которого в трёх измерениях позволяют построить трёхмерную кристаллическую решётку в целом. Классифицируются на основе так называемой с помощью трёх базисных векторов и углов между ними.
Литература
На
Baltscheffsky M., Schultz A., Baltscheffsky H.: H+-PPases: a tightly membrane-bound family. // FEBS Letters. 1999. V.457. P.527–533.
Baltscheffsky M., von Stedingk L-V., Heldt H-W., Klingenberg M.: Inorganic Pyrophosphate; Formation in Bacterial Photophosphorylation // Science.1966. V.153. P.1120–1122.
Bilder P.V.
Bonomi F.,Werth M.T., Kurtz, D.M.: 1985, Assembly of FenSn(SR)2−(n=2,4) in Aqueous Media from Iron Salts, Thiols and Sulfur, Sulfide, Thiosulfide Plus Rhodonase, Inorganic Chemistry 24, 4331–4335.
Eck R.V., Dayhoff M.O. Evolution of the structure of ferredoxin based on living relics of primitive amino acid sequences. // Science 1966. V.152. P.363–366.
Filtness M.J., Butler I.B., Rickard D.: 2003, The origin of life: the properties of iron sulphide membranes. Applied Earth Science (Trans. Inst. Min. Metall.) 112B, P.171–172.
Fontecave M. Iron-sulfur clusters: ever-expanding roles. // Nat Chem Biol. 2006. V.2. P.171-174
Hall D.O., Cammack R., Rao K.K. Role for Ferredoxins in the Origin of Life and Biological Evolution. // Nature. 1971. V.233. P.136–138.
Herskovitz T., Averill B.A., Holm R.H., Ibers J.A., Phillips W.D. and J. F. Weiher J.F. Structure and Properties of a Synthetic Analogue of Bacterial Iron-Sulfur Proteins. // Proc.Natl. Acad. Sci. USA 1972. V.69. P.2437–2441.
Huber C., Wächtershäuser G. Activated Acetic Acid by Carbon Fixation on (Fe,Ni)S Under Primordial Conditions. // Science. 1997. V.276. P.245-247.
Hydrogen as a Fuel: Learning from nature. (2001). (Eds. Richard Cammack, Michel Frey and Robert Robson). Taylor and Francis Press, London and New York.
Kalyvas C.
Kerscher L., Oesterhelt D. The catalytic mechanism of 2-oxoacid:ferredoxin oxidoreductases from Halobacterium halobium. One-electron transfer at two distinct steps of the catalytic cycle. // Eur J Biochem 1981. V.116. P.595-600.
Milner-White E.J., Russell M.J.
Morowitz H. J., Srinivasan V., Smith, E.
Neaman A., Chorover J., Brantley S. 2006. Effects of organic ligands on granite dissolution in batch experiments at pH 6. // Am. J. Sci. V.306. P.451-473.
Neaman A., Chorover J., Brantley S. (2005) Implications of the Evolution of Organic Acid Moieties for Basalt Weathering Over Geological Time. // Am J Sci. 2005. V.305. P.147 - 185.
Pierre J.L., and Gautier-Luneau I. 2000 Iron and citric acid: a fuzzy chemistry of ubiquitous biological relevance, Biometals, 13, 91–96.
Rickard D. and Luther III G. W. Chemistry of iron sulfides. // Chemical Reviews. 2007. V.107. P.514-562.
Rounault T.A., Dlausner R.D. Iron-sulfur clusters as biosensors of oxidants and iron // TiBS. 1996. V. 21. P.174-177.
Russell M.J., Hall, A.J., Mellersh A.R. 2 On the dissipation of thermal and chemical energies on the early Earth: The onsets of hydrothermal convection, chemiosmosis, genetically regulated metabolism and oxygenic photosynthesis, in Ikan, R., ed., Natural and Laboratory-Simulated Thermal Geochemical Processes: Dordrecht, Kluwer Academic Publishers, 2003. P.325-388.
Russell M.J., Hall A.J. The emergence of life from iron monosulphide bubbles at a submarine hydrothermal redox and pH
front. // J. Geol. Soc. (London) 1997. V.154. P.377–402.
Russell M.J., Hall A.J. From geochemistry to biochemistry: Chemiosmotic coupling and transition element clusters in the onset of life and photosynthesis // The Geochemical News. 2002. V.113. P.6-12.
Vaughan D.J. Craig J.R. Mineral Chemistry of Natural Sulfides, Cambridge University Press, Cambridge,1978. P.493.
Wickramasinghe R.H. Iron-sulphur proteins: their possible place in the origin of life and the development of early metabolic systems. // Space Life Sci. 1973. V.4. P.341-352.
Zheng M., Storz G. Redox sensing by prokaryotic tranion factors // Biochem. Pharmacol. 2000. V. 59. P.1–6.
Статьи, связанные с темой.
Автотрофное термофильное происхождение жизни
Как мог выглядеть архаичный метаболизм?
Реликтовые составляющие современного метаболизма. С чего он мог начаться?
Список публикаций >>