Решил, что будет интересна серия статей, посвящённых происхождению генетического кода. Начинаю с наиболее обоснованных фактов и основанных на них моделях. Статья будет правиться и дополняться. Для понимания статей, посвящённых возникновению и эволюции генетического кода (ГК), необходимо представлять хотя бы на школьном уровне то, как происходит синтез белка.
Для лучшего понимания сути данной статьи крайне желательно предварительно ознакомиться со статьёй "Аминоацил-тРНК-синтетазы - два класса ферментов".
Вообще термин "кодазы" употребляется очень редко, хотя это название более наглядно, так как фермент осуществляет фактически кодирование синтеза белка. Чаще всего вместо этого названия употребляется другое - аминоацил-тРНК-синтетазы (АРСазы).
Аминоацил-тРНК-синтетазы ответственны за первый этап синтеза белка – они присоединиют аминокислоту к акцепторному стеблю тРНК, в результате чего образуется аминоацил-тРНК, участвующая в кодируемом пептидном синтезе на рибосоме.
Реакция аминоацилирования аминоацил-тРНК-синтетазами протекает в два этапа. Первая стадия – активация аминокислоты, которая происходит с участием аденозил-5’-трифосфата (АТP). Образуется аминоаденилат, связанный с ферментом.
E + AA + ATP ↔ E♦AA~АМP + PP,
где Е – аминоацил-тРНК-синтетаза, АА – аминокислота, АТP - аденозил-5’-трифосфат, PP - пирофосфат, E♦AA~АМP – комплекс фермента с аминоаденилатом, АМP - аденозил-5’-монофосфат.
На первой стадии аминокислота активируется в результате гидролиза макроэргической связи АТP с отщеплением пирофосфата.
На второй стадии активированный аминоацильный остаток атакует одну из гидроксильных групп (2’-OH или 3’-OH) рибозного кольца в концевом аденозине тРНК. В результате образуется аминоацил-тРНК:
E♦AA~АМP + тРНК ↔ Е + АМP + АА~тРНК,
где АА~тРНК – аминоацил-тРНК.
Аминоацил-тРНК является завершённым субстратом для биосинтеза белка на рибосомах, поскольку в процессе дальнейшего белкового рибосомального синтеза узнаётся только полимерная часть этой молекулы – самой тРНК.
Если мы начнём сравнивать аминокислотные последовательности всех АРСаз, то окажется, что все они разобьются на две непересекающиеся группы:
В одной группе чаще всего встречаются одни консенсусные последоватлеьности (некие усреднённые варианты, которые мало отличаются друг от друга), а у другой группы другие.
По этому признаку АРСазы разбили на два класса. Их так и назвали - класс 1 и класс 2. И никто никода не обнаружил никакого сходства между АРСазами разных классов. Они настолько различны, что нельзя даже вообразить их общее происхождение. Значит АРСазы разных классов возникли как независимые белковые последовательности.Оказалось, однако, что АРСазы разных классов отличаются не только по последовательностям, но и по разным свойствам. Более подробно и наглядно об описании этих двух классов см. http://www.pereplet.ru/nauka/Soros/pdf/9809_014.pdf
В качестве иллюстрации, я просто приведу таблицу: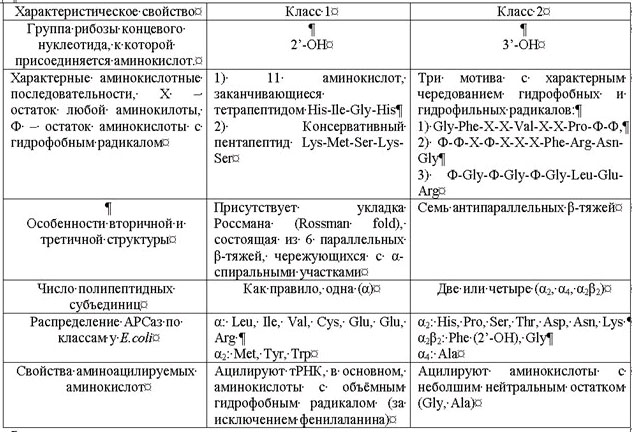
Рис. 1. Различия между АРСазами первого и второго класса. Приведены аминокислоты, соответствующие АРСазам 1 и 2 класса. Обозначения: X - остаток любой аминокислоты, Ф - остаток аминокислоты с гидрофобным радикалом. Для обозначения аминокислот используется стандартный трёхбуквенный код.
Примечательно (это видно из таблицы), что АРСаз 1 класса 10 и 2 класса 10, то есть АРСаз разных классов одинаковое число. Это - нетривиальный факт, он будет объяснён ниже.
То, что типов АРСаз в сумме 20 - это, надеюсь, понятно, так как 20 аминокислот.
Все синтетазы первого класса содержат так называемую укладку Россмана [Rould M. A. et. al. 1989], представляющую собой шесть параллельных β-тяжей, чередующихся с α-спиральными участками и расположенные таким образом, что напоминают веер. Сходные структуры обнаружены в других ферментах, связывающих нуклеотиды. Например, встречается у дегидрогеназ, связывающих NADH-кофактор, киназ, связывающий АТФ и переносящих фосфатную группу. Характерные для АРСаз первого класса пептидные мотивы как раз расположены в структуре Россмана. Они образуют часть АТФ-связывающего центра. Важно, что положительно заряженные остатки гистидина, расположенные в тетрапептиде His-Ile-Gly-His, взаимодействуют с фосфатными группами АТФ. АРСазы второго класса имеют другую структуру активного центра. Они содержат семь антипараллельных β-тяжей, также содержащий характерные пептидные мотивы. В связывании АТФ принимает участие консервативный остаток аргинина второго мотива Ф-Ф-X-Ф-X-X-X-Phe-Arg-Asn-Gly [Eriani G. et. al. 1995]. Из этой таблицы можно усмотреть, что АРСазы разных классов по разному связываются с молекулой тРНК:
АРСазы первого класса взаимодействуют с акцепторным стеблем тРНК через малый желобок, тогда как синтетазы второго класса – через большой желобок (в двойной цепи РНК есть два желобка - малый и большой). Таким образом, АРСазы разных классов взаимодействуют с разными компонентами тРНК.
На основе статистического анализа нескольких сот последовательностей из эубактерий, архей и эукариот АРСазы первого класса могут быть подразделены на три подгруппы. Эти три подкласса условно называются как Ia, Ib и Ic:
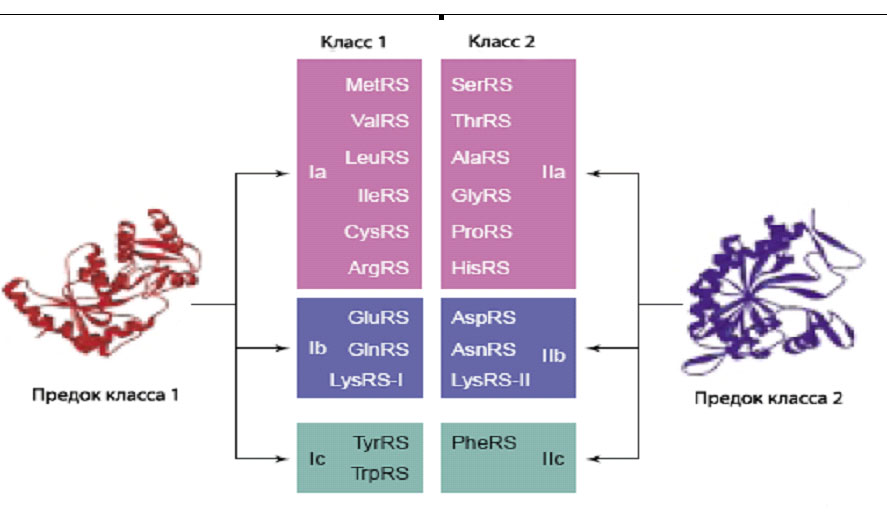
Рис. 2. Представители двух классов АРСаз эволюционировали из двух разных однодоменных белковых предков. Реальная локализация лизиновой синтетазы класса 1 не определена, однако условно отенесена к подклассу Ib. Рисунок взят с небольшими изменениями из [Ribas de Pouplana, L., Schimmel P. 2001b].
Разделение на подклассы было сделано опять же на основе статистического анализа первичных белковых последовательностей. Каждый подкласс должен иметь своего одного общего предка. Представители каждого подкласса узнают аминокислоты со сходными физико-химическими свойствами. Так, представители подкласса Ia узнают гидрофобные аминокислоты с алифатическими разветвлённым радикалами (Ile, Leu, Val) и серусодержащие радикалы (Met, Cys). К этому подклассу также относится аргинил-тРНК-синтетаза. К подклассу Ib относятся ферменты, узнающие заряженные аминокислоты – Lys и Glu. Ферменты из подкласса Ic узнают ароматические аминокислоты Tyr и Trp.
10 типов АРСаз второго класса также удивительным образом подразделяются на три подкласса IIa, IIb и IIc. Представители подкласса IIa узнают две группы аминокислот: алифатические и неполярные (Ala, Pro и Gly) и полярные (Ser, Thr и His). Ферментами подкласса IIb узнаются аминокислоты с заряженными боковыми цепями (Lys, Asp и его производное Asn). Представители подкласса IIc узнают оставшуюся ароматическую аминокислоту (Phe).
Если внимательно рассмотреть, какие аминокислоты относятся к каждому подклассу, то можно увидеть определённую симметрию между свойствами аминокислот из соответствующих подклассов (a,b и c) между двумя классами. Во первых, каждому подклассу соответствует сходное чило аминокислот. Подклассы Ia и IIa содержат одинаковое число аминокислот – по 6, Ib и IIb – по 3, а подклассы Ic и IIc – содержат хотя и разное, но минимальное количество 2 и 1, соответственно. Наиболее очевидное сходство существует между подклассами Ic и IIc – представители обоих классов распознают ароматические аминокилоты, и между подклассами Ib и IIb – им соответствуют заряженные аминокислоты и их производные. Однако и в случае больших подклассов Ia и IIa сходство также есть. Обоим подклассам соответствуют гидрофобные аминокислоты (Val, Leu, Ile в первом классе, Pro и Ala во втором классе); в соответствующих подклассах можно найти изостерические пары аминокилот Thr и Val, а также Ser и Cys. Возможно, что присутствие аргинина в подклассе Ia отражает использование в древнем белковом синтезе его предшественника в биосинтезе – орнитина. Аминопропиловая боковая цепь орнитина является более гидрофобной, чем гуанидино-пропиловая аргинина.
К статистическому анализу последовательностей АРСаз мы здесь добавим ещё одни источник информации - данные рентгеноструктурного анализа о пространсвенной структуре АРСаз разных классов и подклассов.
Рентгеноструктурный анализ показывает, что молекула тРНК сравнима по величине с молекулой (или субъединицей) АРСазы и взаимодействует с ним преимущественно в районе антикодона и акцепторного участка.
АРСазы разных классов контактируют с разными сторонами тРНК. Это важно для правильной ориентации в активном центре либо 2’-, либо 3’-гидроксильной группы рибозы. Связываение АРСазы одного класса с тРНК не создаёт стерических затруднений для связывания АРСаз из другого класса, что было продемонстрировано для 8 различных АРСаз, охватывающих все подклассы, для 6 из которых структуры комплексов приведены на рис. 3.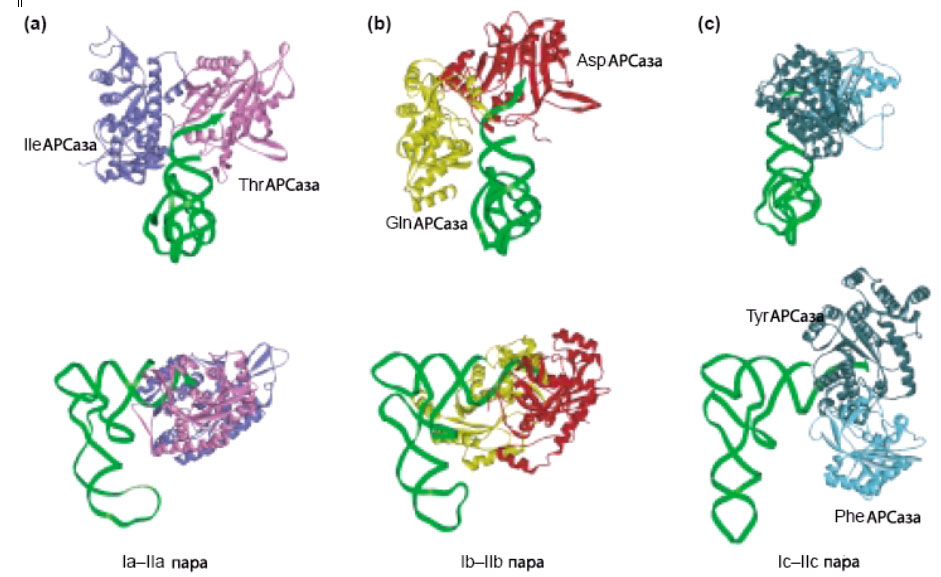
Рис. 3. АРСазы из одной подгруппы НЕ ПРЕПЯТСТВУЮТ связыванию АРСазы из другой подгруппы! Древние АРСазы могли связываться с тРНК ПАРАМИ!
Три пространственно смоделированных комплекса пары АРСаз из разных классов с акцепторным стеблем соответствующих тРНК. Молекулы тРНК обозначены зелёным цветом. Комплексы показаны в двух различных ориентациях. Наверху рисунка плоскость, образованная пересечением осей, направленных вдоль антикодонового и акцепторного стебля, расположена перпендикулярно плоскости страницы, тогда как внизу эта плоскость лежит в плоскости страницы. Показаны следующие специфические синтетазы: изолейциновая [Nureki O. et al. 1998], треониновой [Sankaranarayanan R. et al. 1999], глутаминовой [Rould M.A. 1989], аспартатовой [Ruff M. et. al. 1991], тирозиловой [Brick, P. et al. 1988] и фенилаланиновой [Goldgur Y. et al. 1997] АРСаз.
Рисунок взят с небольшими изменениями из [Ribas de Pouplana, L., Schimmel P. 2001b].
ПРЕДСТАВИТЕЛИ РАЗНЫХ КЛАССОВ КОДАЗ СВЯЗЫВАЮТСЯ С ТРНК С РАЗНЫХ СТОРОН, ЧТО ПОТЕНЦИАЛЬНО ДЕЛАЕТ ВОЗМОЖНЫМ ИХ ОДНОВРЕМЕННОЕ СВЯЗЫВАНИЕ С ТРНК.
Экспериментально было показано, что одна и та же тРНК может быть аминоацилирована АРСазами разных классов, хотя и не одновременно.
Однако не все комбинации пар АРСаз разных классов могут быть размещены на одной и той же тРНК без стерических затруднений. В некоторых парах возможны стерические затруднения для расположения коровых районов синтетаз на акцепторном стебле тРНК.
Моделированием было показано, что наименее стерически затруднённые комбинации могут быть получены, если располагать пары АРСаз из симметричных подклассов: Ia - с IIa, Ib - с IIb и Ic - IIc. Хотя на момент данного анализа не все структуры комплексов АРСаз с тРНК были определены, близкое сходство в первичной структуре между синтетазами внутри подклассов даёт основание предполагать и близкое сходство с их комплексами с тРНК. Показано также, что конформационные изменения, происходящие при связывании с одной АРСазой не препятствуют связыванию с АРСазойиз симметричного подкласса. Поразительно, что связывание тирозиловой и фенилаланиновой тРНК-синтетаз вызывают такие конформационные изменения (сдвиг и поворот), которые точно компенсируют друг друга. Хотя фенилаланиновая синтететаза не затрудняет связывание других синтетаз из противоположного класса, ориентация тирозиловой синтетазы стерически затрудняет связывание всех синтетаз из противоположного класса кроме фенилаланиновой.
Таким образом, замечательная симметрия между подклассами АРСаз из разных классов может рассматриваться как результат древнего парного взаимодействия этих синтетаз на одной тРНК.
Для чего нужны были такие пары. Одно из объяснений – такие пары нужны были для защиты акцепторного стебля от разрушающего воздействия окружающих условий, например, высокой температуры лассов.
Если бы все 20 основных типов синтетаз просто заменили бы 20 типов им предшествующих аминоацилирующих рибозимов, то не было бы причин ожидать появления такой симметрии между подклассами АРСаз. Поэтому более правдоподобно предположить, что всему разнообразию АРСаз предшествовало небольшое количество аминоацилирующих рибозимов. Сами первые АРСазы вряд ли охватывали все аминокислоты и возможно могли аминоацилировать тРНК не одной, а некоторым множеством сходных по физико-химическим свойствам аминокислот. В результате происходил примитивный синтез пептидов с ещё не оформленным классическим генетическим кодом. Этот синтез мог приводить к формированию двух типов синтетаз, являющихся предшественниками АРСаз двух классов.
На рис.4 показано распределение кодонов, в которых определённый цвет соответствует подклассу АРСазы. Из этого рисунка видно, что всем кодонам с корнем С соответствуют АРСазы второго класса, а с корнем U – почти все за исключением фенилаланиновых кодонов АРСазы первого класса.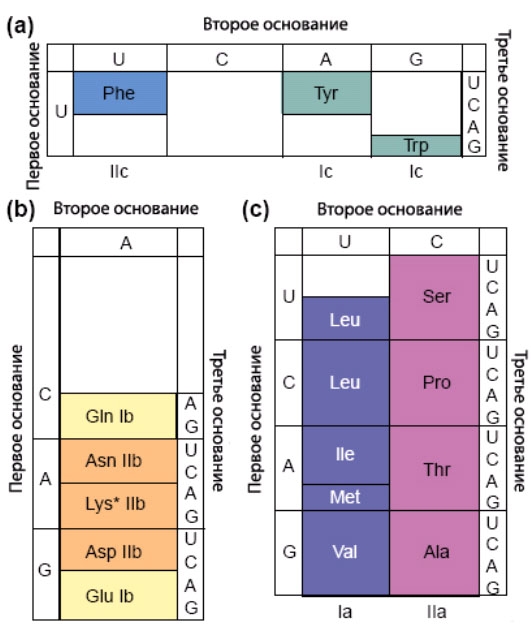
Рис.4. Части генетического кода, которым соответствуют АРСазы симметричных подклассов.
a) Аминокислоты, узнаваемые синтетазами классов Ic и IIc.
b) Аминокислоты, узнаваемые синтетазами классов Ib и IIb.
c) Аминокислоты, узнаваемые синтетазами классов Ia и IIa.
Особый случай лизина, который может быть узнаваем АРСазами обоих классов, отмечен звёздочкой.
Рисунок взят с небольшими изменениями из [Ribas de Pouplana, L., Schimmel P. 2001b].
На этом рисунке показано распределение кодонов по подклассам АРСаз.
Из этого рисунка видно, что АРСазам подклассов Ic и IIc соответствуют кодоны с первым основанием U. Фактически фениаланиновой и тирозиновой АРСазам соответствуют кодоны, отличающиеся только вторым основанием.
Пять аминокислот, связанных с подклассами Ib-IIb, кодируются кодонами, имеющими второе основание А.
В наиболее крупной паре подклассов Ia-IIa используются кодоны с различными вторыми основаниями Четыре из шести аминокислт, соответсвующих синтетазам из подкласса Ia кодируются кодонами с корнем U и различаютя, главным образом, по приставке кодонов. Удивительно, что аналогично четырём из шести аминокислотам, соответствующих кодазам симметричного подкласса IIa также соответствует один и тот же корень в кодоне, в данном случае C и также различаются вариациями лишь в первом нуклеотиде кодируещего их триплета
Анализ закономерностей распределения кодонов, соответствующих АРСазам из симметричных подклассов для 16 из 20 аминокислот, позволяет предположить, что формирование распределение кодонов по этим 16 аминокислотам происходило в период, когда древние тРНК могли аминоацилироваться парами.
Аминоацилирование древних РНК.
Более специфичное распределение кодонов по аминокислотам должно было произойти уже на этапе, когда одна молекула тРНК могла аминоацилироваться только одной кодазой из соотвтетствующей пары. Эволюция в направлении большей специфичности аминоацилирвания проявлялась в том, что АРСазы приобретали способность преимущественного аминоацилирования одной из пула сходных по физико-химическим свойствам аминокислот. Возможно, именно на этом этапе у тРНК появился более поздний нижний домен позволивший увеличить специфичность узнавания кодазами. К образованию нижнего домена тРНК мы ещё вернёмся.
Селективное преимущество аминоацилированных рибозимов – увеличение химического разнообразия в РНКовом мире по сравнению с неаминоацилируемыми РНК. В свою очередь, аминоацилированные РНК могли образовывать пептидил-РНК, что ещёбольше увеличивало химическое разнообразие мира РНК. Фактически существуетвозможность замещения чисто РНКовых молекул молекулами пептидилРНК ирибонуклеопротеиновыми комплексами (РНП). Сами молекулы РНК могли проявлять базовую активность, а пептидные частицы могли увеличивать стабильность иферментативную активность. Такого рода структуры называют РНПзимами.
РНПзим - РНК-белковый (или РНК-пептидный) комплекс, проявляющий ферментативную активность. В РНПзимах каталитическая активность осуществляется непосредственно РНК (рибозимами), но совместно со связанными с ними белками. К РНПзимам всовременных живых организмах относятся рибосомы, РНКаза P и др.
Так, РНКаза P в современных организмах,участвующая в процессинге тРНК, имеет РНКовый каталитический центр. Белковый кофактор для него увеличивает стабильность и усиливает каталитическую активность.
Развивая эту идею, можно предположить, что РНПс аминоацилирующей активностью могли быть предшественниками чисто белковых АРСаз. Такие древние аминоацилирующие РНП могли использовать для аминоацилирования некоторый ограниченный набор аминокислот. Из этих РНП частиц должен был вознинуть рибонуклеопротеиновый компелкс, состоящий из предковой молекулы тРНК (или их гетерогенной популяции) и двух пептидных молекул, связывающихся с аминоацилируемой частью РНП и являющихся предками АРСаз двух классов. В аминоацилировании могли принимать участие или сами эти простейшие пептиды, или в комплексе с рибозимами. Однако важно, что поскольку эти пептиды были оченьважны для аминоацилирования, они находились под очень жёстким отбором наспособность связывать АТФ. Поэтому уже на этом этапе эти древние пептиды должныбыли сформировать АТФ-связывающие карманы. Эти карманы для двух пептидов,связывающихся с РНК, формировались независимо друг от друга и в дальшейшемпередались АРСазам разных классов.
ФОРМИРОВАНИЕ АТФ-СВЯЗЫВАЮЩИХ ДОМЕНОВ ПРЕДКОВЫХ АРСАЗ ПРОИЗОШЛО ДО ФОРМИРОВАНИЯ КЛАССИЧЕСКОГО ГЕНЕТИЧЕСКОГО КОДА И ДАЖЕ ДО ФОРМИРОВАНИЯ РАЗЛИЧНЫХ КЛАССОВ АРСАЗ.
Дупликация и дивергенция предковых рибонуклеопротеиновых комплексов должны были на начальном этапе привести к формированию по крайней мере трёх различных аминоацилируемых рибонуклеопротеинов, состоящих из тРНК и пары предковых белковых структур, которым соответствовал свой пул аминокислот. Эти три предковые аминоацилирующие РНП дали начало трём симметричным подклассам для каждого из класса АРСаз.
Такие примитивные кодирующие системы могли использовать ограниченный набор пар АРСаз и соответствующих им древних тРНК-подобных молекул, в которых каждой тРНК и паре АРСаз соответствовала определённая группа сходных по химическим свойствам аминокислот.
Возможность существования примитивных кодирующих систем, в которых вместо одной аминокислоты используется пул сходных по физико-химическим свойствам аминокислот косвенно подтверждается интересным фактом, когда при синтезе белка в E.coli 20% валиновых кодонов кодировал исходную с валином другую аминокислоту альфа-аминобитурат и кишечная палочка выживала, несмотря на такие замены.
Более специфичное распределение кодонов по аминокислотам должно было произойти уже на этапе, когда одна молекула тРНК могла аминоацилироваться только одной кодазойи з соотвтетствующей пары. Эволюция в направлении большей специфичностиа миноацилирвания проявлялась в том, что АРСазы приобретали способность преимущественного аминоацилирования одной из пула сходных по физико-химическим свойствам аминокислот. Возможно, именно на этом этапе у тРНК появился болеепоздний нижний домен позволивший увеличить специфичность узнавания кодазами.К образованию нижнего домена тРНК мы ещё вернёмся.
Возвращаясь к идее возникновения первых АРСаз как древних РНПзимов, важно отметить, что древние РНПзимы наряду с АРСазами дали начало и другим ферментам.
В пользу этого предположения говорит полифункциональность некоторых АРСаз (см. обзор), которые наряду со специфическим аминоацилированием, могут выполнять также другие функции, которые мы можем считать как древнейшие. Так, тирозиловая АРСаза из митохондрии плесневого гриба Neurospora crassa катализирует не только аминоацилирование соответствующей тРНК, но и также сплайсинг всех митохондриальных интронов группы I (об этом типе интронов будет написано подробно в других статьях), которые во многих исследованных случаях способны к сплайсингу без участия белков [Lambowitz A.M. Perlman P.S. 1990; Paukstelis P.J. et al. 2008]. Данный пример можно проинтерпретировать как промежуточную стадию в "перехвате" каталитической функции от РНК к РНПзиму и затем к белку.
Важно также, что некоторые компоненты РНК и ДНК-полимераз имеют сходство споследовательностями АРСаз второго класса, что указывает на возможность общего древнего происхождения некотрых видов РНК или ДНК-репликаз и АРСаз (ссылка).
Важно также, что рибозимы интронов группы I, катализирующие перенос фосфодиэфирной связи, могут также катализировать реакции на углеродном центре по присоединению аминокислоты [Piccirilli J.A. et al. 1992]. Специфичность, с которой современные рибозимы интронов группы I связывают L-аргинин, оставляют мало сомнений относительно того, что древними аминоацилирующими ферментами были именно РНК.
РЕЗЮМЕ.
1) АРСазы каждого класса можно разбить на три подкласса - a,b и c. Между одними и теми же подклассами АРСаз из разных классов существует симметрия: АРСазам сходных подклассов соответствуют аминокислоты со сходными физико-химическими свойствами и сходный пул кодонов.
2) Современные АРСазы из симметричных подклассов потенциально способны свзязываться с одной и той же молекулой тРНК так, что связывание АРСазы из одного класса НЕ ПРЕПЯТСТВУЕТ связыванию АРСазы из другого класса, но симметричного подкласса.
3) Древние пептиды, связывающиеся с РНК ещё на самых ранних стадиях формирования генетического кода, дали впоследствие начало не только АРСазам, но и многим другим важнейшим древним белкам, в первую очередь РНК-полимеразам. "Перехват" функций от РНК к белкам происходил постепенно через стадию РНПзима.
4) В древних белок-синтезирующих системах АРСазы по-видимому связывались парами с древними тРНК. На ранних этапах эти комплексы могли аминоацилировать РНК, используя для синтеза белка не строго определенную аминокислоту, а пул аминокислот.
5) Эволюция таких комплексов - РНК-пара АРСаз привела сначала к формированию трёх различных видов комплексов, каждый из которых дал начало трём симметричным подклассам кодаз. Каждому подклассу уже соответствовал свой пул аминокислот.
6) На поздних этапах формирования генкода каждую молекулу тРНК аминоацилировала уже одна, а не две АРСазы, а каждой молекуле тРНК соответствовал всё более определённый пул аминокислот или одна аминокислота.
Литература.
1. Ribas de Pouplana, L., Schimmel P. Aminoacyl-tRNA synthetases: potential markers of genetic code development. // TRENDS in Biochemical Sciences. 2001a. V.26. P.591-596.
2. Ribas de Pouplana, L., Schimmel P. Two classes of tRNA synthetases suggested by sterically compatible dockings on tRNA acceptor stem.// Cell. 2001b V.104 P.191–193.
Статьи, связанные с темой:
Аминоацил-тРНК-синтетазы - два класса ферментов
Свойства генетического кода - след его возникновения
