Как мог выглядеть архаичный метаболизм?
Относится к разделу Молекулярная биология
Развивая и уточняя модель автотрофного термофильного происхождения жизни, попробуем по возможности представить, а как именно конкретно могли выглядеть первые автотрофные циклы, которые согласно нашему рассмотрению должны были сформироваться ещё до того, как в фильме под названием "Происхождение жизни" появились новые действующие лица - РНК-компоненты.
Зададимся вопросом. А какой метаболический цикл можно рассматривать в качестве первого, собственно и давшего толчок для дальнейшей уже дарвиновской эволюции метаболизма? Для того, чтобы представить этот цикл, мы должны учитывать, что первые метаболические реакции должны были катализироваться не белковыми ферментами, а какими-то их аналогами, структурно более простыми. Вспомним, что в статье Минеральные корни современных ферментов в качестве базового было сформулировано предположение о том, что реакции в этих метаболических сетях катализировались преимущественно минералами, хотя безусловно большую роль должны были играть те органические молекулы, которые с одной стороны синтезировались или абиогенно, или же, что очень важно, синтезировались уже в самих этих автотрофных метаболических сетях. Автокаталитичность реакций архаичного метаболизма таким образом, была обеспечена с одной стороны тем, что продукты в циклах накапливались (так как был процесс связывания, а не выделения СО2), а с другой стороны - тем, что многие органические молекулы, синтезируемые в этих циклах уже сами становились частью катализаторов этих циклов, причём в первую очередь как лиганды для минералов. Такого рода гипотетический катализ архаичного метаболизма, обеспечиваемый минералами и быть может некоторыми простейшие органическими веществами получил название полуферментативного. Путь, по которому пытаются воссоздать древние метаболические пути, возникшие в отстуствие белковых и РНКовых катализаторов, можно назвать биомиметическим (от слова «биомиметика», синонима ещё более распространённого в русском языке слова «бионика»), когда в древних циклах пытаются сохранить общий принцип или структуру каких-то частей современных метаболических путей, которые предполагаются как древнейшие. Такого рода воссозданные древние метаболические сети, циклы, или отдельные реакции, назвываются в научной литературе архаичными или биомиметическими аналогами, или прообразами.
Для этого нам вновь потребуется вспомнить известные давно и не очень пути фиксации углерода, наблюдаемые в различных группах прокариот.
В настоящее время основную роль в глобальной фиксации углерода играют фотосинтезирующие зелёные растения, зелёные водоросли и цианобактерии. Однако этот путь фиксации углерода в данной статье нас будет интересовать меньше всего. Мы рассмотрим способы фиксации, характерные для прокариотических организмов. Удивительно, но факт. Количество достоверно доказанных способов фиксации углерода медленно, но неуклонно растёт, причём последние способы были открыты совсем недавно [Thauer R.K. 2007; Huber H. et al., 2008]. В настоящее время достоверно доказанным можно считать уже 6 различных способов фиксации углерода. Автотрофные микроорганизмы могут быть найдены как в большинстве групп эубактерий, так и среди многочисленных представителей архей. Примечательно, что эти микроорганизмы, как правило, в качестве источника энергии используют не свет, а неорганические вещества: они окисляют серу, сульфиды, металлы, ионы аммония и нитриты, что особенно важно для нашего анализа, если рассматривать именно хемоавтотрофную модель происхождения жизни.
Следует отметить, что даже в обнаруженных механизмах фиксации углерода есть ещё немало белых пятен. Не исключено также, что в ближайшем будущем будут описаны новые способы фиксации углерода, которые дадут новую информацию для анализ. До сих пор ещё даже не оценена роль хемолитоавтотрофной фиксации углерода даже у современных организмов, которая характерна не только для подзеных, глубоководных и гидротермальных систем, но также, скажем, для почв агросистем и лесов [Kellermann С.S. 2008].
Рассмотрим подробнее различные варианты моделей архаичных метаболизмов, которые дали начало их современным аналогам.
В качестве древнейшего цикла Г.Вехтерхойзер рассматривает предковый аналог современного восстановительного цикла трикарбоновых кислот (ВЦТК, восстановительного цикла лимонной кислоты, восстановительного цикла Кребса, цикла Арнона).
Главное, почему цикл Кребса (точнее его восстановительный аналог) так привлекателен в качестве древнейшего цикла фиксации углерода (если не первого, то по крайней мере уже существовавшего до появления кодируемого пептидного синтеза) - это то, что его интермедиаты являются необходимыми предшественниками для синтеза аминокислот и рибонуклеотидов, то есть ВЦТК создаёт предпосылку для возникновения более продвинутых форм ЖС, основанных на рибонуклеотидах, РНК и пептидах.
Этот цикл встречается в филогенетически исключительно разнообразных группах организмов, что может служить доводовм в пользу его древности. Обнаружен у бактерий водород-окисляющей Hydrogenobacter thermophilus, аэробной Aquifex pyrophilus, сульфат-редуцирующей Desulforobacter hydrogenophilus. Является единственным достоверно доказанным способом фиксаци углерода у ε-протеобактерий. Обнаружен и среди архей в роде Sulfolobus, а также растущем на молекулярном водороде и сере Thermoproteus neutrophilus.
Ещё один важный аргумент в пользу привлекательности ВЦТК, как исходного цикла для эволюции первых ЖС - это то, что целый ряд интермедиатов этого цикла - вещества, способные служить лигандами, связывающимися с переходными металлами. Получившиеся таким образом комплексные координационные соединения - потенциальные катализаторы, которые могли являться прообразами современных белковых катализаторов. Подробнее об этом см. Минеральные корни современных ферментов.
Не смотря на то, что этот способ фиксации углерода был обнаружен ещё в 1966 году Эвансом с соавт. [Evans et al. 1966], его более-менее детальный механизм стал известен тольк к 90-м годам прошлого века [Thauer R.K. 2007].
Этот цикл является автокаталитическим, так как его продукты ускоряют данный цикл: с каждым оборотом цикла количество акцепторов СО2 удваивается. Если предположить, что ВЦТК является непосредственным потомком одного из первых биохимических циклов, то необходимо попытаться найти условия, в которых какие-то химические реакциии этого цилка или каких-то модификаций этого цикла могли бы протекать в отсутствие белковых катализаторов.
Cхема ВЦТК представлена на рис. 1 слева в виде необычного, но весьма наглядного представления: если приглядеться, то можно увидеть, что две половинки этого цикла симметричны, и формулы интермедиатов отличаются на карбоксильную группу -CO2-. Если начать рассматривать этот цикл с сукцината, то можно увидеть, что за весь цикл после связывания четырёх молекул CO2 образуется ещё одна дополнительная молекула сукцината. Именно этот соверменный цикл служит основой для реконструкции предкового архаичного цикла, в котором для протекания реакций не требуется белковых ферментов.
Свою модель Г.Вехтерхойзер строит исходя из неких базовых геохимических предположений, которые он условно называет "постулатами", и из которых доказывает определённые следствия.
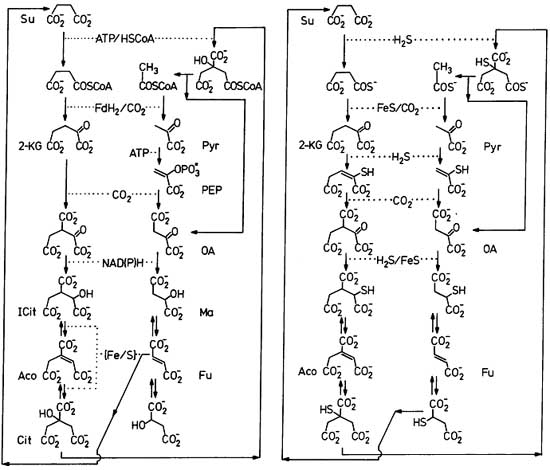
Рис. 1. Схемы современного восстановительного цикла лимонной кислоты (слева) и гипотетического архаичного цикла (справа). Рисунок взят из [Wächtershäuser G. 1990]. Каталитические циклы показаны в так называемом "переплетённом" представлении, в котором обе половины симметричны. Формулы слева и справа отличаются на группу -CO2-.
Обозначения: Su - сукцинат, 2-KG - 2-кетоглутарат, ICit - изоцитрат, Aco - аконитат, Cit - цитрат, Pyr - пируват, PEP - фосфоенолпируват, OA - оксалоацетат, Ma - малат, Fu - фумарат, FdH2 - восстановленный ферредоксин, [Fe/S] - фермент с железо-серным кластером, HSCoA - свободный кофермент А.
Вехтерхойзер отталкивается от базового предположения:
Геохимическая окружающая среда, в которой возникли первые метаболические циклы, являлась водной и анаэробной, обогащённой сероводородом H2S (или сульфид-ионами HS-), контактирующая с сульфидами и пиритами тяжёлых металлов.
Если принять это предположение, то можно экспериментально показать, что в таком окружении органические компоненты современного ВЦТК сосуществовали с тиоаналогами, согласно следующим химич, которые могут быть получены из предположения 1 и хорошо известных химических фактов.
1. Карбоксильная группа (-СОО-) находится в равновесии с тиокарбоксильной группой (-СОS-).
2. Компоненты карбонильных групп (и их енольных форм) сосуществуют с тиоаналогами, как показано на рис. 2а.
3. Обратимые реакции гидрирования-дегидрирования аконитата и фумарата (см. рис.4 слева) конкурируют с реакциями присоединения-освобождения сероводорода (рис.4 справа).
4. Положительно заряженные поверхности сульфидов и пиритов тяжёлых металлов связывают отрицательно заряженные компоненты архаического цикла через карбоксильную (-СОО-), тиокарбоксильную (-СОS-) и тиолатную (-S-) группы.
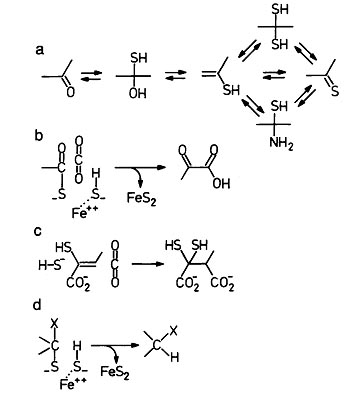
Рис. 2. Механизмы реакций, объясняющие следствия из предположений. Рисунок взят из [Wächtershäuser G. 1990].
Вехтерхойзер также предположил, что при формировании архаичного предкового ВЦТК пирит (FeS2) являлся термодинамически наиболее стабильным соединением железа, однако скорость его образования (то есть FeS+H2=FeS2+H2) была существенно меньше скорости его расходования.
Обратимые и необратимые части ВЦТК.
Анализ возможности самопроизвольного протекания реакции возможен, если подсчитать (с помощью справочных данных) величину так называемой свободной энергии G (см. словарь ниже) для предполагаемых реакций. Её изменение позволяет нам судить, пойдёт ли реакция самопроизвольно, или нет. Если её изменение отрицательно (ΔG < 0), то данная реакция сможет протекать самопроизвольно, такие реакции называются экзергоническими. Если же ΔG > 0, то прямая реакция самопроизвольно идти не может (такие реакции носят название эндергонических), зато сможет идти обратная реакция. С помощью величины изменения энергии Гиббса мы можем анализировать возможность самопроизвольного протекания гипотетеических реакций, предположительно давших начало древнему ВЦТК.
С этой точки зрения уместно взглянуть на величину ΔG в современном ВЦТК (рис. 6):
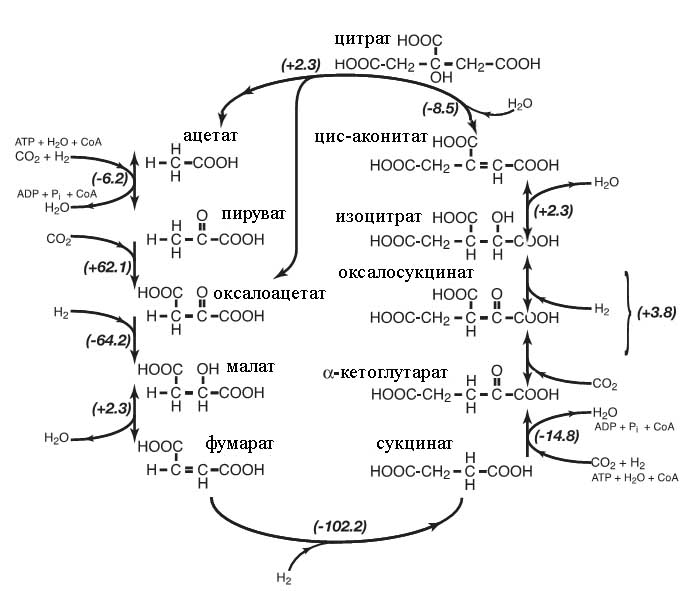
Рис. 3. Изменение энергии Гиббса в современном ВЦТК. Двусторонние стрелочки показывают потенциальную обратимость отдельных реакций. Рисунок взят из [Smith E., Morowitz H.J. 2004] с некоторыми изменениями.
Как видно из рис. 3 существенно эндергонической является реакции карбоксилирования пирувата.
Вторая критическая реакция, хотя и менее эндергоническая - это карбоксилирование 2-кетоглутарата.
Если же рассматривать укороченный вариант этого цикла, который соответствует окислительному циклу Кребса, то критической оказывается превращение цитрата в оксалоацетат (свободная энергия Гиббса, как термодинамический потенциал просто складывается для последовательности реакций).
Остальные реакции являются или эндергоническими, или изменение энергии Гиббса близко к нулю и реакция может быть обратима.
Поэтому именно для этих двух реакций необходимо подобрать абиогенные условия, которые позволили бы обойти это препятствие и "запустить" биохимический ротор.
Примечательно, что в современных организмах эти две критические реакции катализируются ферментами, содержащими неорганические FeS-кластеры, которые относятся к активным центрам ферментов, и этот факт может быть проинтерпретирован как непосредственное участие металло-серных кластеров в катализе архаичных аналогов ВЦТК (подробнее об этом в статье Минеральные корни сорвеменных ферментов).
Проанализируем с точки зрения изменения свободной энергии возмоность протекания реакций ВЦТК и её гипотетического древнего аналога. После термического востановления водородом в горячих источниках возможно протекание и обратной реакции:
Не смотря на то, что данной модели уже больше 20 лет, она по прежнему выглядит весьма привлекательной, поскольку способна объяснить возможность функционирования древнейшего аналога ВЦТК.
В последствии модель возникновения жизни в горячих источниках получила существенное развитие [Corliss J.B. 1990; Cody G.D. et al., 2001; Di Gulio M. 2000; Holm N.G., Anderson E.M., 1998; Nisbet E.G., Sleep N.H. 2001; Shock E.L. 1990.; Wächtershäuser G. 1992, 1997].
Один из моментов связан с отрицанием категоричности утверждения Вехтерхойзера, связанного с отрицанием роли абиогеннно синтезируемых аминокислот (их роль и возможный даже "след" правых аминокислот в исходной абиогенной рацемической смеси будет рассмотрен в одной из статей).
Однако различные виды экспериментальных данных (анализ известных тиоаналогов ВЦТК, возможность фотосинтетического прохождения части реакций, данные, говорящие в пользу существенной древности ВЦТК и ферредоксинов), а также тот факт, что составные части этого цикла обеспечивают пул предшественников для биосинтеза аминокислот и рибонуклеотидов, дают основание считать, что для развития данной модели есть перспективы. Модель первичности прообраза ВЦТК с начала 90-х годов стала приобретать всё большую популярность [Morowitz H.J. et al. 2000; Cody G.D. et al. 2001; Lindahl P.A. 2004].
Вариант второй. Фиксация СО2 через древний аналог ацетилкоэнзимного пути (пути путь Вуда-Люнгдала) - второй альтернативный вариант источника энергии и строительного материала для ЖС.
"Жизнь началась как побочный эффект гидрогенизации диоксида углеорода с формированием метана или ацетата"
М.Рассел, В. Мартин 2004
Наряду с архаичным прообразом ВЦТК вторым кандидатом цепи реакций, связанных с фиксацией углерода, архаичные предшественники которых могут рассматриваться в качестве первых реакций автотрофного исходного метаболизма, происходящих в гидротермальных системах, рассматривается так называемый ацетилкоэнзимный путь (путь Вуда-Люнгдала) [Fuchs G., Stupperich E. 1985; Pereto J.G. et al. 1999; Russell M.J., Martin W. 2004; Thauer R.K. 2007; Ragsdale S.W., Pierce E. 2008; Ljungdahl L.G. 2009].
Этот способ фиксации углерода был открыт в начале 80-х годов Вудом с соавт. [Wood H.G. et al. 1986]. В этом метаболическом пути одна молекула СО2 восстанавливается до СО, которая, в свою очередь восстанавливаетя до метанола, из которого образуется ацетил-СоА [Wood H.G. et al., 1986; Kinkle B.K., Kane T.C. 2000; Thauer P.K. 2007]. Это - единственный известный нециклический способ фиксации углерода.
Данная реакция катализируется двумя ферментами - ацетил-CoA-синтетазой (ACS) и O-дегидрогеназыой (CODH), которые могут представлены как разными белками, так и одним бифункциональным белком. Удивительным в этом способе фиксации углерода оказался тот факт, что активные центры двух ключевых ферментов этого пути представляют собой железо-серно-никелевые кластеры, которые фактически и катализируют эту реакцию. Кроме сравнительной простоты крайне интересным оказалась неорганическая часть ключевых ферментов, участвующих в данном цикле, которая подробнее рассматривается в статье "Минеральные корни современных ферментов". Поскольку ключевой ферментный комплекс, состоящий из СО-декгидрогеназы (CODH) и ацетил-СоА-синтазы (ACS) (у некоторых прокариот они могут быть представлены отдельными белками), является очень чувствительным к окислению, этот метаболический путь обнаруживается только у строгих анаэробов [Thauer P.K. 2007].
Все современные автотрофы в данном метаболическом пути фиксируют диоксид углерода с использованием водорода: косвенно из воды или H2S или непосредственно из H2. Современные автотрофные организмы, обладающие этим способом фиксации углерода, в качестве источника энергии используют только неорганические вещества: СО и Н2, и H2S, а углекислый газ используется в качестве акцептора электронов.
Этот способ фиксации характерен для эволюционно очень удалённых групп анаэробных прокариот [Peretó J.G. et al. 1999] - ацетогенных (например, Acetobacterium woodii и Sporomusa sp.) и сульфат-редуцирующих бактерий (например, Desulfobacterium autotrophicum и Desulfovibrio baarsii). Встречается он также и среди метаногенов (например, Methanobacterium thermoautotrophicum, Methanosarcina barkeri) и филогенетически далеко отстоящую от них группу термофилов и родов Methanopyrus, Methanococcus и Methanothermus.
Структура ферментов, включённых в этот процесс и сам механизм этого метаболического пути, не смотря на различия в некоторых используемых кофакторах, во многом очень сходен между разными группами прокариот, что говорит о монофилетическом происхождении этого пути [Weiss D.S., Thauer R.K. 1993].
Организмы, генерирующие уксусную кислоту в качестве главного конечного продукта брожения с помощью окисления молекулярного водорода, сероводорода или оксида углерода (II), получили название ацетогенных бактерий: они продуцируют ацетат.
Этот способ фиксации углерода обнаружен как у бактерий, так и некоторых термофильных архей [Kinkle B.K., Kane T.C. 2000].
Интересная особенность этого пути в том, что здесь используются две молекулы CO2, но для совершенно разных целей: одна молекула используется как единственный источник углерода, тогда как вторая - как акцептор электронов [Fuchs G. 1986].
При этом способе фиксации на первом этапе происходит фиксация углекислого газа с помощью тетрагидрофолата с использованием энергии АТР. На втором этапе происходит синтез ацетил-коэнзима А из СH3-H4-фолата. Перенос метильной группы на кофермент А осуществляется особой метилазой, предсталяющей собой так называемый кобальт-содержащий железо-серный белок (CFeSP), содержащий корриновое кольцо (), координационно связанный с кобальтом (см. рис. 4).
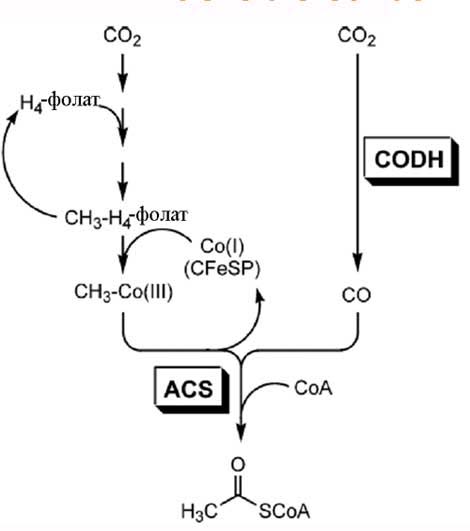
Рис. 4. Путь Вуда-Люнгдала. Обозначения СОDH - СО-дегидрогеназа; ACS - ацетил-коэнзим А-синтаза; CFeSP (CobaltFeS protein) - кобальтово-железо-серный белок, катализирующий перенос метильной группы от тетрагидрофолата к коферменту а и восстановленному до (+2) углероду.
Параллельно происходят два процесса:
1. СО-дегидрогеназа (СОDH) восстанавливает молукулу СО2 до СО, причём электроны для восстановления чаще берутся из H2:
CO2 + 2e + 2H+ = CO + H2O.
Примечательно, что восстановление СО2 до СО происходит на так называемом Fe4NiS5-активном центре белка, который получил название "С-кластер" (см. рис. 4).
2. Ацетил-СоА-синтаза (ACS) конденсирует карбонильную группу с метильной группой на так называемом "А-кластере" (рис. 4), дающую связанную с металлом ацетильную группу, которая освобождается из фермента через тиолиз с помощью ацетил-коэнзим А.
CO + H2O ⇄ CO2 + 2e- + 2H+ [1]
CH3-Co3+FeSP + CO + CoASH ⇄ CH3C(O)SCoA + Co1+FeSP + H+ [2]
H+ + Co1+FeSP + CH3-THF = CH3-Co3+FeSP + THF [3]
CH3C(O)SCoA + H4SPT + H2O⇄ CH3-H4SPT + CO2 +2e- + 2H+ + CoASH [4]
где H4SPT является тетрагидросарцинаптерином, архейным аналогом тетрагидрофолата. CoFeSP в реакции [2] является
Как отметили Дж. Перето с соавт., филогенетическое распределение ВЦТК и ацетил-коэнзимного пути не позволяет сделать вывод о том, какое путь более древний [Pereto J.G. et al. 1999]. Однако существует ряд доводов, говорящих в пользу большей древности именно ацетил-коэнзимного пути.
В некотором роде этот путь можно рассматривать как существенно более простой по сравнению с ВЦТК: он содержит меньше стадий, не требует органических праймеров (затравок для инициации реакций), таких как лимонная кислота, и фиксация углерода в нём происходит только в одной реакции, тогда как даже в укороченной версии ВЦТК фиксация углерода происходит в двух реакциях.
Кроме того, ацетил-коэнзимный путь фиксации углекислого газа - единственный способ фиксации без затрат АТР (или других трифосфатов) в прямой реакции углекислого газа и водорода.
Этот факт даёт большие возможности для упрощения этого пути до полностью безнуклеотидного аналога.
Немаловажным аргументом в пользу первичности данного способа фиксации углерода ялвяется тот факт, что при этом способе фиксации СО2 используется энергия исключительлно неорганических веществ - молекулярного водорода (или других неорганических доноров электронов).
Привлекательным в данном предположении выглядит не только существенная простота данной реакции, но и её экзергонический характер (в ходе реакции уменьшается энергия Гиббса, а, значит, реакция термодинамически способна идти без затрат энергии).
4H2 + 2CO2 + HSCoA = CH3COSCoA + 3H2O, ΔG = — 59 кДж/моль
Сам ацетил-коэнзим А, также как и кобаламин в ACS, должны были быть непременными компонентами рибоолигонуклеотидного мира, а, значит, такой, хотя и довольно простой вариант, этот путь мог приобрести только на стадии, когда в метаболизм уже включились рибонуклеотиды.
Тем не менее, экспериментально обнаружены реакции, которые во многом аналогичны реакциям данного пути, но которые могли уже стать ключевыми в становлении первого метаболизма ещё до появления гипотетического рибонклеотидного мира.
Древним аналогом Ацетил-СоА мог служить ацетилтиоэфир.
Примечательно, что ацетилтиоэфиры могут образовываться в щелочных условиях из неорганических компонентов с фиксацией диоксида углерода в присутствии FeS и NiS как катализаторов [Huber C., Wächtershäuser G. 1997], что является очень сильным аргументом в пользу интерпретации древнего прообраза ацетил-коэнзимного пути как первого способа фиксации углерода, с которого ЖС начали эволюционировать (см. 5). Они обнаружили, что смесь соосаждённых NiS/FeS даёт ацилтиоэфиры.
2CH3SH + CO → CH3CO(SCH3) + H2S,
CH3SH вместе с уксусной кислотой могут синтезироваться при добавлении селена к смеси NiS/FeS:
CO + H2S → CH3COOH + CH3SH.
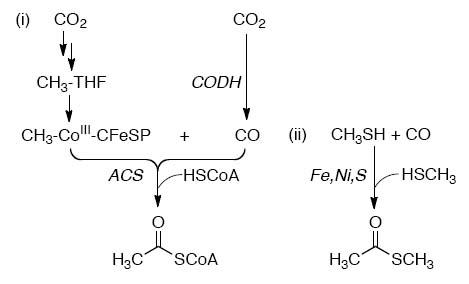
Рис. 5. Сходство путей фиксации углерода в АКА пути (i) и его геохимическом биомиметическом аналоге (II).
Этот аргумент рассматривается чуть более подробно в статье Минеральные корни современных ферментов, где учитывается сходство между минеральными компонентами активных центров ферментов, ответственных за протекание реакций этого метаболического пути и неорганическими FeS NiS-катализаторами, катализирующими очень сходную реакцию (см. реакцию (8) в статье Автотроное термофильное происхождение жизни).
Если рассматривать гипотетический прообраз данной реакции до "попадания" автокаталитических реакций под контроль рибонуклеотидов, то безнуклеотидный аналог этой реакции, предположительно катализируемый каким-то минералом, (фактически являющийся итоговым уравнением превращения в ацетогенных бактериях) является ещё более экзергоническим:
4H2 + 2CO2 = CH3COOH + 2H2O, ΔG = — 160,7 кДж/моль при 700С.
Данная реакция является экзергонической, но может протекать лишь в присутствии катализатора (из-за высокой
Таким образом, в примитивном древнем аналоге этого пути мог также образовываться тиоэфир, не обязательно связанный с нуклеотидом (коферментом А). В качестве кандидата на роль этого тиоэфира уместно рассматривать метилсульфид СH3SH, который, как указывалось выше может образовываться из СО и СО2 и сероводорода и (или) сульфидов. По предположению М. Рассела и В. Мартина подобно ацетил-СоА, это вещество может служить одновременно и универсальным строительным материалом, и источником энергии [Russell M.J., Martin W. 2004]. Из этого вещества в дальнейшем могла образовываться тиоуксусная кислота (см. описание реакции выше) и вследствие нестабильности последней - ацетатов.
Ацетилтиоэфиры и ацетилфосфаты могли являться предшественниками АТР как универсальная энергетическая валюта.
Сам абиогенный способ фиксации углерода, обнаруженный Хубером и Вехтерхойзером мог стать основой не только АКА пути, но и архаичного варианта ВЦТК, которые могли приобрести более-менее сходный с современным вид только после появления на сцене эволцюии метаболизма рибонуклеотидных кофакторов.
Учитывая, что ацетил-СоА является одновременно продуктом АКА пути и непременных компонентом ВЦТК (и не только, как будет сказано ниже), то он мог стать стартовой точкой для дальнейшей эволцюии автотрофных метаболических сетей, из которых важнейшей частью является именно ВЦТК, как исходная стартовая площадка для синтеза аминокислот, нуклеотидов и липидов.
Вариант третий. Архаичная метаболическая сеть с различными способами фиксации углерода, являвшимися прообразами большинства (но не всех) способов фиксации углерода.
Представим, что современные способы фиксации углерода отражают какие-то архаичные пути фиксации диоксида углерода, катализируемые предположительно какими-то минералами, сформированных в гидротермальном геохимическом окружении (в первую очередь, железо-серными и железо-никелево-серными - см. Минеральные корни современных ферментов).
Если представить, что первые ЖС представляли собой сети конкурирующих автокаталитических реакций, так или иначе связанных с фиксацией углерода, то крайне нетривиальным оказывается тот факт, что во всех представленных путях фиксации углерода мы можем найти общие фрагменты. Этот свойство позволяет нам предположить, что все современные способы фиксации углерода имеют части, исторически родственные (гомологичные) сходным частям из других циклов. Этот факт даёт в руки определённый способ построить гипотетическую сеть химических реакций, отдельные ячейки которых представляют собой близкие аналоги известных путей фиксации углерода в хемоавтотрофах.
Именно по этому пути пошли С.А. Маракушев и О.В. Белоногова, которые попытались построить и обосновать некую довольно конкретную автокаталитическую систему реакционных путей, отдельные части которых представляют собой архаичные аналоги современных метаболических путей фиксации углерда.
Таким образом, согласно, С.А. Маракушеву и О.В. Белоноговой уже в самом начале существования первых ЖС возможно было существование альтернативных реакций связывания углерода, которые давали возможность создать конкурирующие между собой метаболические сети.
Вспомним, что в статье Минеральные корни современных ферментов в качевте базового было сформулировано предположение о том, что реакции в этих метаболических сетях катализировались преимущественно минералами, хотя безусловно большую роль должны были играть те органические молекулы, которые с одной стороны синтезировались или абиогенно, или же, что очень важно, синтезировались уже в самих этих автотрофных метаболических сетях. Автокаталитичность реакций архаичного метаболизма таким образом, была обеспечена с одной стороны тем, что продукты в циклах накапливались (так как был процесс связывания, а не выделения СО2), а с другой стороны - тем, что многие органические молекулы, синтезируемые в этих циклах уже сами становились частью катализаторов этих циклов, причём в первую очередь как лиганды для минералов.
В качестве древнейших циклов авторы рассматривают 4: ВЦТК, 3-гидроксипропионатный цикл (3-ГП), 3-гидроксипропионатный/4гидроксибитуратный (3-ГП/4-ГП) и, наконец, восстановительный дикарбоксилатный/4-гидроксибитуратный (ВД/4-ГБ). Они отвергают древность и вторичность происхождения не только цикла Кальвина-Бенсона- восстановительного пентозофосфатного цикла, но и вопреки точке зрения Рассела, Мартина, Вехтерхойзера, Коди и др. также и ацетил-коэнзим А-пути (АКА) пути.
Обозначенный ими аргумент более позднего происхождения – фракционирование стабильных изотопов с высокими значениями доли изотопа углерода С13, является сомнительным, если принимать во внимание, в АКА пути, подобно другим путям фиксации углерода в современных организмах принимают участие белковые ферменты, участие которых должно было безусловно повлиять на эффективность изотопного фракционирования углерода в реакциях фиксации СО2, тогда как в рамках рассматриваемых моделей безусловно вполне аргументированная гипотеза первичности фиксации углерода по архаичному аналогу АКА пути подразумевает его катализ минеральными компонентами совместно с относительно простыми органическими лигандами, синтезированными абиогенно или же в рамках продуктов реакций, протекающих в этих архаичных путях фиксации углерода.
Сами авторы данной модели подчёркивают, что их архаичная метаболическая сеть, должна была катализироваться сходным путём.
В рамках моделей автотрофного термофильного происхождения жизни они предположили, что в первых ЖС функционировала автотрофная метаболическая сеть, которая могла быть представлена как комбинация сопряжённых между собой циклов – ВЦТК и 3-ГП, которые дали начало четырём указанным предположительно древнейшим путям фиксации углерода.
Для того, чтобы понять, как 4 различных представленных цикла могли сформировать метабиолическую сеть, рассмотрим каждый из них чуть подробнее и укажем в них общие пути. Первый из этих путей - ВЦТК - мы уже более-менее детально рассматривали в статье Реликтовые составляющие современного метаболизма. С чего он мог начаться? и фактически продолжили анализ этого цикла в первой части данной статьи. Тем не менее, для удобства дальнейшего рассмотрения изобразим этот цикл в виде двух половинок, ограниченных ацетил-СоА и сукцинил-СоА (рис. 6):
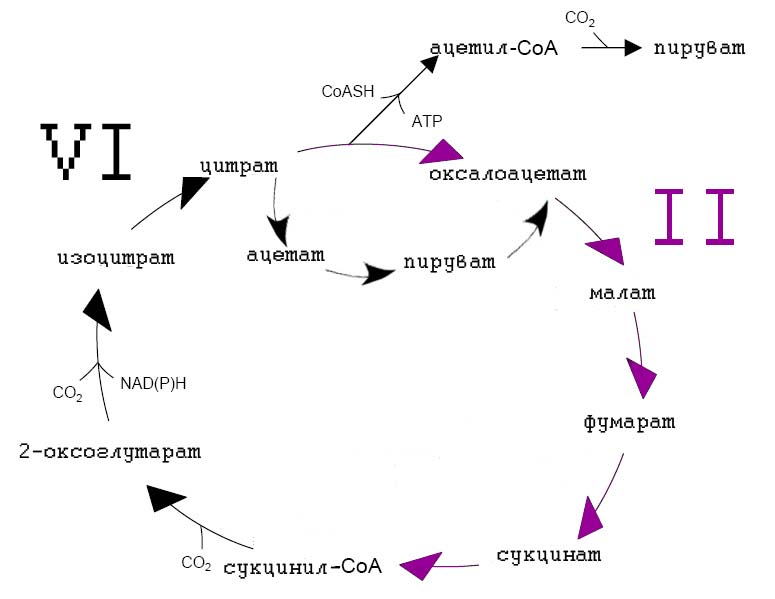
Рис. 6. Восстановительный цикл трикарбоновых кислот.
3-гидроксипропионатный цикл (3-ГП).
3-гидроксипропинатный цикл являетя непрямым способом восстановления ацетил-СоА через 3-гидроксипропионат и пропионил-СоА в сукцинил-СоА [Hügler M. et al., 2003; Ishii M. et al., 2004].
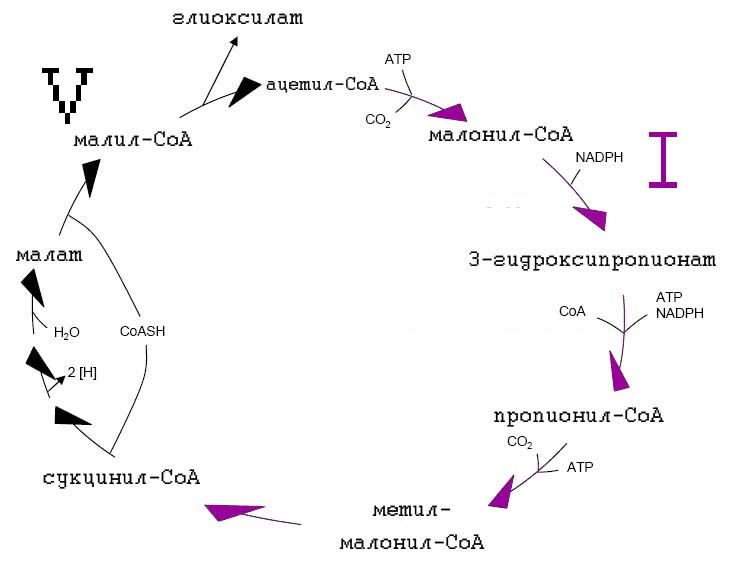
Рис. 7. 3-гидроксипропионатный путь (3-ГП). Двумя ключевыми ферментами являются малонил-CoA-редуктаза и пропионил-CoA синтаза.
Цикл первоначально был обнаружен в фототрофной бактерии Chloroflexus aurantiacus [Holo H., Sirevag R. 1986], а позднее был обнаружен у некоторых хемотрофных архей [Alber B.E., Fuchs G. 2002; Hügler M. et al., 2003; Berg I.A. et al. 2007].
Ключевыми ферментами являются малонил-СоА-редуктаза и пропионил-СоА-синтаза [Hügler M. et al., 2003]. Интересно, что ни один из ферментов этого цикла не является кислород-чувствительным [Thauer R.K. 2007].
3-гидроксипропионатный/4-гидроксибитуратный путь (3-ГП/4-ГБ).
Этот путь фиксации CO2 был описан совсем недавно [Berg I.A. et al. 2007]. Впервые он был найден в Metallosphaera sedula, микроорганизме, растущем на H2 and O2 как источнике энергии [Thauer P.K. 2007].
Чрезвычайно важным для нашего дальнейшего гипотетического построения архитектуры архаичных автотрофных циклов оказывается тот факт, что ключевые ферменты этого цикла обнаруживаются таких грпуппах, как Sulfolobus, Archaeoglobus и Cenarchaeum.
Этот нетривиальный факт говорит о том, то различные пути фиксации СО2 могут иметь родственные связи и общие корни.
Если сравнить интермедиаты 3-ГП/4-ГБ (рис. 4) с интермедиатами 3-ГП (рис. 3), то нетрудно заметить, что эти циклы имеют общие интермедиаты. В 3-ГП/4-ГБ отличается фрагмент цилка, от сукцинил-СоА до ацетил-СоА.
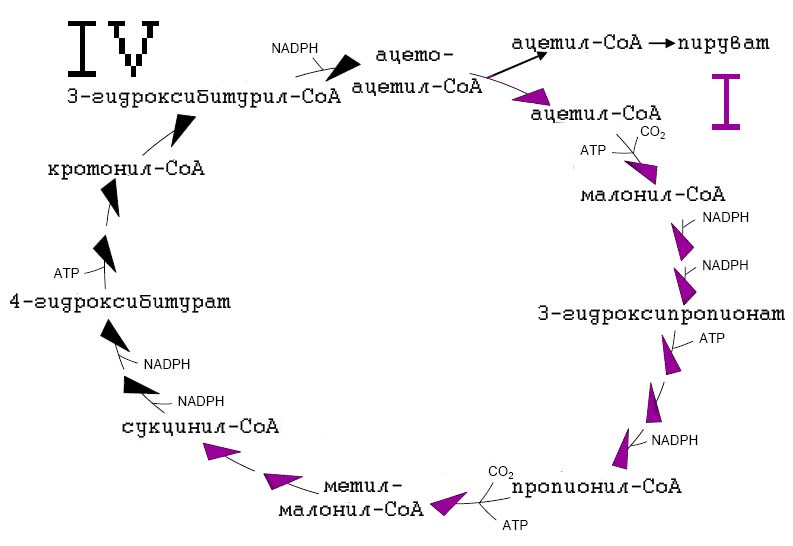
Рис. 8. 3-гидроксипропионатный/4-гидроксибитуратный цикл. Ключевыми являются два фермента, ответственные за фиксацию CO2: ацетил-СоА-карбоксилаза и пропионил-СоА-карбоксилаза.
Восстановительный дикарбоксилатный/4-гидроксибитуратный цикл (ВД/4-ГБ).
Этот новый способ фиксации СО2 был недавно обнаружен в анаэробной, гипертермофильной, облигатно автотрофной архее Ignicoccus hospitalis, и его встречаемость по-видимому ограничена Crenarchaeota [Huber H. et al. 2008].
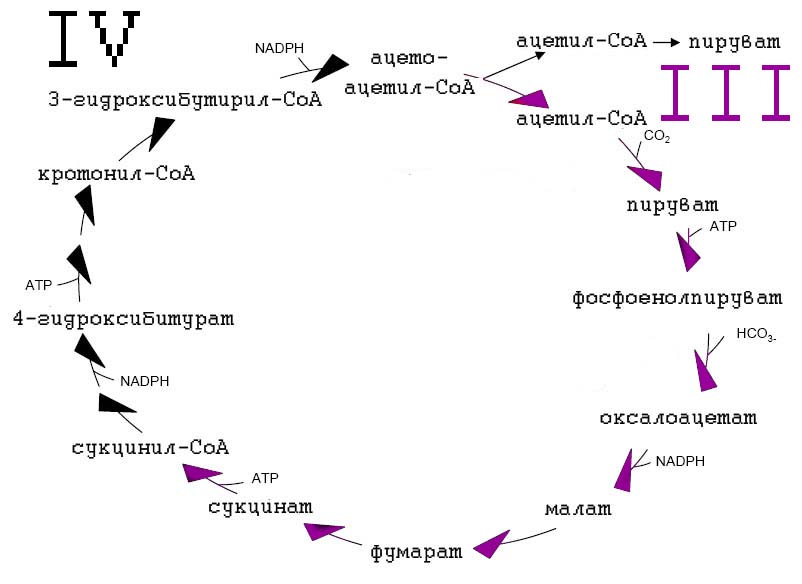
Рис. 9. Восстановительный дикарбоксилатный/4-гидроксибитуратный цикл (ВД/4-ГБ). Два фермента, ответственных за фиксацию CO2: пируват-синтаза и фосфоенолпируват-карбоксилаза.
У цикла ВД/4-ГБ есть общая часть в ВЦТК: оксалоацетат → малат → сукцинат. В 3-ГП цикле эта последовательность противоположна: сукцинат → фумарат → малат.
Если внимательно взглянуть на данные рисунки, то нетрудно увидеть, во-первых, что все они представлены в форме превращение от ацетил-СоА до сукцинил-СоА. Эти пути перенумерованы по отдельности. Во-вторых в некоторых циклах нетрудно заметить общие части. Этот нетривиальный факт может служить основой для построения общей гипотетической метаболической сети, в которой отдельные известные способы фиксации углерода являются результатом объедининия различных частей.
Что может быть причиной наличия общих ветвей в различных путях фиксации углерода?
Ответом на этот вопрос может служить предположение о единстве (не обязательно одновременности) происхождения этих различных способов. Метаболический фрагмент одного пути (цикла) фиксации СО2 мог стать основой для нового пути фиксации углерода, при появлении нового типа катализатора, фиксирующего углерод.
С.А. Маракушев и О.В. Белоногова, опираясь на общносmь частей различных способов фиксации углерода, построили обобщённую схему фиксации углерода (рис. 10), из которой попытались вывести гипотетическую архаическую метаболическую сеть, получившую название CAF (CO2 archaic fixation) и включавшую различные способы фиксации углерода, в рамках которой возможно была конкуренция различных фрагментов этой сети, приведшая к дальнейшей дарвиновской эволюции (рис. 11) [Маракушев С.А., Белоногова О.В. 2002, 2010a; Marakushev S.A., Belonogova O.V]. Реконструкция этой сети приведена на рис. 10.
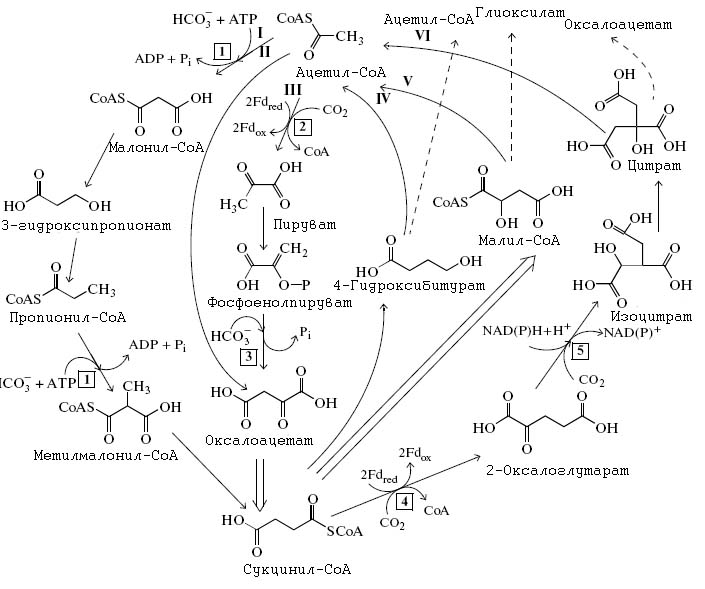
Рис. 10. Гипотетическая универсальная автотрофная метаболическая сеть. Римскими цифрами обозначены те последовательности реакций, из комбинаций которых можно получить современные 4 варианта фиксации углерода. Пунктирные линии обозначают продукты фиксации, высвобождаемые из цикла. Двойная стрелка обозначает сокращённо последовательность обратимых реакций превращения малат ↔ фумарат ↔ сукцинат
Рисунок адаптирован из [Маракушев С.А., Белоногова О.В. 2010а].
Данная сеть является автокаталитической, поскольку отдельные циклы приводят к удвоению продуктов реакции: один оборот ВЦТК, ВД/4-ГБ и 3-ГП/4-ГБ приводит к связыванию двух молекул СО2 и образованию одной молекулы ацетил-СоА (или ацетата), тогда как один оборот 3-ГП-цикла приводит к образованию одной молекулы глиогсилата.
Тогда возникает вопрос относительно того, на какой стадии формирования жизни могли возникнуть эти новые альтернативные пути.
Эти стадии можно разбить по крайней мере на три:
1. На стадии до появления РНК-белкового мира. В этом случае основными катализаторами таких архаичных циклов фиксации углерода должны были стать минеральные катализаторы, возможно совместно с органическими молекулами, являющихся продуктами этих циклов, являвшихся или лигандами, связанными с минеральными катализаторами, или же отдельными самостоятельными катализаторами (что в свете известных в настоящее время фактов менее правдоподобно). Именно этой точки зрения придерживаются С.А. Маракушев и О.В. Белоногова и в рамках этого предположения они построили гипотетическую архаическую метаболическую сеть CAF (CO2 archaic fixation), схема которой приведена на рис. 11.
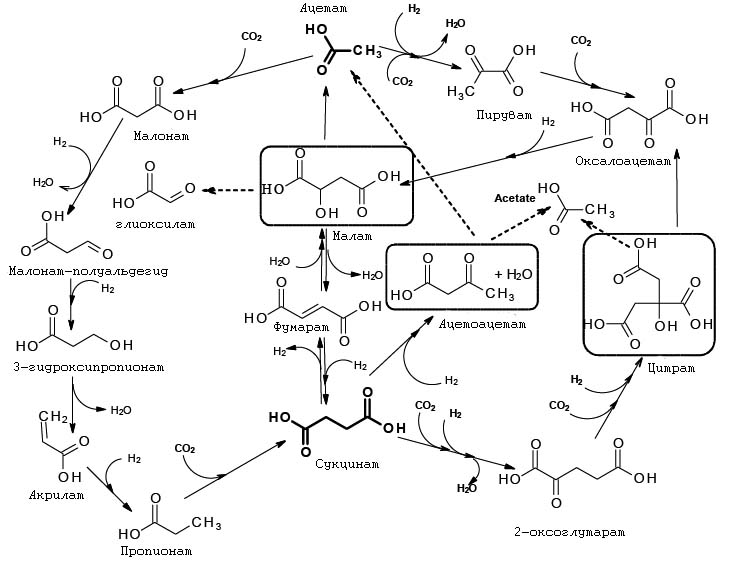
Рис. 11. Гипотетическая схема архаичной фиксации углерода (CAF). Рисунок адаптирован из [Маракушев С.А., Белоногова О.В. 2010а]. Пунктирные линии обозначают продукты фиксации, высвобождаемые из цикла и потенциально служащие в качестве исходных веществ для дальнейших (в первую очередь анаболических) процессов биосинтеза. Обведены метаболиты, завершающие циклы: малат распадается на ацетат и глиоксилат, цитрат - на оксалоацетат и ацетат, ацетоацетат (поглощая молекулу воды) - на два ацетата.
Авторы модели ставят под сомнение первичность фиксации углерода с помощью рассмотренного выше образования активированного тиоэфира CH3CO~SCH3 из CH3SH и СО.
В качестве альтернативы для первичного двигателя этих циклов и источников энергии авторы предлагают и обосновывают другой путь образования активированных тиоэфиров органических кислот - включение в реакцию углеводородов и молекулярного водорода, которые являются более типичными представителями щелочных гидротерм. Сами алкилтиолы могли бы образовываться в гидротермах из алекнов взаимодействием с сероводородом.
Тиоэфиры органических кислот могут включаться в САF-цикл, и таким образом, стать одним из "горючих", двигавших данные циклы, и возможно катализаторами реакций этих циклов.
Первичность этих путей должна подразумевать определённое разнообразие минеральных катализаторов (вместе с органическими лигандами), что, однако до сих пор требует экспериментального подтерждения.
2. Возникновение и эволюцию данных циклов можно также рассматривать и на стадии РНК-олигонуклеотидного мира. Учитывая, что во всех путях требуются рибонуклеотиды в качестве кофакторов, данная стадия является уже вполне допустимой, поэтому в данном случае уместно рассматривть не сам САF-цикл, а его более современный вариант с нуклеотидными инетрмедиатами, кофакторами и продуктами. В этом случае также возможна конкуренция между различными вариантами метаболической сети и последующая дарвиновская эволюция.
3. На стадии РНК-белкового мира. В этом случае ключевыми катализаторами могли быть не только и не столько минеральные образования (вместе с органическими лигандами), но и в первую очередь компоненты молекул РНК (безусловно всевозможные РНК-кофакторы и сами рибозимы), а также пептиды или белки. Поскольку на этой стадии был возможен уже не только полный набор инетермедиатов, но и белковых и белково-минеральных катализаторов (быть может занимающих промежуточное положение между современными белками с кодируемоей ДНК-генами структурами и комлексов минералов с олигопептидами и (или) другими кофакторами и лигандами).
Тогда эти циклы должны были присутствовать у LUCА, являвшегося не просто последним универсальным общим предком, но и прежде всего коллективным организмом, у которого различные вариации метаболизма, включавшего в том числе различные способы фиксации углерода, могли проявляться в пространственно разобщённых различных условиях.
Таким образом, согласно, С.А. Маракушеву и О.В. Белоноговой уже на ранних этапах эволюции первых ЖС возможно было существование альтернативных реакций связывания углерода, которые давали возможность создать, во-первых, конкурирующие между собой части метаболические сети, а во-вторых повышать устойчивость этой сети к внешним воздействиям.
Последнее допущение обусловлено тем, что при наличии множества альтернативных способов фиксации углерода возмножна не только (и не столько изоляция) метаболических сетей с различными способами фиксации углерода, сколько их взаимное коллективное сосуществование, в частности взаимное анаплеротическое влияние. (Каталитические процессы, пополняющие запас промежуточных продуктов цикла, называются анаплеротическими (возмещающими) реакциями).
Ключевыми анаплеротическими интермедиатами становятся ацетат и сукцинат (или ацетил-СоА и сукцинил-СоА).
В такого рода сети запас промежуточных продуктов одних циклов может существенно зависеть от протекания других циклов, и, таким образом, между различными альтернативными метаболизмами могли бы быть не только отношения конкуренции, но и объединения их в гиперциклы более высокого порядка.
Включение новых реакционных циклов фиксации углерода в автотрофный архаичный метаболизм в каком-то смысле аналогично появлению принципиально новой разновидности ЖС, которые потенциально могли бы даже мало зависеть от родительских форм метаболизма, поскольку имеют своё главное ключевое свойство, дающее им независимость от других разновидностей - свой способ фиксации углерода.
Таким образом, данную метаболическую сеть вполне уместно рассматривать в качестве структуры, носящей о себе информацию (конформационный геном) и способную дарвиновски эволюционировать.
Резюме.
Вначале появились простейшие способы фиксации углерода, которые стали основой первых автокаталитических химических реакций, в результате которых была возможна наработка интерметидатов этих циклов. К кандидатам такого рода реакций на простйшие циклы можно отнести ацил-тиоэфиры, образованные в результате взаимодействия на железо-никелевых катализаторах 2CH3SH + CO или же альтернативно различные тиоэфиры органических кислот, образованные из углеводроводородов горячих гидротерм. Эти тиоэфиры запустили один или же несколько циклов фиксации углеорода, образовавших эволюционирующаю метаболическую сеть. Эти первые эволюционирующие метаболические сети и представляли собой первые ЖС.
Вполне вероятно, что такого рода реакции дали начало ВЦТК, архаический аналог которого также должен был возникнуть до появления нуклеотидов, поскольку именно он является биосинтетической базой для синтеза аминокислот, нуклеотидов и липидов.
Архаичные аналоги АКА пути и ВЦТК дали начало рибонуклеотидному миру, в котором уже возникли и получили дальнейшую эволюцию более современные варианты АКА пути и ВЦТК, а также возможно и других путей фиксации углерода - 3-ГП, ВД/4-ГБ, 3-ГП/4-ГБ. Эти пути эволюционировали также в виде метаболической сети.
Менее вероятным (хотя и возможным) выглядит появления архаичных аналогов 3-ГП, ВД/4-ГБ, 3-ГП/4-ГБ уже до возникновения биосинтеза нуклеотидов, требующее существенно большего разнообразия как протоферментативной базы, так и замены нуклеотидных кофакторов на более простые аналоги.
Постепенный переход к РНК-полимерам дал возможность резко усилить разнообразие и эффективность катализаторов, после чего всё большую роль в дарвиновской эволюции стал играть отбор РНК-геномов, хотя роль конформационных геномов как единиц дарвинвоского отбора сохраналась по видимому вплоть до начала дивергенции, то есть перехода к миру ДНК.
Литература.
Маракушев С.А., Белоногова О.В.
Маракушев С.А., Белоногова О.В. Эволюция архаической хемоавтотрофной системы фиксации двуокиси углерода в гидротермальных системах. // Доклады Академии Наук. 2010б. №2. С.262-268.
Alber B.E., Fuchs G. Propionyl-coenzyme A synthase from Chloroflexus aurantiacus, a key enzyme of the 3-hydroxypropionate cycle for autotrophic CO2 fixation. // J Biol Chem. 2002. V.277. P.12137-12143.
Berg I.A., Kockelkorn D., Buckel W., Fuchs G. A 3-hydroxypropionate/4-hydroxybutyrate autotrophic carbon dioxide assimilation pathway in Archaea. // Science. 2007. V.318. P.1782 - 1786.
Cody G.D., Boctor N.Z., Hazen R.M., Brandes J.A., Morowitz H.J., Yoder H.S. Geochemical roots of autotrophic carbon fixation: hydrothermal experiments in the system citric acid, H2O–(7FeS)–(7NiS). // Geochim. Cosmochim. Acta 2001. V.65. P.3557–3576.
Evans, M.C., Buchanan, B.B., Arnon, D.I. A new ferredoxin-dependent carbon reduction cycle in a photosynthetic bacterium. // Proc Natl Acad Sci USA. 1966. V.55. P.928-934.
Fuchs G. CO2 fixation in acetogenic bacteria: variations on a theme. // FEMS Microbiol Rev. 1986. V.39. P.181-213.
Holo H., Sirevag R. Autotrophic growth and CO2 fixation of Chloroflexus aurantiacus. // Arch Microbiol. 1986. V.145. P.173-180.
Huber H., Gallenberger M., Jahn U., Eylert E., Berg I.A., Kockelkorn D. et al. A dicarboxylate/4-hydroxybutyrate autotrophic carbon assimilation cycle in the hyperthermophilic Archaeum Ignicoccus hospitalis. // Proc Natl Acad Sci USA. 2008. V.105. P.7851-7856.
Hügler M. Autotrophe CO2-Fixierung in thermophilen Mikroorganismen. Freiburg: Albert-Ludwigs-Universität Freiburg i. Br., 2003. P.127.
Ishii M., Chuakrut S., Arai H., Igarashi, Y. Occurrence, biochemistry and possible biotechnological application of the 3-hydroxypropionate cycle. // Appl Microbiol Biot. 2004. V.64. P.605-610.
Kellermann С.S. Autotrophy in Groundwater Ecosystems.
Kinkle B.K., Kane T.C. Chemolithoautotrophic micro-organisms and their potential role in subsurface environments. In Ecosystems of the World. Wilkens, H., Culven, D.C., and Humphreys, W.F. (eds). Amsterdam: Elsevier, 2000. P.309-318.
Marakushev S.A., Belonogova O.V.
Marakushev S.A., Belonogova O.V. The parageneses thermodynamic analysis of chemoautotrophic CO2 fixation archaic cycle components, their stability and self-organization in hydrothermal systems. // J. Theor. Biol. 2009. V. 257. P. 588–597
Peretó J.G., Velasco A.M., Becerra A., Lazcano A. Comparative biochemistry of CO2 fixation and the evolution of autotrophy. // Internatl. Microbiol. 1999. V.2. P.3-10.
Thauer R.K. A Fifth Pathway of Carbon Fixation. // Science. 2007. V.318. P.1732-1733.
Weiss D.S., Thauer R.K. Methanogenesis and the unity of biochemistry. // Cell. 1993. V.72. P.819–822.
Wood H.G., Ragsdale S.W., Pezacka E. CO2 fixation into acetyl-CoA: a new pathway of autotrophic growth. // Trends Biochem Sci. 1986. V.11. P.14-18.
Статьи, связанные с темой
Автотрофное термофильное происхождение жизни
Минеральные корни современных ферментов
Реликтовые составляющие современного метаболизма. С чего он мог начаться?
Что было первым: метаболизм или ген? Могла ли жизнь начаться как циклическая химическая реакция неполимерных молекул?
Список публикаций >>